苯并[b]荧蒽对大鼠肺泡巨噬细胞的氧化损伤效应
2018-05-21张丽凤魏海英张云芸
张丽凤,魏海英,张云芸
(山西大学 环境与资源学院,山西 太原 030006)
0 引言
多环芳烃(PAHs) 是一类在环境中广泛存在的有机污染物,主要由煤炭、石油、木材、塑料等高分子有机材料的不完全燃烧产生[1],是空气污染的重要污染源之一。在多项研究中发现,大气细颗粒物中PAHs的主要成分之一是苯并[b]荧蒽(Benzo[b]fluoranthene)[2-5]。苯并[b]荧蒽是具有5个苯环的典型PAHs化合物,致癌性极强[6],常常作为一种PAHs环境暴露指标[7]。
肺泡巨噬细胞(Alveolar macrophages,AM)是肺脏重要的功能细胞,是肺部的第一道功能屏障,对维持机体正常的生理活动有着重要作用[8-9]。大气中的颗粒物会到达肺泡被AM摄取[10],沉积在肺中的颗粒或颗粒上携带的可溶性毒物的相互作用,会导致炎症而损害AM吞噬活性[11-12]。
关于PM2.5对肺泡巨噬细胞的毒性作用课题组已经做了大量的研究,主要包括沙尘暴PM2.5、灰霾PM2.5对肺泡巨噬细胞的毒性作用以及毒理机制的研究等,结果表明PM2.5会对AM造成一定的氧化损伤,并使其细胞膜通透性增加,PM2.5还会造成AM线粒体融合分裂的异常[13-16]。已有研究结果多为PM2.5混合成分的毒性作用,而哪些成分起主要作用尚不清楚。课题组对太原市不同季节PM2.5化学成分分析发现,冬季和夏季PM2.5中苯并[b]荧蒽含量分别为16.3 ng·m-3 [17]和12.5 ng·m-3,为PM2.5中PAHs类最高,我们推测苯并[b]荧蒽对PM2.5毒性具有较大的贡献率,但具体机制尚不清楚。因此,本研究拟以苯并[b]荧蒽为研究对象,采用体外细胞培养及染毒方法对AM进行暴露,暴露后测定AM中的抗氧化酶(超氧化物歧化酶、谷胱甘肽)活性以及脂质过氧化物丙二醛和活性氧含量变化,初步探讨苯并[b]荧蒽暴露对大鼠 AM 的氧化损伤作用,从而为PAHs毒性机理提供新的理论依据。
1 材料和方法
1.1 实验试剂与仪器
实验试剂:RPMI-1640培养基,考马斯亮蓝 G-250、小牛血清、0.18%胰蛋白酶、牛血清蛋白(BSA)、四甲基偶氮唑盐(MTT),二甲基亚砜(DMSO)、ROS检测试剂盒、MDA 试剂盒、SOD 试剂盒、GSH 试剂盒,苯并[b]荧蒽母液(5 mg·mL-1甲醇)。
实验仪器:低温高速离心机、细胞恒温培养箱、TU-1810 紫外可见分光光度计(北京普析通用仪器公司)、Accuri C6流式细胞仪(BD,美国)、酶标仪、 HZQ-F100 振荡培养箱。
1.2 大鼠肺泡巨噬细胞的提取和培养
每次实验选取4只体重为220 g~250 g 的SPF 级雄性Wistar大鼠,每只腹腔注射1.0 mL的质量体积比为1%戊巴比妥钠进行全身麻醉,然后腹主动脉放血致死,打开大鼠胸腔,使用灭菌后的磷酸盐缓冲液 (PBS,pH=7.0)灌洗双肺,收集肺泡灌洗液(BLAF),将BLAF于4℃、3 000 r·min-1离心 10 min,弃上清液,用含质量体积比10% 小牛血清的 RPMI1640 培养液洗涤沉淀两次,制成细胞悬浮液,使用台盼蓝拒染法计数,然后进行稀释,将细胞稀释液(2×106~3×106个·mL-1)分装于细胞培养皿中,每皿3 mL,置于细胞培养箱中37℃、质量体积比5%CO2培养2 h后,除去原培养液,用PBS轻轻洗涤1~2次,去除非贴壁的细胞和原培养液成分,贴壁的肺泡巨噬细胞纯度大于95%[18],备用。
1.3 AM存活率的测定
采用MTT分析法测定AM存活率。将细胞悬液稀释为浓度1×105个·mL-1~2×105个·mL-1, 以每孔100 μL细胞悬液添加到96孔培养板中,贴壁2 h后,除去培养液,每孔添加不同浓度的(20 nmol·L-1、40 nmol·L-1、60 nmol·L-1、80 nmol·L-1、100 nmol·L-1)苯并[b]荧蒽,同时设置对照组,每个浓度组设6 个平行。24 h染毒后,除去染毒液,每孔加100 μL培养液和20 μL MTT(5 mg·mL-1) 继续在37℃细胞培养箱培养4 h,然后去上清液,将每孔添加150 μL DMSO,室温下振荡10 min,直至蓝紫色结晶全部溶解,将液体平行转移到另一96孔板中,用酶标仪上在490 nm波长处测 OD值,计算细胞的相对存活率。
1.4 生物学指标的测定
染毒24 h后,除去培养液,用PBS清洗后,胰蛋白酶消化收集细胞,进行生物学指标的测定。
蛋白含量测定:以牛血清白蛋白为标准溶液(1 mg·mL-1),作蛋白含量0 μg、10 μg、20 μg、30 μg、40 μg、50 μg、60 μg的标准曲线,采用考马斯亮蓝法,于 595 nm 波长下测其吸光值。
1.4.1 GSH、SOD及MDA的测定
SOD活性采用试剂盒测定,在酶标仪550 nm处测定其吸光值,每毫克蛋白在1 mL反应液中SOD抑制率达到50%时对应的SOD的量为一个SOD活力单位,总SOD活力(U·mg-1prot)表示细胞抗氧化能力。
GSH活性采用试剂盒测定,在412 nm处测定吸光值,以单位蛋白质中GSH的活性(nmol·mg-1prot)表示细胞的抗氧化能力。
MDA含量采用试剂盒测定,严格按照试剂盒步骤进行,其最大吸收波长在532 nm,以单位蛋白质中MDA的含量(nmol·mg-1prot)表示细胞脂质过氧化程度。
1.4.2 ROS的测定
AM细胞内的活性氧(ROS)水平采用DCFH-DA(二氯二氢荧光素-乙酰乙酸酯)测定。将AM贴壁2 h后转移至于2 mL EP管中,使用PBS清洗1次。将DCFH-DA用无血清培养液按照1∶2 500的比例稀释,将稀释的DCFH-DA工作液添加到EP管中,每管1 mL,于37℃培养箱孵育25 min后,以3 000 rmin-1离心10 min后,使用PBS清洗3次。添加不同浓度的苯并[b]荧蒽染毒液对细胞进行染毒24 h,并且提前30 min对阳性对照管添加Rosup刺激物,24 h后,打匀细胞,过滤(200目),用流式细胞仪检测ROS,检测的荧光强度可反映细胞内ROS水平。
1.5 统计方法
采用SPSS11.5软件对数据进行分析,用单因素方差分析检验组间的差异显著性(*P<0.05,**P<0.01),用 Origin 8.0 完成制图与分析,实验数据以平均值±标准误差(Mean±SD)表示。
2 结果与分析
2.1 苯并[b]荧蒽的细胞毒性
如图1所示,随着苯并[b]荧蒽染毒浓度的增加,AM存活率呈下降趋势,相对于对照组,低浓度(20 nmol·L-1) 组细胞存活率虽有下降,但并不显著,当染毒浓度大于40 nmol·L-1时,细胞存活率显著降低(p<0.05,p<0.01),对较高浓度组(80 nmol·L-1、100 nmol·L-1) 而言,AM 存活率下降极显著,这表明苯并[b]荧蒽具有很强的细胞毒性。
2.2 不同浓度苯并[b]荧蒽对AM中SOD和GSH的影响
苯并[b]荧蒽暴露24 h后,AM细胞中SOD活性呈剂量依赖性显著降低(P<0.01)(图2A),高浓度组苯并[b]荧蒽对SOD活力表现出极强的抑制作用。如图2B所示,随着苯并[b]荧蒽浓度的增加,GSH的含量呈递减趋势,当染毒浓度大于40 nmol·L-1时,与对照相比,GSH含量显著(P<0.01)降低,但在染毒浓度为 20 nmol·L-1时,并无显著差异。
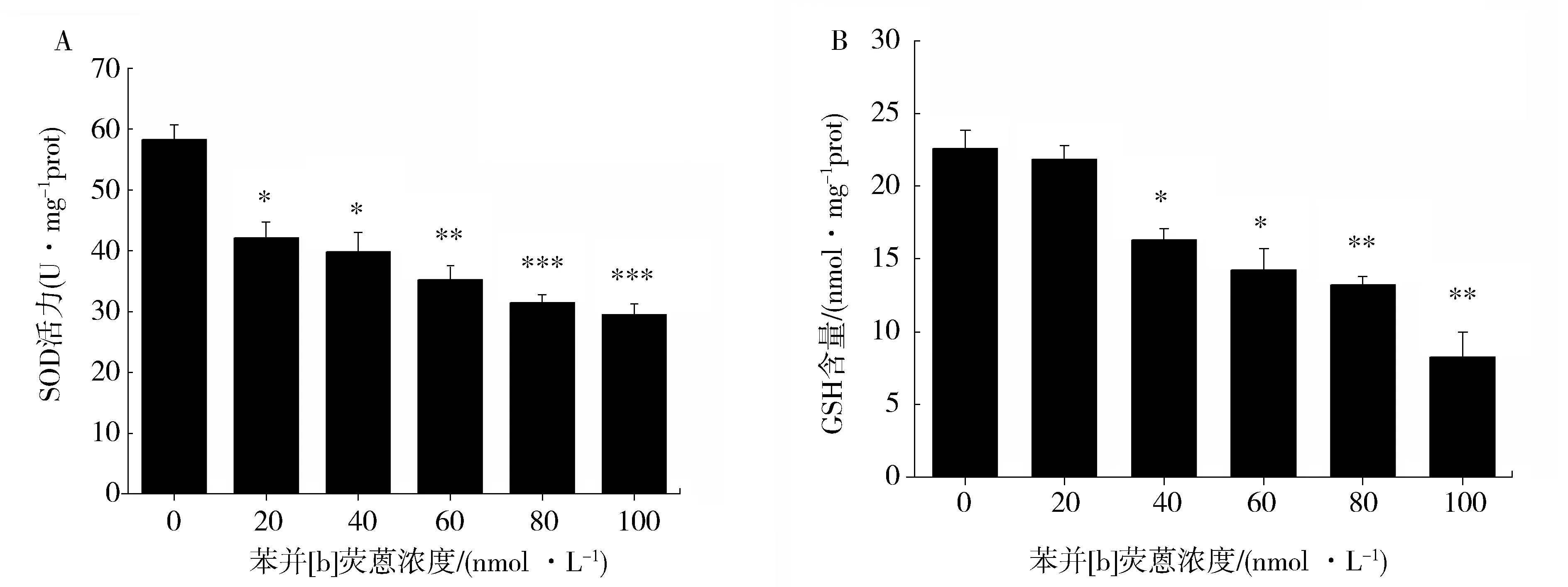
Fig.2 Effect of benzo[b]fluoranthene on the activity of SOD (A) and thecontent of GSH (B) in AM.(*P<0.05,**P<0.01,vs control,n=6)图2 苯并[b]荧蒽 对AM中SOD活力(A)和GSH含量(B)的影响 (与对照组相比,*P<0.05,**P<0.01,n=6)
2.3 不同浓度苯并[b]荧蒽对AM中MDA的影响
从图3可以看到,随着苯并[b]荧蒽浓度的升高,AM中MDA 的含量逐渐增高,染毒浓度较低时,苯并[b]荧蒽对MDA的作用并不显著,当苯并[b]荧蒽的浓度超过60 nmol·L-1时,MDA的含量显著上升,表明苯并[b]荧蒽引起了AM的脂质过氧化。
2.4 苯并[b]荧蒽诱导ROS的生成
经苯并[b]荧蒽染毒后的AM细胞中,ROS的含量随苯并[b]荧蒽的浓度的升高而增加(图4),当染毒浓度大于40 nmol·L-1时,ROS的含量极显著增加(P<0.01)。高浓度处理时,ROS的含量与对照相比差异极显著(P<0.01)。
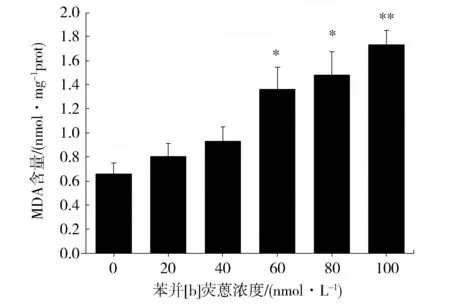
Fig.3 Effects of benzo[b] fluoranthene on the content ofMDA in AM. (*P<0.05,**P<0.01 vs control,n=6)图3 苯并[b]荧蒽对AM中MDA含量的影响(与对照组相比,*P<0.05,**P<0.01 n=6)
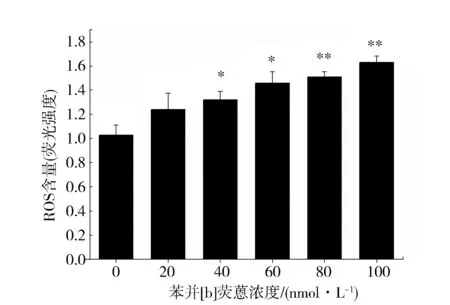
Fig.4 Effects of benzo[b]fluoranthene on ROS generationin AM.(*P<0.05,**P<0.01 vs control n=6)图4 苯并[b]荧蒽对AM中ROS的影响(与对照组相比,*P<0.05,**P<0.01,n=6)
3 分析讨论
PM2.5的毒性与其成分是密切相关的[19-20]。在对PM2.5样品的成分分析发现,有机物中苯并[b]荧蒽浓度是相对较高的,本研究以苯并[b]荧蒽为研究对象,探讨了其对巨噬细胞的氧化损伤作用,结果表明苯并[b]荧蒽具有显著的细胞毒性。
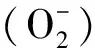
综上所述,苯并[b]荧蒽有很强的细胞毒性,浓度依赖性诱导肺泡巨噬细胞SOD活性和GSH含量降低以及ROS和MDA水平升高。苯并[b]荧蒽对AM毒性的可能机制是,苯并[b]荧蒽通过诱导肺泡巨噬细胞中ROS的形成,降低抗氧化防御系统的抗氧化功能,引起细胞脂质过氧化,从而使细胞受到损伤,当这种损伤超过细胞自复能力时引起细胞死亡。
参考文献:
[1] Smith D J T,Harrison R M.Concentrations,Trends and Vehicle Source Profile of Polynuclear Aromatic Hydrocarbons in the U.K.Atmosphere[J].AtmosphericEnvironment,1996,30(14):2513-2525.DOI:10.1016/1352-2310(95)00474-2.
[2] 孟川平,杨凌霄,董灿,等.济南冬春季室内空气PM_(2.5)中多环芳烃污染特征及健康风险评价[J].环境化学,2013(5):719-725.DOI:10.7524/j.issn.0254-6108.2013.05.001.
[3] Deng X,Zhang F,Rui W,etal.PM2.5-induced Oxidative Stress Triggers Autophagy in Human Lung Epithelial A549 Cells[J].ToxicologyinVitro,2013,27(6):1762-1770.DOI:10.1016/j.tiv.2013.05.004.
[4] Chen Y,Li X,Zhu T,etal.PM2.5-bound PAHs in Three Indoor and One Outdoor air in Beijing:Concentration,Source and Health Risk Assessment[J].ScienceoftheTotalEnvironment,2017,586:255-264.DOI:10.1016/j.scitotenv.2017.01.214.
[5] 赵静波,姬亚芹,单春艳,等.鞍山市城区夏季PM2.5中多环芳烃组成特征及来源解析[J].环境污染与防治,2015,37(11):72-75.DOI:10.15985/j.cnki.1001-3865.2015.11.014.
[7] Aubin S,Farant J P.Benzo[b]Fluoranthene,a Potential Alternative to Benzo[a]Pyrene as an Indicator of Exposure to Airborne PAHs in the Vicinity of Söderberg Aluminum Smelters[J].AirRepair,2000,50(12):2093-2101.DOI:10.1080/10473289.2000.10464236.
[8] Draijer C,Petersgolden M.Alveolar Macrophages in Allergic Asthma: the Forgotten Cell Awakes.[J].CurrentAllergy&AsthmaReports,2017,17(2):49-52.DOI:10.1007/s11882-017-0681-6.
[9] Kumar R K.Cytokines of the Lung[J].AmericanReviewofRespiratoryDisease,1990,142(5):765-788.DOI:10.1164/ajrccm/142.5.1234.
[10] Wilson M R,Lightbody J H,Donaldson K,etal.Interactions Between Ultrafine Particles and Transition Metals in Vivo and in Vitro[J].Toxicology&AppliedPharmacology,2002,184(3):172-179.DOI:10.1006/taap.2002.9501.
[11] Becker S,Soukup J M.Decreased CD11b Expression,Phagocytosis,and Oxidative Burst in Urban Particulate Pollution-exposed Human Monocytes and Alveolar Macrophages[J].JToxicolEnvironHealthA,1998,55(7):455-477.DOI:10.1080/009841098158278.
[12] Goulaouic S,Foucaud L,Bennasroune A,etal.Effect of Polycyclic Aromatic Hydrocarbons and Carbon Black Particles on Pro-inflammatory Cytokine Secretion:Impact of PAH Coating Onto Particles[J].JournalofImmunotoxicology,2008,5(3):337-345.DOI:10.1080/15476910802371016.
[13] 耿红,孟紫强,张全喜.沙尘暴PM2.5水溶和有机成分对巨噬细胞的损伤[J].中国环境科学,2006,26(1):20-24.DOI:10.3321/j.issn:1000-6923.2006.01.005.
[14] 宋姗娟.灰霾PM2.5对肺泡巨噬细胞的毒性作用研究[D].太原:山西大学,2014.
[15] 刘婷.冬季灰霾PM2.5对肺泡巨噬细胞的毒理机制研究[D].太原:山西大学,2015.
[16] 刘婷,魏海英,杨文妍,等.太原市冬季灰霾天气大气PM_(2.5)对肺泡巨噬细胞的氧化损伤作用[J].环境科学学报,2015,35(3):890-896.DOI:10.13671/j.hjkxxb.2014.1000.
[17] Li R J,Kou X J,Geng H,etal.Pollution Characteristics of Ambient PM2.5-bound PAHs and NPAHs in a Typical Winter Time Period in Taiyuan[J].ChineseChemicalLetters,2014,25(5):663-666.DOI:10.1016/j.cclet.2014.03.032.
[18] 耿红,孟紫强,张全喜,等.沙尘暴细颗粒物对大鼠肺泡巨噬细胞钙水平和脂质过氧化的影响[J].环境科学学报,2005,25(6):845-850.DOI:10.3321/j.issn:0253-2468.2005.06.023.
[19] Ghio A J,Carraway M S,Madden M C.Composition of Air Pollution Particles and Oxidative Stress in Cells,Tissues,and Living Systems[J].JournalofToxicology&EnvironmentalHealthPartBCriticalReviews,2012,15(1):1-21 DOI:10.1080/10937404.2012.632359.
[20] 焦周光,付绪磊,温占波,等.北京大气PM_(2.5)对A549细胞炎性因子及DNA损伤的毒性[J].中国环境科学,2016,36(5):1579-1588.DOI:969/j.issn.1000-6923.2016.05.045.
[21] 丁书茂,杨旭.超氧化物歧化酶及其模拟化合物研究进展[J].高等继续教育学报,2004,17(1):1-5.DOI:10.3969/j.issn.1006-7353.2004.01.001.
[22] 王君明,崔瑛,王峥涛,等.超氧化物歧化酶参与肝损伤的研究进展[J].中国实验方剂学杂志,2011,17(7):265-269.DOI:10.3969/j.issn.1005-9903.2011.07.082.
[23] Lushchak V I.Glutathione Homeostasis and Functions:Potential Targets for Medical Interventions[J].JournalofAminoAcids,2012,2012(5):736837.DOI:10.1155/2012/736837.
[24] Trevisan M,Browne R,Ram M,etal.Correlates of Markers of Oxidative Status in the General Population[J].AmericanJournalofEpidemiology,2001,154(4):348-356.DOI:10.1093/aje/154.4.348.
[25] 宋姗娟,魏海英,刘婷等.菲对肺泡巨噬细胞的毒性作用[J].环境化学,2014(4):551-555.DOI:10.7524/j.issn.0254-6108.2014.04.011.
[26] Koca H,Bor M,Özdemir F,etal.The Effect of Salt Stress on Lipid Peroxidation,Antioxidative Enzymes and Proline Content of Sesame Cultivars[J].Environmental&ExperimentalBotany,2007,60(3):344-351.DOI:10.1016/j.envexpbot.2006.12.005.
[27] 陈海刚,马胜伟,林钦,等.氯化三丁基锡对黑鲷鳃和肝组织SOD、MDA和GPx的影响[J].南方水产科学,2009,5(2):23-27.DOI:10.3969/j.issn.1673-2227.2009.02.004.
[28] Geng H,Meng Z,Zhang Q.Effects of Blowing Sand Fine Particles on Plasma Membrane Permeability and Fluidity,and Intracellular Calcium Levels of Rat Alveolar Macrophages[J].ToxicologyLetters,2005,157(2):129-137 DOI:10.1016/j.toxlet.2005.01.010.
[29] Pamplona R,Costantini D.Molecular and Structural Antioxidant Defenses Against Oxidative Stress in Animals[J].AmericanJournalofPhysiologyRegulatoryIntegrative&ComparativePhysiology,2011,301(4):843-863.DOI:10.1152/ajpregu.00034.2011.
[30] Azad M B,Chen Y,Gibson S B.Regulation of Autophagy by Reactive Oxygen Species (ROS):Implications for Cancer Progression and Treatment[J].Antioxidants&RedoxSignaling,2009,11(4):777-790.DOI:10.1089/ars.2008.2270.
[31] 黄雷招,唐德燊.活性氧簇及其介导的自噬[J].医学综述,2012,18(19):3160-3163.DOI:10.3969/j.issn.1006-2084.2012.19.006.
