亚洲玉米螟细胞色素P450还原酶基因的克隆与表达分析
2018-05-21康晓林李涛刘晓健范云鹤于朱珠张学尧
康晓林,李涛,刘晓健,范云鹤,于朱珠,张学尧*
(1.山西大学 应用生物学研究所,山西 太原 030006;2.山西大学 生命科学学院,山西 太原 030006;3.山西大学 环境与资源学院,山西 太原 030006)
0 引言
亚洲玉米螟(Ostriniafurnacalis)属于鳞翅目,冥蛾科害虫[1],食性较杂,主要危害高粱、玉米、谷子、扁豆、棉花和生姜等至少20余种农作物。在我国除青藏高原玉米产区未见报道外,广泛分布于我国南北玉米主产区,是我国玉米生产的主要农业害虫之一。
昆虫细胞色素P450是一类含亚铁血红素的酶系[2]。该酶系广泛参与昆虫保幼激素和蜕皮激素的合成[3]、表皮碳氢化合物的合成[4]、气味化合物降解[5],以及农药与植物次生代谢物[6]的代谢等多种生理过程。细胞色素P450还原酶(Cytochrome P450 reductase,CPR),是细胞色素P450酶系中电子传递链的重要组分,它接收来自NADPH的电子,经由FAD和FMN转移到细胞色素P450的铁卟啉基团上的铁原子[7],在细胞色素P450酶的催化过程中起关键作用。此外,昆虫细胞色素P450还原酶还可为血红素氧化酶(haem oxygenase)和细胞色素b5(cytochrome b5)提供电子[8]。
每个昆虫基因组仅含有一个细胞色素P450还原酶基因。自Koener等首次克隆到家蝇CPR基因以来[9],目前已在至少21种昆虫中克隆得到CPR基因全长。CPR基因的表达上调与昆虫抗药性密切相关;稻飞虱(Laodelphaxstriatellus)[10]和柑橘小实蝇(Bactroceradorsalis)[11]的抗药性品系与敏感品系相比,CPR表达明显提高;RNA沉默昆虫CPR后亦会导致昆虫对杀虫剂敏感性提高。昆虫CPR被认为是新型杀虫剂研发的理想靶标,已有学者对其进行了大量研究。然而,目前还未见关于亚洲玉米螟细胞色素P450还原酶基因的克隆及功能研究的报道。
本文以亚洲玉米螟为研究对象,利用RT-PCR技术克隆到亚洲玉米螟细胞色素P450还原酶基因(OfCPR),利用生物信息学技术分析该酶的结构特征;通过实时定量PCR技术比较了该基因在亚洲玉米螟不同发育阶段、五龄每一天和组织部位的mRNA表达模式,为进一步探讨OfCPR基因功能,和亚洲玉米螟的防治工作奠定了基础。
1 材料与方法
1.1 供试昆虫
供试亚洲玉米螟在人工气候箱以人工饲料饲喂,饲养条件为温度(27±1)℃,相对湿度60%,光照周期为(16L:8D),成虫另行添加质量百分比5%蜜糖水。在一龄至五龄幼虫期、蛹期和成虫期分别整虫取样,用于不同龄期基因表达检测;在五龄幼虫期第一至五天分别整虫取样,用于五龄不同天数基因表达检测;冰上解剖五龄幼虫,分离获得肠道、血淋巴和残余部分,用于不同组织部位基因表达检测。每组样品包含3个生物学重复,所得样品用液氮快速冷冻,放置于-80℃超低温冰箱冻存备用。
1.2 主要试剂盒仪器设备
TRIzol、PrimeScript reverse transcriptase和RNA酶抑制剂为宝生物工程大连有限公司产品,胶回收试剂盒为Omega公司产品,DNA maker和pEASY-Blunt Zero Cloning Kit为北京全式金生物技术有限公司,2×Taq PCR MasterMix为北京天根生化科技有限公司产品,其他试剂为市售分析纯。
1.3 亚洲玉米螟细胞色素P450还原酶全长的克隆
根据本课题组已有的亚洲玉米螟转录组数据库,设计一对OfCPR基因的全长引物。以亚洲玉米螟总cDNA为模板,PCR法获得该基因全长序列。PCR反应体系为(20 μL),cDNA模板1 μL,2×Taq PCR MasterMix 10 μL,上下游RT引物 (10 μmol/L)各1 μL,ddH2O 7 μL。引物序列OfCPR-F:5’-GTTGAGTGTCATGTGTTCGTCGGGT,OfCPR-R:5’-ATCTAATGATAAGACGATACAAAAT。扩增条件为 95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸3 min,35个循环后,72 ℃延伸10 min。PCR扩增产物用质量百分比1.5%琼脂糖凝胶电泳分离并检测,利用Omega胶回收试剂盒回收目的条带。将回收产物连接到pEASY-Blunt Zero载体上,并转化Trans-T1感受态细胞,涂布于含有100 mg/mL氨苄青霉素和50 mg/mL卡那霉素的琼脂平板上,挑取单菌落,过夜振荡培养后送样测序。
1.4 序列分析
利用BLAST(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)和ORF finder(https:∥www.ncbi.nlm.nih.gov/orffinder/)预测OfCPR基因完整阅读框,并用DNA translate(http:∥web.expasy.org/translate/)软件翻译为氨基酸序列;使用ProtParam(http:∥web.expasy.org/protparam/)对该酶蛋白质分子量和理论等电点等参数进行预测,使用SignalP(http:∥www.cbs.dtu.dk/services/SignalP)和SMART(http:∥smart.embl-heidelberg.de)软件在线预测蛋白信号肽及跨膜区。利用在线程序SWISS-MODEL(http:∥swissmodel.expasy.org)进行同源模建,以已知晶体结构为模板,模拟亚洲玉米螟CPR三级结构。
1.5 实时定量PCR检测
以玉米螟不同龄期、五龄不同天数和不同组织部位的cDNA为模板,参照SYBR Green Realtime PCR Master Mix试剂说明书,对其反应体系进行优化。RT-qPCR反应体系为 (20 μL):cDNA模板4 μL,2×SYBR Green Realtime PCR Master Mix 10 μL,上下游RT引物 (10 μmol/L)各0.8 μL,ddH2O 4.4 μL。引物序列OfCPR-F:ATAATTATGCTCGTCGTGTTATTGG、OfCPR-R:ATGATTTCGTCCTTCTTGTTTTCCT,扩增条件为:95℃预变性15 s,95℃ 15 s,61℃ 31 s,35个循环。采用2-ΔΔCT法分析OfCPR基因mRNA在亚洲玉米螟不同发育阶段和五龄不同天数及组织的相对表达量,β-actin为内参基因。每组样品设3个生物学重复,所有数据均以平均值±标准差表示,采用Turkey法进行多重比较。
2 结果与分析
2.1 亚洲玉米螟OfCPR基因的克隆
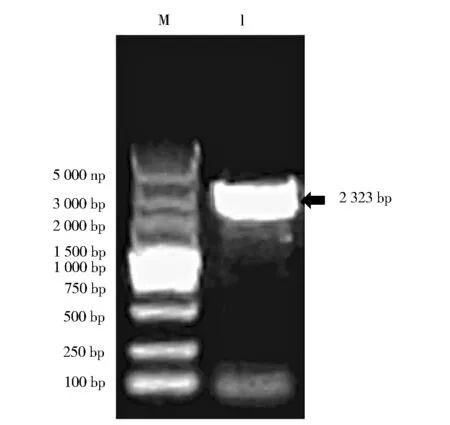
M:DNA maker DL5000,1:PCR products of OfCPRFig.1 Electrophoretogram for PCR amplificationproducts of OfCPR from Ostrinia furnacalisM:DNA maker DL5000,1:OfCPR的扩增产物图1 亚洲玉米螟CPR基因全长cDNA的PCR扩增电泳
利用本课题组已有的亚洲玉米螟转录组数据库,以“Cytochrome P450 reductase”为关键词搜索亚洲玉米螟转录组Nr注释库,获得一条玉米螟CPR基因的待定全长cDNA序列,长度为3 132 bp。通过在该待定序列5’和3’端非编码区各设计一条正向和反向引物,琼脂糖凝胶电泳检测目的条带(图1),胶回收PCR产物,插入pEASY-Blunt Zero克隆载体。测序结果显示,该段DNA序列与从亚洲玉米螟转录组获得的待定CPR基因序列完全一致,全长2 323 bp,命名为OfCPR,GenBank登录号MG255 127。其中为开放阅读框为2 049 bp,5’端非编码区长116 bp,3’端非编码区长158 bp,编码682个氨基酸。
2.2 亚洲玉米螟OfCPR氨基酸序列分析
OfCPR蛋白质预测分子量为76.9 kDa,理论等电点为5.57。在常见20种氨基酸中,亮氨酸(Leu)含量最高,为9.6%;Trp含量最低,为1.2%;其中不稳定系数46.51,平均疏水系数-0.409。SignalP和SMART预测结果显示,该酶N端含有一个疏水穿膜区(20L-43S:LFSTFDIIMLVVLLGAAVWWLYS),没有信号肽。使用SWISS-MODEL在线预测OfCPR的三维分子结构,以褐家鼠(Rattusnorvegicus)CPR晶体结构(4YAF)为最适模板,对OfCPR进行同源建模(图2)。结果显示该酶主要由膜结合区、FMN结合结构域,连接结构域和C端的FAD/NADPH结合结构域四部分组成。
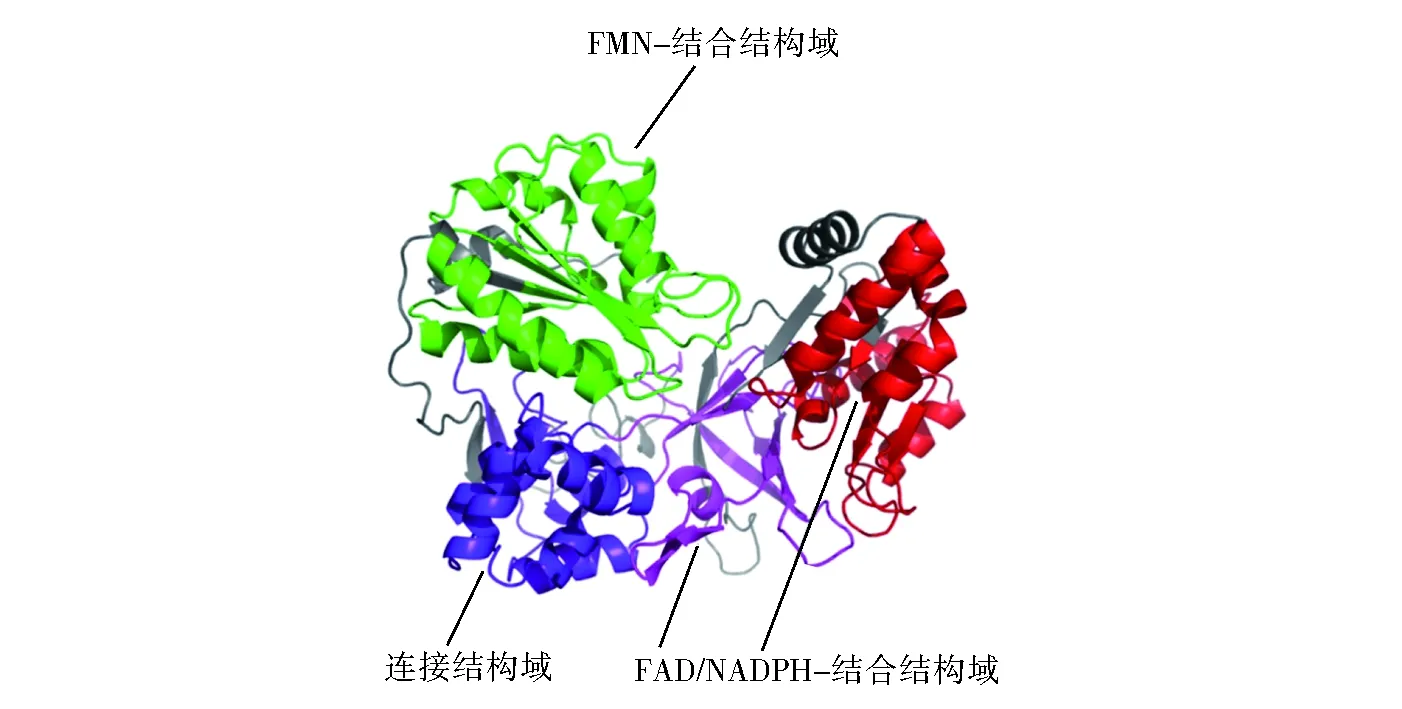
Fig.2 Three-dimensional molecular structure of OfCPR图2 亚洲玉米螟细胞色素P450还原酶的三维分子结构
2.3 OfCPR蛋白多序列对比与进化分析
利用BLASTP软件在NCBI数据库中搜索与OfCPR同源的代表性昆虫CPR的氨基酸序列21条。在此基础上进行氨基酸序列相似性比较,结果显示OfCPR与鳞翅目昆虫CPR氨基酸序列较为接近,其中与家蚕(Bombyxmori)和棉铃虫(Helicoverpaarmigera)CPR氨基酸相似度分别为93%和87%,而与半翅目、直翅目和虱毛目等昆虫CPR氨基酸序列相比有较大差异,氨基酸相似度62%-67%。
为了进一步分析OfCPR在不同昆虫物种间的进化关系,利用MEGA7软件将OfCPR和代表性昆虫CPR蛋白序列进行NJ法聚类分析。结果显示(图3)亚洲玉米螟CPR首先与家蚕(B.mori)、棉铃虫(H.armigera)和小菜蛾(Plutellaxylostella)等鳞翅目昆虫CPR聚为一支,再依次与双翅目、同翅目昆虫CPR相聚。
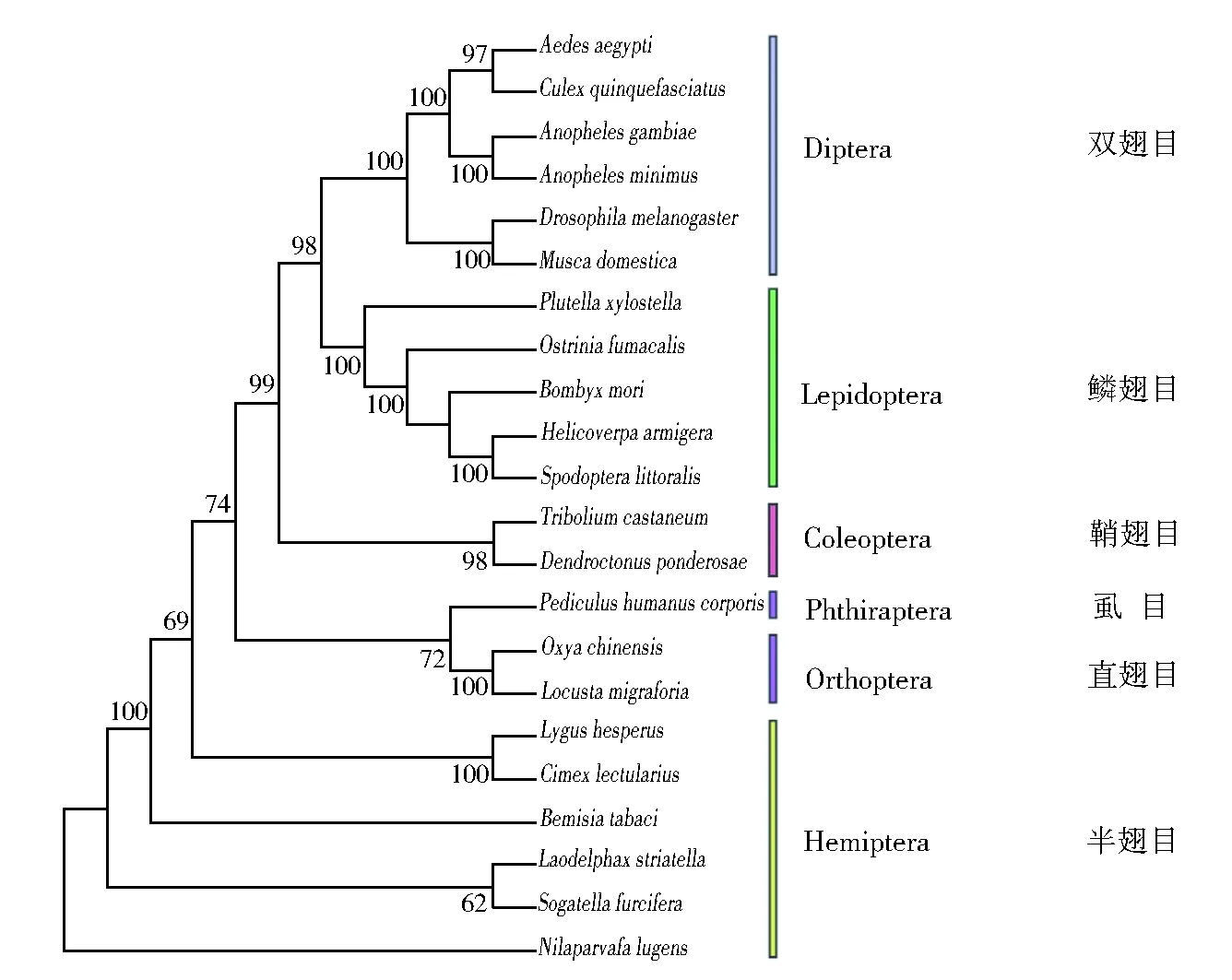
Fig.3 Phylogenetic analysis of insect CPR from typical species图3 典型昆虫细胞色素P450还原酶系统发育树
2.4 OfCPR基因差异表达分析
OfCPR基因在亚洲玉米螟各个龄期均有不同程度的表达(图4),其中OfCPR基因表达量在成虫期最高;在一龄和五龄幼虫期也较高,但无显著性差异(P>0.05)。由于OfCPR在五龄幼虫期有较高水平表达,该龄期也是亚洲玉米螟由幼虫期向蛹期过渡的关键时间,且五龄亚洲玉米螟进食量大、对玉米危害较为严重。因此进一步在五龄期,比较OfCPR基因不同天数和不同组织的相对表达量。结果如图5所示,OfCPR在五龄第三天表达量较高(4.25±2.26倍),而在其他天数表达量较低。OfCPR初步的组织差异表达显示(图6),该基因在肠道表达量最高(4.09±1.13倍),而在血淋巴和残余部分表达量较低。
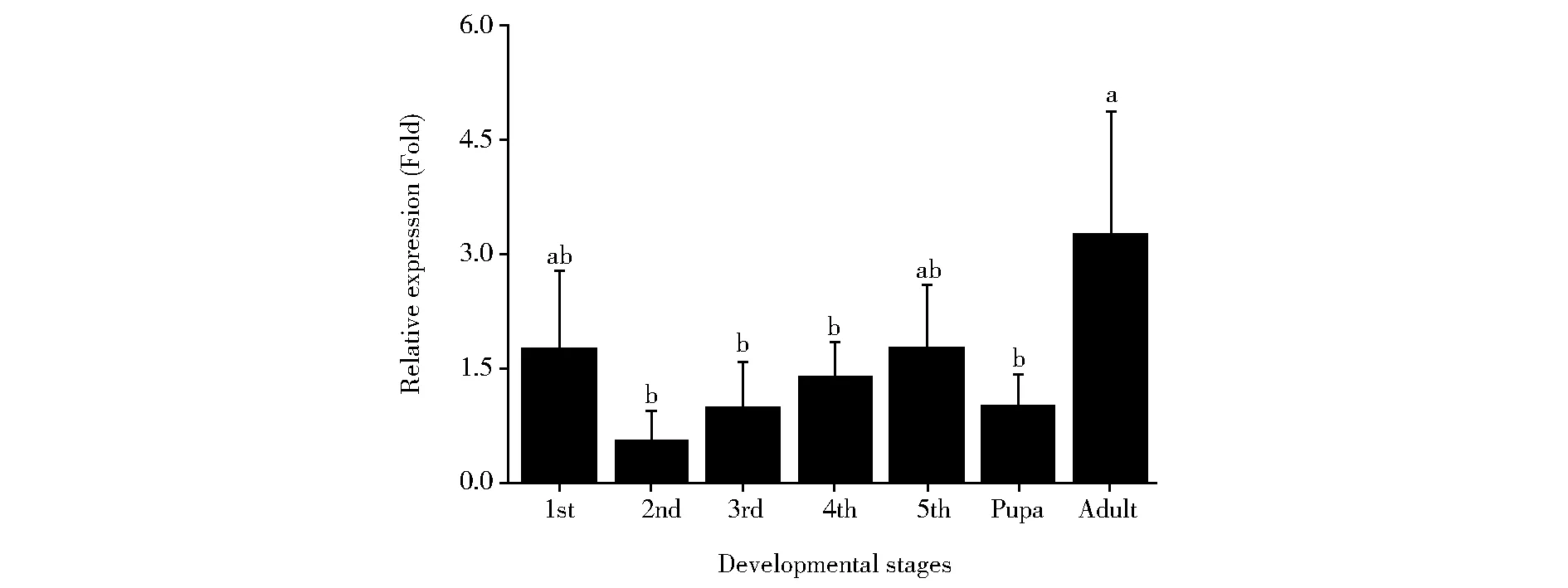
1st:1st-larval stage, 2nd: 2nd-larval stage, 3rd: 3rd-larval stage, 4th: 4th-larval stage, 5th: 5th-larval stage.Small letters indicate significant differences (P<0.05).Fig.4 Relative expression of OfCPR in different stages of Ostrinia furnacalis1st,2nd,3rd,4th和5th分别表示一至五龄幼虫期;Pupa:蛹期;Adult:成虫期图4 亚洲玉米螟不同发育时期OfCPR的相对表达量

Small letters indicate significant differences (P<0.05)Fig.5 Relative expression of OfCPR in different days of 5th-larval stage图5 亚洲玉米螟OfCPR五龄不同天数相对表达量

Small letters indicate significant differences (P<0.05).Fig.6 Relative expression of OfCPR in different tissues of 5th-larval stagesCarcass:残余部分;Hemolymph:血淋巴;Gut:肠道图6 亚洲玉米螟OfCPR五龄不同组织部位相对表达量
3 讨论
细胞色素P450——细胞色素P450还原酶系统是一类非常重要的多功能酶系统。昆虫细胞色素P450可大致分为微粒体细胞色素和线粒体细胞色素P450,而每个昆虫基因组中P450数量差异较大,例如人体虱(Pediculushumanus)含有36个细胞色素P450而尖音库蚊(Culexpipiens)基因组含有180个细胞色素P450[12]。但昆虫细胞色素P450还原酶数量极为稳定,在已知的昆虫基因组中,都只含有一个CPR基因。
昆虫CPR氨基酸序列高度一致,氨基酸序列一致性大于60%,而鳞翅目昆虫CPR氨基酸序列一致性大于80%。昆虫CPR由膜结合区、FAD/NADPH-结合结构域和FMN-结合结构域四部分组成。FAD/NADPH-结合结构域位于C端,FMN-结合结构域位于N-端,两个结构域通过无规格卷曲相互连接。在氨基酸序列上,FAD-结合结构域序列还被连接结构域序列分割为两部分[13]。细胞色素P450还原酶通过N端的膜结合区锚定在膜上,并使该酶其他部分朝向细胞质,保证CPR可以与膜上的细胞色素P450动态结合[13]。昆虫CPR参与介导NADPH电子,经由FAD/NADPH-结合结构域,FMN-结合结构域,最终传递给细胞色素P450酶系[14]。
昆虫细胞色素P450催化活性需要CPR传递的电子供能[15]。昆虫CPR组织和龄期表达谱,一定程度上可反映细胞色素P450活力。果蝇(Drosophilamelanogaster)DmCPR与DmCYP4G1共同在绛色细胞高表达,干扰DmCPR与DmCYP4G1基因都会引起表皮酯类成分紊乱,表明DmCPR与DmCYP4G1可能共同参与了表皮酯类物质的生物合成[16]。二化螟(Chilosuppressalis)CsCPR在成虫期,一龄和五龄幼虫期表达水平相对较高[17];而温带臭虫(Cimexlectularius)在雌性和雄性成虫体内均有较高水平表达[18],这与OfCPR在成虫期最高,而在一龄和五龄幼虫期相对较高的结果相似。小菜蛾(P.xylostella)[19]、二化螟(C.suppressalis)[17]和抗性品系棉铃虫(H.armigera)[20]的CPR基因在肠道或中肠中有较高表达,这与OfCPR在肠道表达水平较高结果一致。飞蝗细胞色素P450和细胞色素P450还原酶均在肠道组织有相对较高表达,与其他组织相比飞蝗肠道P450还具有较高的溴氰菊酯代谢能力[21]。肠道是昆虫消化食物,降解植物次生代谢和杀虫剂的重要器官。昆虫细胞色素P450——细胞色素P450还原酶系统在该部位高度表达,并担负重要的外源物质解毒代谢功能[22]。OfCPR在亚洲玉米螟肠道高表达可能与亚洲玉米螟细胞色素P450介导的外源化合物代谢过程有关,进而增强亚洲玉米螟对于外部生境的适应性。
参考文献:
[1] Wang H,Li S,Teng S,etal.Transcriptome Profiling Revealed Novel Transcriptional Regulators in Maize Responses to Ostrinia Furnacalis and Jasmonic Cuid[J].PLOSOne,2017,12(5):e0177739.DOI:10.1371/journal.pone.0177739.
[2] 邱新辉,冷欣夫.昆虫细胞色素P450的研究:P450基因的进化[J].昆虫知识,1998,6:019.
[3] Rewitz K F,Rybczynski R,Warren J T,etal.Identification,Characterization and Developmental Expression of Halloween Genes Encoding P450 Enzymes Mediating Ecdysone Biosynthesis in the Tobacco Hornworm,Manduca Sexta[J].InsectBiochemistryandMolecularBiology,2006,36(3):188-199.DOI:10.1016/j.ibmb.2005.12.002.
[4] Yu Z T,Zhang X,Wang Y,etal.LmCYP4G102:An Oenocyte-specific Cytochrome P450 Gene Required for Cuticular Waterproofing in the Migratory Locust,Locusta Migratoria[J].ScientificReports,2016,6:29980.DOI:10.1038/srep2998.
[5] Hovemann B T,Sehlmeyer F,Malz J,etal.Drosophila Melanogaster NADPH-cytochrome P450 Oxidoreductase:Pronounced Expression in Antennae May be Related to Odorant Clearance[J].Gene,1997,189(2):213-219.DOI:10.1016/S0378-1119 (96)00851-7.
[6] Guo Y Q,Wu H,Zhang X,etal.RNA Interference of Cytochrome P450 CYP6F Subfamily Genes Affects Susceptibility to Different Insecticides in Locusta Migratoria[J].PestManagementScience,2016,72(11):2154-2165.DOI:10.1002/ps.4248.
[7] Huang R,Zhang M,Rwere F,etal.Kinetic and Structural Characterization of the Interaction Between the FMN Binding Domain of Cytochrome P450 Reductase and Cytochrome c[J].JournalofBiologicalChemistry,2015,290(8):4843-4855.DOI:10.1074/jb c.M114.582700.
[8] Murataliev M B,Guzov V M,Walker F A,etal.P450 Reductase and Cytochrome b5 Interactions with Cytochrome P450:Effects on House Fly CYP6A1 Catalysis[J].InsectBiochemistryandMolecularBiology,2008,38(11):1008-1015.DOI:10.1016/j.ibmb.2008.08.007.
[9] Koener J F,Cario F A,Feyereisen R,etal.The cDNA and Deduced Protein Sequence of House fly NADPH-cytochrome P450 Reductase[J].InsectBiochemistryandMolecularBiology,1993,23(4):439-447.DOI:10.1016/0965-1748(93)90051-S
[10] Zhang Y L,Wang Y,Wang L,etal.Knockdown of NADPH-cytochrome P450 Reductase Results in Reduced Resistance to Buprofezin in the Small Brown Planthopper,Laodelphax Striatellus (fallén)[J].PesticideBiochemistryandPhysiology,2016,127:21-27.DOI:10.1016/j.pestbp.2015.08.006.
[11] Huang Y,Lu X P,Wang L L,etal.Functional Characterization of NADPH-cytochrome P450 Reductase from Bactrocera Dorsalis:Possible Involvement in Susceptibility to Malathion[J].ScientificReports,2015,5:18394.DOI:10.1038/srep18394.
[12] NelsonDR.The Cytochrome P450 Homepage[J].HumanGenomics,2009,4(1):59-65.DOI:10.1186/1479-7364-4-1-59.
[13] Laursen T,Jensen K,Møller B L,etal.Conformational Changes of the NADPH-dependent Cytochrome P450 Reductase in the Course of Electron Transfer to Cytochromes P450[J].BiochimicaetBiophysicaActa-ProteinsandProteomics,2011,1814(1):132-138.DOI:10.1016/j.bbapap.2010.07.003.
[14] Liu N N,Gong Y,Li M,etal.Cytochrome P450s — Their Expression,Regulation,and Role in Insecticide Resistance[J].PesticideBiochemistryandPhysiology,2015,120:77-81.DOI:10.1016/j.pestbp.2015.01.006.
[15] Feyereisen R.Arthropod CYPomes Illustrate the Tempo and Mode in P450 Evolution[J].BiochimicaetBiophysicaActa-ProteinsProteom,2011,1814(1):19-28.DOI:10.1016/j.bbapap.2010.06.012.
[16] Qiu Y,Tittiger C,Wicker-Thomas C,etal.An Insect-specific P450 Oxidative Decarbonylase for Cuticular Hydrocarbon Biosynthesis[J].ProceedingsoftheNatlionalAcademyofSciencesofUnitedStatesofAmerica,2012,109(37):14858-14863.DOI:10.1073/pnas.1208650109.
[17] Liu S,Liang Q M,Huang Y J,etal.Cloning,Functional Characterization,and Expression Profiles of NADPH-cytochrome P450 Reductase Gene from the Asiatic Rice Striped Stem Borer,Chilo Suppressalis (Lepidoptera:Pyralidae)[J].ComparativeBiochemistryandPhysiologyB-Biochemistry&MolecularBiology,2013,166(3-4):225-231.DOI:10.1016/j.cbpb.2013.09.004.
[18] Zhu F,Sams S,Moural T,etal.RNA Interference of NADPH-Cytochrome P450 Reductase Results in Reduced Insecticide Resistance in the Bed Bug,Cimex lectularius[J].PublicLibraryofScienceONE,2012,7(2):e31037.DOI:10.1371/journal.pone.0031037.
[19] Chen X E,Zhang Y L.Identification and Characterization of NADPH-dependent Cytochrome P450 Reductase Gene and Cytochrome b5 Gene from Plutella Xylostella:Possible Involvement in Resistance to Beta-cypermethrin[J].Gene,2015,558(2):208-214.DOI:10.1016/j.gene.2014.12.053.
[20] Liu D,Zhou X,Li M,etal.Characterization of NADPH-cytochrome P450 Reductase Gene from the Cotton Bollworm,Helicoverpa Armigera[J].Gene,2014,545(2):262-270.DOI:10.1016/j.gene.2014.04.054.
[21] Zhang X Y,Wang J X,Zhang M,etal.Molecular Cloning,Characterization and Positively Selected Sites of the Glutathione S-transferase Family from Locusta Migratoria[J].PublicLibraryofScienceONE,2014,9(12):e114776.DOI:10.1371/journal.pone.0114776.
[22] Schuler M A,Berenbaum M R.Structure and Function of Cytochrome P450Sin Insect Adaptation to Natural and Synthetic Toxins:Insights Gained from Molecular Modeling[J].JournalofChemicalEcology,2013,39(9):1232-1245.
