一种识别Cu2+离子的罗丹明探针及其光谱性质研究
2018-05-21任列香刘金王攀峰刘斌
任列香,刘金,王攀峰,刘斌*
(1.吕梁学院 化学化工系,山西 离石 033000;2.山西大学 分子科学研究所,山西 太原 030006)
0 引言
铜是生物体中重要的微量元素,它在基因表达,蛋白质功能和结构改进等过程中起着重要的作用,也是人类神经系统的必需元素[1]。它在人体内的含量直接影响人类健康,过高或过低都会引起各种疾病,如过高可引起各种神经退行性疾病,如门克斯疾病[2],威尔逊疾病[3]和阿尔茨海默病[4]。另外,由于铜在工业领域中的广泛使用,对环境的污染日益严重。因此,寻找一种有效监测Cu2+的探针对生物和环境等领域都具有重要的意义。
罗丹明及其衍生物是一类螺环化合物,闭环状态下荧光较弱,与一些金属离子作用后螺环打开,能发出极强的橙色荧光,被广泛用作金属离子的荧光探针[5-9]。相比于其他分析手段来说,荧光探针具有操作简单,费用低,灵敏度高等特点,因此,开发一种识别Cu2+的罗丹明酰肼荧光探针受到科研工作者的关注[10-18]。
为了改善罗丹明的亲脂性和生物相溶性,提高其在生物检测中的应用,本文在罗丹明酰肼的基础上,引入了一个长链的4-氨基水杨酸和戊二醛的缩合物,合成了一种新型罗丹明酰肼衍生物L,并对其结构进行了表征。光谱研究表明化合物L对Cu2+具有良好的选择性识别功能,可用于生物和环境中微量铜离子的检测。
1 实验部分
1.1 试剂与仪器
N-2-羟乙基哌嗪-N’-2-乙磺酸 (Hepes),二亚乙基三胺 (DETA),4-氨基水杨酸,戊二醛,罗丹明,各种金属离子(Fe3+, Cr3+, Al3+, Hg2+, Fe2+, Mg2+, Mn2+, Co2+, Pb2+, Cu2+, Cd2+, Ni2+, Ca2+, Zn2+, K+, Na+, Ag+)硝酸盐,试剂均为分析纯。
核磁共振仪(Bruker-300 MHz),荧光光谱仪 (Cary Eclipse spectrofluoremeter),电喷雾质谱仪(Agilent 6520 Accurate-Mass Q-TOF LC/MS),紫外-可见分光光度计(Varian 50 BIO),元素分析仪(Vario EL Ⅲ analyzer),红外光谱仪(Bruker TENSOR 21 FT-IR),pH计(pHS-3C,中国,上海)。
1.2 罗丹明酰肼衍生物L的合成
罗丹明酰肼衍生物L的合成路线见图1所示。

Fig.1 Synthetic route of the rhodamine hydrazide derivative L图1 罗丹明酰肼衍生物L的合成路线
先将4-氨基水杨酸(0.765 g,5 mmol) 溶于20 mL乙醇中,然后加入过量的戊二醛 (5 mL,12.5 mmol),搅拌,空气浴回流2 h。冷却,过滤,用15 mL的冰乙醇洗涤沉淀3次,减压干燥,得到一种黄色的希夫碱化合物四氨基水杨酸缩戊二醛1(0.9 g,产率为76%)。罗丹明酰肼的合成根据文献报道方法[19]。罗丹明酰肼(0.46 g,1.0 mmol)和1(0.23 g,1.0 mmol) 溶解在30 mL乙醇中,搅拌,空气浴回流3 h后,冷却,出现粉色沉淀物,固体经重结晶纯化后得到0.32 g化合物L(产率为47.5%)。
化合物L:FT-IR (KBr):3 078,2 929,1 699,1 616,1 514,1 465,1 265,1 116 cm-1.1H-NMR(300 MHz,CDCl3):δ(ppm)=7.93-7.90 (d,J=5.1 Hz, 2H),7.60-7.55 (m, 4H, Phen-H), 7.35-7.28 (s, 2H, Phen-H), 7.26-7.19 (d,J=8.1 Hz,2H,Phen-H),7.06-6.98(d,J=10.2 Hz,3H,Xanthene-H),6.46-6.41(m,2H,Xanthene-H),3.33(q, 8H,NCH2),2.44(t,J=8.1 Hz,2H),1.37 (m,6H,CH2CH2CH2),1.02-0.88(t,J=6.7 Hz,12H,NCH2CH3).ESI mass spectrometry:m/z=674.33 [M+H]+, [M+H]+calculated 674.33. Anal. Cacld for C: 71.30, H: 6.43, N: 10.39; Find: C: 71.26, H:6.64,N:10.30.
1.3 化合物L与Cu2+ 的光谱测定
金属离子盐的水溶液浓度为1.0 mmol/L,化合物L的乙腈储备液浓度为1.0 mmol/L。
光谱测定按照下列步骤:移取100 μL 1 mmol/L化合物L于吸收池中,用CH3CN-Hepes (1∶1,V/V,pH 7.0,10 mmol/L Hepes) 缓冲溶液稀释到2.0 mL,然后滴加不同量 (10~400 μL)的金属离子,反应2.0 min,扫描其吸收和发射光谱。荧光光谱测定设定激发狭缝和发射狭缝宽度均为2.5 nm,激发波长为540 nm。
2 结果与讨论
2.1 紫外-可见光谱研究
为了探测化合物L对Cu2+的选择性识别,研究了L与不同金属离子 (Ni2+,Hg2+,Fe2+,Co2+,Ca2+,Cd2+,Mn2+,Cu2+,Zn2+,Cr3+,Fe3+,Al3+,K+,Na+,Ag+) 作用的可见吸收光谱,结果如图2a所示。L单独存在时,在可见光区没有吸收;加入Cu2+后,在500~590 nm范围出现一个新的强吸收峰,同时溶液的颜色由无色变为粉色(图3),而其它金属离子加入后,吸收光谱没有明显的变化。该实验结果表明Cu2+与L作用后,L的螺环被打开了[5],L对Cu2+具有很高的选择识别性能。图2b为L与不同浓度Cu2+作用的吸收光谱图,由图可知,Cu2+的加入,554 nm处的吸收峰随Cu2+浓度的增大,吸收强度增大。当浓度比为1∶1时,吸收强度增大到原来的12倍。图2c为L与Cu2+作用的Job’s plot 工作图,L+Cu2+总浓度为50 μmol/L,在[Cu2+]/[L+Cu2+]为0.5时出现拐点,说明L与Cu2+以1∶1的比例络合。根据Hill plot 曲线拟合可得结合常数K=1.0×105L/mol(图略),检测限由公式DL=K×Sb1/S可得为1.0 μmol/L,其中K=3,Sb1为空白溶液10次测量的标准偏差,S是滴定曲线的斜率。图2d为干扰实验,向L中分别加入10倍量的干扰金属离子(Ni2+,Hg2+,Fe2+,Co2+,Ca2+,Cd2+,Mn2+,Zn2+,Cr3+,Fe3+,Al3+,K+,Na+,Ag+),测定其吸收光谱,然后再向其中分别加入2倍量的Cu2+,扫描其吸收光谱,作光谱对照图。结果表明其它共存金属离子不影响L对Cu2+的识别。

Fig.2 (a) Absorption spectra of 50 μmol/L L in the presence of different metal ions (100 μmol/L) in 1∶1 CH3CN-Hepes buffer solvent (pH 7.0,10.0 mmol/L Hepes).(b) UV-vis titration profile of L upon gradual addition of Cu2+(0~1.5 equiv.)(c) Job’s plot of the L with Cu2+, total concentration of L+Cu2+was keptconstant at 50.0 μmol/L. (d) Absorption of L(50.0 μmol/L) at 554 nm to 2.0 equiv.of Cu2+ in 1∶1 CH3CN-Hepes buffer solution (10.0 mmol/L Hepes,pH 7.0) containing 10 equiv. of various metal ions图2 (a) L (50 μmol/L)与不同金属离子 (100 μmol/L)作用的吸收光谱.(b) L (50.0 μmol/L)与不同浓度Cu2+作用的吸收光谱 (c)L与Cu2+作用的Job’s plot (d) 不同金属离子存在下,L中加入Cu2+ 前后吸收强度对照柱形图

Fig.3 Photos of changes in color and fluorescent emission of the L(50 μmol/L) uponaddition of 2.0 equiv. various metal ions in 1∶1 CH3CN-Hepes buffer solution (10.0 mmol/L Hepes, pH 7.0)图3 探针L(50 μmol/L)与不同金属离子(100 μmol/L)作用后在可见光和紫外线照下的溶液颜色变化
2.2 荧光光谱研究
为了进一步验证化合物L对Cu2+的选择性识别功能,L与金属离子作用的荧光光谱被研究,如图4所示。L在CH3CN-Hepes (1∶1,V/V)溶液中的荧光很弱,在Cu2+加入后,荧光强度明显增强 (λex=540 nm)。在λ=365 nm紫外灯照射下溶液由无色变为橙色(见图3)。其他金属离子(Ni2+, Hg2+, Fe2+, Co2+, Ca2+, Cd2+, Mn2+, Zn2+, Cr3+, Fe3+, Al3+, K+, Na+, Ag+) 加入后(见图4a),荧光基本不变。图4b是L与不同浓度的Cu2+作用后的荧光光谱图。由图可见,随着Cu2+浓度的增大,L在575 nm 处的荧光逐渐增强。在1∶1比例以后,继续增加Cu2+浓度,荧光强度基本不再变化。图4c将实验数据根据log[(F-F0)/(Fmax-F)]对log[Cu2+]进行Hill plot 线性拟合,得L与Cu2+结合常数K=1.91×105L/mol。根据公式DL=K×Sb1/S,Cu2+的检测限为22.9 nmol/L,该值远远低于人体血液中Cu2+的浓度 (15.7~23.6 μmol/L)[18]和饮用水中Cu2+的浓度 (~20 μmol/L)[20],可用于生物和环境等体系中微量Cu2+的测定。与最近一些文献中Cu2+荧光探针比较[21-23],该探针检出限低,荧光响应时间短,生物相容性高。生物其他金属离子的干扰实验结果如图4d所示,表明共存离子的存在不影响化合物L对Cu2+的识别。荧光研究结果与紫外-可见吸收结果一致,表明化合物L能够很好地选择性识别Cu2+。

Fig.4 (a) Fluorescence spectra of L(50 μmol/L) upon addition of 2.0 equiv.Cu2+and other metal ions with the excitation at 540 nm in 1∶1 CH3CN-HEPES buffer solution(10.0 mmol/L Hepes, pH 7.0). (b) Emission profile of L(50 μmol/L)upon concomitant additions of Cu2+. Insert: Changes of emission intensity at 575 nmwith incremental addition of Cu2+. (c) Hill plot of the fluorescence titration data of L at575 nm with Cu2+ in CH3CN-Hepes solution. (d) Fluorescence intensity changes ofL (50 μmol/L) upon the addition of various metal ions in CH3CN/HEPES(pH 7.0, 1∶1,V/V) solution.λex=540 nm, slit: 2.5 nm/2.5 nm图4 (a) L(50 μmol/L)与不同金属离子 (100 μmol/L)作用的荧光光谱图;(b) L (50 μmol/L) 与不同浓度Cu2+作用的荧光光谱;(c)L与Cu2+作用的Hill plot 图; (d) 不同金属离子存在下,L中加入Cu2+ 前后荧光强度对照柱形图
2.3 pH选择和反应时间选择
测试了不同pH条件下,化合物L及L+Cu2+在575 nm处荧光强度的变化。实验表明,pH对L的荧光强度基本无影响。L+Cu2+体系受pH的影响较大,在pH 5~7.5时,体系的荧光强度明显的增强,pH=7.0时荧光强度最大,故实验选择pH=7.0。另外,研究了L与Cu2+的反应动力学,L+Cu2+的体系在1.0 min内反应完成,且光照下稳定,故本文滴定时间间隔定为2.0 min。

Fig.5 IR spectra of L (a) and L-Cu2+ (b) in KBr disks图5 化合物L与Cu2+作用前后的红外光谱图
2.4 光谱作用机理研究
为了考察了化合物L与Cu2+的作用机理,本文测定了L和L+Cu2+的IR光谱,结果如图5所示。图5a为单独L的红外光谱,1 616 cm-1处对应于酰胺羰基的特征吸收;而在结合Cu2+后,该峰发生红移 (近1 589 cm-1),如图5b。此类现象在其他罗丹明酰肼文献中也有报道[14,24],酰肼结合Cu2+后,羰基O原子和氨基N原子与Cu2+形成五元环络合物,螺环被打开[25]。
另外,在乙腈和乙腈/水体系中分别进行了可逆实验。如图6a所示,金属离子螯合剂二亚乙基三胺 (DETA)加入到L-Cu2+的乙腈溶液中,荧光强度大大降低,而向该溶液中继续滴加Cu2+发现荧光强度又回到L-Cu2+的状态,表明在乙腈溶液中,该反应是可逆的[26]。图6b是在乙腈/水体系中加入Cu2+的螯合剂EDTA或DETA,发现荧光强度均未降低,说明该过程为不可逆过程。为了研究其作用机理,将该水解产物进行了电喷雾质谱分析,结果显示L在m/z=674.3 处的分子离子峰消失,而在m/z=443.23出现新的质谱峰,该峰归属为罗丹明B (Calc. m/z=443.23) 的质谱峰。说明在水分子的存在下,Cu2+的加入促使L分子内酰胺键发生断裂,分解为罗丹明B,从而发出强的荧光。该作用机理见图7。

Fig.6 Photos of changes in color of L(a) 1:L,2:L+Cu2+,3:L+Cu2++DETA in CH3CN;(b)1:L,2:L+Cu2+,3:L+Cu2++DETA,4:L+Cu2++EDTA in H2O/CH3CN (1∶1,V/V)图6 探针L和在不同溶剂中的光谱曲线和颜色变化
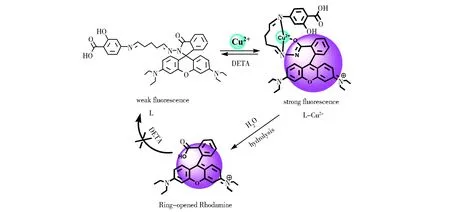
Fig.7 Proposed binding mechanism between L and Cu2+图7 L与Cu2+作用机理的示意图
3 结论
本文合成并表征了一种新型水溶性罗丹明酰肼衍生物L。吸收光谱和荧光光谱实验均表明化合物L与Cu2+在乙腈水溶液中络合比为1∶1,作用后溶液由无色变为粉色,同时发出了极强的橙色荧光,L对Cu2+具有良好的选择性识别功能,检测限低,抗干扰性强,可用于检测识别环境中的微量Cu2+。分析了L与Cu2+的作用机理,Cu2+能够打开L的螺环,并在乙腈/水体系中,酰胺键发生水解断裂。
参考文献:
[1] Muthaup G,Schlicksupp A,Hess L,etal.The Amyloid Precursor Protein of Alzheimer’s Disease in the Reduction of Copper(Ⅱ) to Copper(Ⅰ) [J].Science,1996,271:1406-1409.DOI:10.1126/science.271.5254.1406.
[2] Vulpe C,Levinson B,Whitney S,etal.Isolation of a Candidate Gene for Menkes Disease and Evidence that it Encodes a Copper-Transporting ATPase [J].NatGenet,1993,3:7-13.DOI:10.1038/ng0193-7.
[3] Bull P C,Thomas G R,Rommens J M,etal.The Wilson Disease Gene is a Putative Copper Transporting P-type ATPase Similar to the Menkes Gene[J].NatGenet,1993,5:327-337.DOI:10.1038/ng1293-327.
[4] Hung Y H,Bush A I,Cherny R A.Copper in the Brain and Alzheimer’s Disease[J].JBiolInorgChem,2010,15:61-76.DOI:org/10.1007/s00775-009-0600-y.
[5] 王攀峰,柴杰,胡向全,等.一种铬离子选择性荧光探针的合成及识别性质[J].山西大学学报:自然科学版,2015,38(1):115-119.DOI:10.13451/j.cnki.shanxi.univ(nat.sci).2015.01.019.
[6] Kim H N,Lee M H,Kim H J,etal.A New Trend in Rhodamine-Based Chemsensors:Application of Spirolactam Ring-Opening to Sensing Ions[J].ChemSocRev,2008,37:1465-1472.DOI:10.1039/b802497a.
[7] Beija M,Afonso C A M,Martinho J M G.Synthesis and Applications of Rhodamine Derivatives as Fluorescent Probes[J].ChemSocRev,2009,38:2410-2433.DOI:10.1039/b901612k.
[8] Chen X Q,Pradhan T,Wang F,etal.Fluorescent Chemosensors Based on Spiroring-Opening of Xanthenes and Related Derivatives[J].ChemRev,2012,112:1910-1956.DOI:org/10.1021/cr200201z.
[9] Mei L,Xiang Y,Li N,etal.A New Fluorescent Probe of Rhodamine B Derivative for the Detection of Copper Ion[J].Talanta,2007,2:1717-1722.DOI:10.1016/j.talanta.2007.02.002.
[10] Yu C W,Zhang J,Wang R,etal.Highly Sensitive and Selective Colorimetric and Off-on Fluorescent Probe for Cu2+Based on Rhodamine Derivative [J].OrgBiomolChem,2010,8:5277-5279.DOI:10.1039/c0ob00553c.
[11] Zhang J F,Zhou Y,Yoon J,etal.Naphthalimide Modified Rhodamine Derivative:Ratiometric and Selective Fluorescent Sensor for Cu2+Based on Two Different Approaches[J].OrgLett,2010,12:3852-3855.DOI:10.1021/ol101535s.
[12] Xu Z H,Zhang L K,Guo R,etal.A Highly Sensitive and Selective Colorimetric and Off-on Fluorescent Chemosensor for Cu2+Based on Rhodamine B Derivative [J].SensActuatorB:Chem,2011,156:546-552.DOI:10.1016/j.snb.2011.01.066.
[13] Ge F,Ye H,Luo J Z,etal.A New Fluorescent and Colorimetric Chemosensor for Cu(Ⅱ) Based on Rhodamine Hydrazone and Ferrocene Unit[J].Sens.ActuatorB:Chem,2013,181:215-220.DOI:org/10.1016/j.snb.2013.01.048.
[14] Goswami S,Sen D,Das A K,etal.A New Rhodamine-Coumarin Cu2+-Selective Colorimetric and ‘off-on’ Fluorescence Probe for Effective Use in Chemistry and Bioimaging along with Its Bound X-ray Crystal Structure[J].Sens.ActuatorB:Chem,2013,183:518-525.DOI:org/10.1016/j.snb.2013.04.005.
[15] Min M H,Wang X F,Chen Y M,etal.Highly Sensitive and Selective Cu2+Sensor Based on Electrospun Rhodamine Dye Doped Poly(ether sulfones) Nanofibers [J].SensActuatorB:Chem,2013,188:360-366.DOI:org/10.1016/j.snb.2013.07.017.
[16] Huo F J,Wang L,Yin C X,etal.The Synthesis,Characterization of Three Isomers of Rhodamine Derivative and Their Application in Copper(Ⅱ) Ion Recognition[J].SensActuatorB:Chem,2013,188:735-740.DOI:org/10.1016/j.snb.2013.07.102.
[17] Kumar M,Kumar N,Bhalla V,etal.Highly Selective Fluorescence Turn-on Chemodosimeter Based on Rhodamine for Nanomolar Detection of Copper Ions[J].OrgLett,2012,14:406-409.DOI:10.1021/ol203186b.
[18] Jung H S,Kwon P S,Kim J S,etal.Coumarin-Derived Cu2+-Selective Fluorescence Sensor:Synthesis,Mechanisms,and Applications in Living Cells [J].JAmChemSoc,2009,131:2008-2012.DOI:10.1021/ja808611d.
[19] Yang X,Guo X,Zhao Y.Development of a Novel Rhodamine-type Fluorescent Probe to Determine Peroxynitrite[J].Talanta,2002,57:883-890.DOI:PII:S0039-9140(02)00120-0.
[20] Drinking Water Contaminants[S].United States Enviromental Protection Agency,816-F-09-004,2009.
[21] Liu B,Zhou H,Yang B,etal.Aggregation-induced Emission Activity and Further Cu2+-induced,Self-assembly Process of Two Schiff Compounds[J].SensActuatorB:Chem,2017,246:554-562.DOI:org/10.1016/j.snb.2017.02.120.
[22] Liu B,Hu X,Chai J,etal.Application of Nanodiamonds in Cu(Ⅱ)-based Rhodamine B probes for NO Detection and Cell Imaging[J].JMaterChemB,2016,4:3358-3364.DOI:10.1039/c6tb00524a.
[23] Gupta A S,Paul K,Luxami V.A Fluorescent Probe with “AIE+ESIPT” Characteristics for Cu2+and F-ions Estimation[J].SensActuatorB,2017,246:653-661.DOI:org/10.1016/j.snb.2017.02.080.
[24] Zhu H,Fan J L,Lu J,etal.Optical Cu2+Probe Bearing an 8-Hydroxyquinoline Subunit:High Sensitivity and Large Fluorescence Enhancement[J].Talanta,2012,93:55-61.DOI:10.1016/j.talanta.2012.01.024.
[25] Dujols V,Ford F,Czarnik A W.A Long-Wavelength Fluorescent Chemodosimeter Selective for Cu(Ⅱ) Ion in Water[J].JAmChemSoc,1997,119:7386-7387.DOI:S0002-7863(97)01221-3.
[26] Chen X,Jia J,Ma H,etal.Characterization of Rhodamine B Hydroxylamide as a Highly Selective and Sensitive Fluorescence Probe for Copper(Ⅱ)[J].AnalChimActa,2009,632:9-14.DOI:10.1016/j.aca.2007.08.025.
