Sp8在健康大鼠侧脑室室管膜区的表达*
2018-05-21葛金文邓凤君宋祯彦潘爱华严小新
贺 旭 葛金文 邓凤君 宋祯彦 潘爱华 严小新
(1 益阳医学高等专科学校解剖学教研室,益阳 413000; 2 湖南中医药大学中西医结合学院,长沙 410208; 3 中南大学基础医学院人体解剖学与神经生物学系,长沙 410013; 4 益阳医学高等专科学校药学系,益阳 413000)
Sp8是锌指转录家族中重要一员,可通过调控小鼠外胚层顶嵴的形成而作用于肢体生长和神经孔的闭合,胚胎神经发生敲除 Sp8 基因可产生严重的露脑畸形[1-2]。Sp8可以用来标记神经祖细胞[3],Sp8沿室管膜下层呈切线迁移,由外向内放射状分布于大脑皮质各层。小鼠嗅球中间神经元产生需要转录因子Sp8的调控,基因消融Sp8后严重减少生长激素抑制素中间神经元的表达[4]。侧脑室室管膜区(subventricle zone,SVZ)和海马齿状回的颗粒细胞层(SGZ)作为产生新生神经元的“龛”,在内源性因素和外界环境的干预下,不断产生新的神经元参与神经元结构的可塑性。SVZ区产生的神经祖细胞经过吻侧迁移流到达嗅球,分化为中间神经元[5],目前有研究指出Sp8在SVZ区广泛表达且可调控新生神经元的产生[6],并且Sp8转录因子也能在成年豚鼠海马齿状回颗粒细胞层有广泛表达,可能是该部位静息状态下神经干细胞的一种标记物[7]。随着年龄的增加,大脑神经源性能力逐步下降,并且在年龄相关性的神经退行性疾病中受到损害,然而Sp8在SVZ区的表达是否受年龄的影响,以及大鼠SVZ区神经元的表达是否受到Sp8转录因子的调控,目前尚未报道,故对此进行研究。
1 材料和方法
1.1 实验动物
选择1、6、12月龄的雄性健康SD大鼠各4只,由湖南斯莱克景达实验动物有限公司提供。所有动物饲养于室温为23℃±1℃,相对湿度为55%的动物房。整个实验程序都通过中南大学伦理委员会的批准。
1.2 主要实验仪器和试剂
珊顿冰冻切片机 (Shan Don公司);Olympus BX67荧光显微镜(奥林巴斯);鼠抗Sp8(sc-104661)、羊抗Doublecortin (DCX,Santa Cruz公司,sc-8066);兔抗胶质纤维酸性蛋白(GFAP,Sigma-Aldrich公司,G9269);兔抗 Ki-67(Vector公司,014-1107)。
1.3 组织学处理和实验方法
1.3.1 组织学处理 给予SD大鼠麻醉,灌注取出脑组织。4℃后固定过夜,梯度沉糖。恒低温冰冻切片机下采用邻切法进行冠状位切片,切片厚度为6μm。
1.3.2 免疫荧光单标染色法 选取6μm切片。在摇床上PBS-T溶液轻微漂洗3次,每次5min;5%驴血清+0.1% Triton X-100磷酸盐缓冲液室温孵育2h;然后将脑片分别与羊抗Doublecortin (DCX,1∶1 000),鼠抗Sp8 (1∶1000) 孵育;置于4℃冰箱过夜;室温下复温30min,PBS-T溶液轻微漂洗3次,每次5min;分别加入Alexa Fluor 488偶联驴抗羊、驴抗鼠IgG (1∶200) 室温孵育2h;PBS-T溶液漂洗3次,每次5min;双苯酰亚胺 (1∶5000) 染核10min;PBS-T溶液漂洗3次,每次5min;贴片,50%甘油封片,荧光显微镜下观察并选取SVZ区拍照。
1.3.3 免疫荧光双标染色法 选取6μm切片。在摇床上PBS-T溶液轻微漂洗3次,每次5min;5% 驴血清+0.1%Triton X-100磷酸盐缓冲液室温孵育2h;然后将脑片与以下2组抗体孵育:兔抗GFAP(1∶2000) 与鼠抗Sp8(1∶1000);兔抗Ki67(1∶1000) 与鼠抗Sp8(1∶1000)],置于 4℃冰箱过夜;室温下复温30min,PBS-T溶液轻微漂洗3次,每次5min;Alexa Fluor 488与Alexa Fluor 594偶联驴抗兔、驴抗鼠IgG(1∶200) 室温孵育2h;接下来实验步骤同免疫荧光单标染色法。
1.4 统计学处理
2 结果
2.1 Sp8在SVZ区的表达
为了探讨是否SVZ区的Sp8的表达随着年龄的增加而递减,在1月龄、6月龄及12月龄大鼠的SVZ区进行免疫荧光单标染色。Sp8在各个年龄组均有表达,表达部位位于细胞的胞核(图1,见封三)。在1月龄 SVZ 区Sp8表达最高,细胞密度为(6001.0±387.9)/mm2,随着大鼠年龄的增加,Sp8细胞密度依次递减,6月龄及12月龄的细胞密度分别为(3470.4±274.2)/mm2和(2165.6±375.9)/mm2。3个年龄组SVZ区Sp8细胞经单因素兼组间多重比较,差异均有统计学意义(P<0.05)。
2.2 DCX在SVZ区的表达
DCX是一种微管相关蛋白,可作为未成熟神经元的标记物,代表着神经发生的水平[8]。已有研究表明作为主要神经发生区域之一的SVZ区在正常生理情况下可表达DCX[9],且受到外界伤害性应激后DCX细胞可大量表达[10-12]。本研究结果显示DCX在各个年龄组(1月龄、6月龄及12月龄)均有表达,表达部位位于细胞的胞质和突起中(图2,见封三)。1月龄、6月龄及12月龄SVZ 区DCX随着年龄的增大而依次递减,神经元的密度分别为(1442.2±153.3)/mm2、(1081.2±95.1)/mm2、(561.3±104.5)/mm2,各个年龄组SVZ区DCX细胞经单因素兼组间多重比较,差异均有统计学意义(P<0.05)。
2.3 Sp8在SVZ区与 Ki67及GFAP细胞的共表达
目前从细胞和分子机制对哺乳动物内SVZ区的神经发生进行了一系列的研究,包括从细胞、分子活动的有丝分裂活动到神经元的分化、增殖。因此开展了Sp8与反映有丝分裂后的神经元的分化及成熟的分子标记物进行了免疫荧光双标染色。Ki67是机体内源性细胞增殖的标记物,本次实验观察到1月龄大鼠SVZ区Sp8与Ki67细胞均有大量表达(图3,见封三),且SVZ区Sp8与Ki67的共表达细胞较为密集(图3a,见封三)。GFAP是星形胶质细胞标记物,可能表达于神经干细胞中或者成熟的星形胶质细胞中。实验结果显示SVZ区1月龄大鼠SVZ区Sp8与GFAP细胞均有大量表达(图4,见封三),这可能是发育早期GFAP属于星形(B型)细胞,具有神经干细胞的属性。而Sp8与GFAP细胞的共表达结果显示GFAP细胞的突起与Sp8有少量的共表达(图4b,见封三)。这提示转录因子Sp8也参与了星形胶质干细胞的分化。
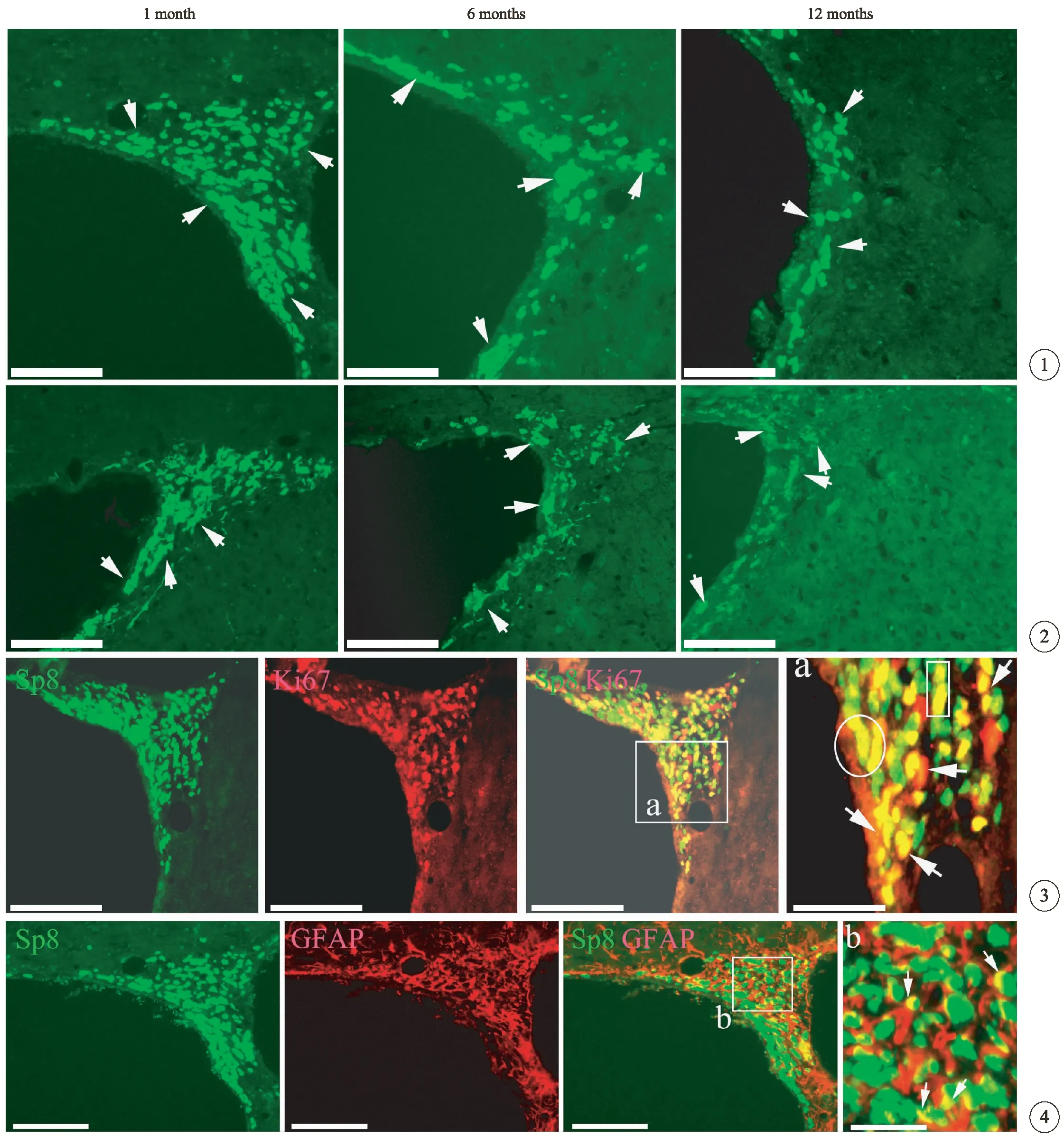
图1 Sp8细胞在各个年龄阶段SVZ区的表达。标尺=100μm,白色箭头所示为Sp8细胞.
图2 DCX细胞在各个年龄阶段 SVZ 区的表达。标尺=100μm,白色箭头所示为DCX细胞.
图3 1月龄大鼠SVZ区Sp8与Ki67细胞的共表达。标尺=100μm,a为局部放大图,Sp8与细胞内源性增殖标记物标记物Ki67有大量的共表达(白色圆圈和箭头所示).
图4 1月龄大鼠SVZ区Sp8与GFAP细胞的共表达。标尺=100μm,b为局部放大图,Sp8与星形胶质细胞标记物GFAP有共表达(白色箭头所示).
Fig 1 The expression of Sp8 in the SVZ at different age groups.The white arrows showed the Sp8 cells.
Fig 2 The expression of DCX in the SVZ at different age groups.The white arrows showed the DCX cells.
Fig 3 The coexpression of the Sp8 with Ki67 in the SVZ region at 1-month group.Figure a was an enlarged image and panels showed that Sp8 was intensely colocalized with the mitotic cell marker Ki67 (pointed by circles and arrows).
Fig 4 The coexpression of Sp8/GFAP in the SVZ region at 1-month group.Figure b was an enlarged image and panels showed that Sp8 was coexpressed with the astrocyte cell marker GFAP (pointed by white arrows).
Scale bar was 100μm,which was applied to the following images.
3 讨论
自从“中枢神经系统(脑和脊髓)的神经干细胞可以产生新生神经元替代凋亡和坏死的细胞”的学说得到公认之后,干细胞的运用和开发引起了生物学家和医学领域的广泛兴趣。衰减干细胞的活化作用可能会减少引起肿瘤发生的恶性肿瘤细胞的分裂或者是另外一些涉及到过量的细胞增殖和分裂的条件[13-15]。另外一个方面是可能通过促进神经干细胞的保存和激活对于表现为神经元丢失的神经退行性疾病及再生医学提供一种治疗方案[16-18]。鉴于此,探索和了解神经发生区域(主要指SVZ区和SGZ区)神经干细胞的数量及去向对于理解正常人体和病理状态下神经元的自我更新和修复有着重要作用。
脑缺血是脑卒中的主要形式,占到发病率的60%。脑卒中是一种严重的脑血管疾病,常有严重的神经功能后遗症,表现为肢体运动功能下降、面部瘫痪、嘴角流涎。同时研究也发现这些脑卒中后的患者神经康复某种程度与大脑相关脑区的神经再生有关联,具体表现为脑创伤和缺血性脑卒中可以加速脑内缺血部位和神经发生“龛”中神经再生能力[19-21],这种依靠脑组织自身产生的新生神经元整合到被破坏的神经功能环路中,从而发挥修补和重塑脑组织的作用。Sp8作为一种转录因子,参与调控了侧脑室室管膜区新生神经元的表达。DCX是一种微管相关蛋白,可特异性表达于未成熟和迁移神经元,主要分布在海马的齿状回颗粒细胞层、侧脑室室管膜区及嗅球等部位,通过调节突触可塑性参与神经元网络结构的构建。DCX代表着神经发生的水平[8,22],而Ki67是细胞增殖核抗原,是内源性细胞增殖的标记物,常用来检测神经干细胞有丝分裂期细胞的增殖[23]。免疫荧光单标染色结果表明Sp8与DCX细胞在SVZ区均有表达,且随着年龄的增加神经元的密度依次减少(P<0.05),这表明衰老是引起SVZ区神经发生功能下降的诱导因素之一,并且新生神经元下降可能是其调控因子之一的Sp8的衰减导致。除此之外,免疫荧光双标染色结果显示1月龄大鼠SVZ区Sp8与内源性细胞增殖标记物Ki67有大量的共表达,这说明新生大鼠SVZ区转录因子Sp8参与了细胞有丝分裂期间的细胞增殖;免疫荧光双标染色结果表明1月龄大鼠SVZ 区存在Sp8与星形胶质干细胞标记物GFAP的共存,这提示转录因子Sp8也参与了星形胶质干细胞的分化。
综上所述,锌指结构转录因子Sp8可广泛表达在SD大鼠的SVZ区,并且随着年龄的增加而发生衰减;除此之外,Sp8还可调控 SVZ区的神经发生及星形胶质干细胞的分化。
参 考 文 献
[1] Bell S M,Schreiner C M,Waclaw R R,et al.Sp8 is crucial for limb outgrowth and neuropore closure[J].Proc Natl Acad Sci U S A,2003,100(21):12195-12200.
[2] 吴俊,张雪梅,贺旭,等.Sp样转录因子家族在神经系统发育与疾病中的研究进展[J].脑与神经疾病杂志,2014,22(2):143-147.
[3] Zhang X M,Cai Y,Wang F,et al.Sp8 expression in putative neural progenitor cells in guinea pig and human cerebrum[J].Dev Neurobiol,2016,76(9):939-955.
[4] Jiang X,Zhang M,You Y,et al.The production of somatostatin interneurons in the olfactory bulb is regulated by the transcription factor Sp8[J].PLoS One,2013,8(7):e70049.
[5] 孟艳,高殿帅,蔡青,等.成年大鼠脑室下区吻侧迁移流的细胞形态学研究[J].神经解剖学杂志,2005,21(6):576-582.
[6] 聂琰珍,田苗,刘芳.转录因子Sp8在成年大鼠侧脑室下区新生神经元中的表达[J].解剖学报,2011,42(3):318-322.
[7] 王芳,张雪梅,严小新,等.Sp8阳性细胞在健康及放射性脑损伤豚鼠SGZ区的表达[J].脑与神经疾病杂志,2016,24(7):397-403.
[8] Couillard-Despres S,Winner B,Schaubeck S,et al.Doublecortin expression levels in adult brain reflect neurogenesis[J].Eur J Neurosci,2005,21(1):1-14.
[9] 谭新杰,胡长林,蔡文琴.微管相关蛋白Doublecortin在成年大鼠神经元前体细胞发生中的表达[J].解剖学杂志,2006,29(5):601-603.
[10] He X,Deng F J,Ge J W,et al.Effects of total saponins of Panax notoginseng on immature neuroblasts in the adult olfactory bulb following global cerebral ischemia/reperfusion[J].Neural Regen Res,2015,10(9):1450-1456.
[11] Adamczak J,Aswendt M,Kreutzer C,et al.Neurogenesis upregulation on the healthy hemisphere after stroke enhances compensation for age-dependent decrease of basal neurogenesis[J].Neurobiol Dis,2017,99:47-57.
[12] 贺旭,葛金文,黄俊,等.三七总皂苷对全脑缺血成年大鼠侧脑室室管膜区神经再生的影响[J].中草药,2016,47(9):1535-1540.
[13] Sosa M S,Bragado P,Aguirre-Ghiso J A.Mechanisms of disseminated cancer cell dormancy:an awakening field[J].Nat Rev Cancer,2014,14(9):611-622.
[14] Sosa M S,Parikh F,Maia A G,et al.NR2F1 controls tumour cell dormancy via SOX9- and RARbeta-driven quiescence programmes[J].Nat Commun,2015,6:6170.
[15] 冯军峰,刘伟国.神经干细胞及肿瘤干细胞与脑肿瘤发生关系的研究[J].国外医学.神经病学神经外科学分册,2005,32(2):167-170.
[16] Choi S S,Lee S R,Kim S U,et al.Alzheimer’s disease and stem cell therapy[J].Exp Neurobiol,2014,23(1):45-52.
[17] Kim S U,Lee H J,Park I H,et al.Human nerual stem cells for brain repair[J].Int J Stem Cells,2008,1(1):27-35.
[18] 招远祺,乔利军,袁龙健,等.从神经干细胞角度探索中医药介入中枢神经再生的研究策略[J].中国中医基础医学杂志,2015,21(7):915-918.
[19] 侯铁军,程焱.缺血性脑损伤与神经干细胞的再生[J].中国卒中杂志,2007,2(4):367-371.
[20] Lin R,Cai J,Nathan C,et al.Neurogenesis is enhanced by stroke in multiple new stem cell niches along the ventricular system at sites of high BBB permeability[J].Neurobiol Dis,2015,74:229-239.
[21] Jin K,Minami M,Lan J Q,et al.Neurogenesis in dentate subgranular zone and rostral subventricular zone after focal cerebral ischemia in the rat[J].Proc Natl Acad Sci U S A,2001,98(8):4710-4715.
[22] Francis F,Koulakoff A,Boucher D,et al.Doublecortin is a developmentally regulated,microtubule-associated protein expressed in migrating and differentiating neurons[J].Neuron,1999,23(2):247-256.
[23] Sibbe M,Kuner E,Althof D,et al.Stem- and progenitor cell proliferation in the dentate gyrus of the reeler mouse[J].PLoS One,2015,10(3):e119643.