淫羊藿苷对环磷酰胺诱导生精障碍大鼠下丘脑-垂体-睾丸轴的影响*
2018-05-21高学勇韩咪莎
高学勇 林 珊 韩咪莎
(1 福建医科大学基础医学院解剖学与组织学胚胎学系,福州 350004; 2 福州儿童医院检验科,福州 350005)
全世界约15%的育龄夫妇被不育不孕所困扰,其中约50%为男性不育[1]。最近50年间,人类的精子质量不断降低,生殖能力也明显下降;男性不育多为生精障碍,表现无精症和少精症,其病因复杂,目前治疗方法很多,但效果均不太理想。环磷酰胺(cyclophosphamide)是一种烷化剂类药物,是常用的抗肿瘤药物和免疫抑制剂;对男性生殖系统的损伤和对后代的潜在致畸危险已经引起医患双方的高度关注[2]。淫羊藿(herba epimedium)药用历史悠久,属于小蘖科淫羊藿属植物。淫羊藿苷(icariin)是淫羊藿的主要有效成分,也是探讨含淫羊藿苷中成药的首选成分,淫羊藿苷对免疫系统、生殖、内分泌系统等作用的研究,证实了其强大的药理活性,这为淫羊藿用于男性不育症的治疗提供了实验依据。本研究采用环磷酰胺致性成熟大鼠睾丸生精障碍模型,研究环磷酰胺损伤后,睾丸组织学变化、促性腺激素及睾酮水平,生精上皮细胞凋亡、正中隆起促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)阳性纤维表达,探讨淫羊藿苷能否改善环磷酰胺导致的生精障碍睾丸功能及其机制。
1 材料和方法
1.1 实验动物和主要试剂
清洁级雄性SD大鼠40只,15周龄,体质量300~350g,由上海斯莱克实验动物有限公司提供;淫羊藿苷单体(南京替斯艾么中药研究所,含量HPLC>98%);环磷酰胺(江苏恒瑞医药股份有限公司);细胞凋亡检测试剂盒、SABC试剂盒、GnRH 试剂盒(武汉博士德生物工程有限公司);DAB试剂盒(福州迈新生物技术开发有限公司);睾酮含量放射免疫试剂盒购于北京北方生物技术研究所。
1.2 动物分组及给药
随机将40只SD大鼠分成4组,每组10只。(1) 空白对照组:未经任何处理;(2) 阴性对照组:腹腔注射生理盐水1ml连续5d后,每天皮下注射含30% 二甲基亚砜的丙二醇0.5ml 1次,共50d。(3) 模型组:腹腔注射环磷酰胺(20mg·kg-1·d-1)[3]连续5d后,每天皮下注射含30%二甲基亚砜的丙二醇0.5ml 1次,共50d。(4) 淫羊藿苷治疗组:腹腔注射环磷酰胺(20mg·kg-1·d-1)连续5d后,每天皮下注射淫羊藿苷注射液(50mg·kg-1·d-1)[4]1次,共50d。
1.3 取材及标本制作
各组于实验第56天,即ICA注射结束后第1天,以3%戊巴比妥钠(30mg/kg)麻醉,剖胸从右心房抽取2ml血液,离心取血清,低温冰箱保存,待测睾酮、FSH、LH;打开腹腔,取左侧睾丸注射4%多聚甲醛0.5ml,预固定30min后,再固定24h;下丘脑取材:迅速断头,按大鼠脑立体定位图谱[5],切取含正中隆起、第三脑室和弓状核的下丘脑脑块,用4%多聚甲醛固定24h。睾丸、下丘脑脑块常规石蜡包埋,制备5μm厚的连续切片,用于H-E染色、生殖细胞凋亡和免疫组织化学的观察。
1.4 睾丸组织H-E染色和生殖细胞凋亡检测
取各组每只大鼠睾丸组织切片各2张,其中1张做H-E染色,观察睾丸组织学变化:生精小管面积、直径、生殖细胞数量层次及生精小管是否含精子,同时应用显微摄影系统PM-OBAD,进行图像分析自动测量生精小管直径、面积;另一张应用TUNEL观察生殖细胞凋亡,具体操作按凋亡检测试剂盒说明书进行,凋亡细胞核呈棕黄色,光镜下随机选取10个高倍视野,计数各视野阳性细胞数;阴性对照不加末端转化酶,以试剂盒提供的阳性对照切片作为阳性对照。结果判定:细胞核中有棕黄色颗粒者为阳性细胞,即凋亡的细胞。按凋亡检测试剂盒说明书(TUNEL方法)检测生殖细胞凋亡。
1.5 检测血清睾酮、FSH、LH
取聚苯乙烯试管若干,编号后按试剂盒使用说明书中加样顺序表进行加样,加样前所有试剂摇匀、并平衡至室温。采用电脑放射免疫法程序的四参数回归自动处理得出结果。
1.6 免疫组织化学观察正中隆起GnRH阳性纤维
石蜡切片经脱蜡水化后,采用SABC法检测正中隆起GnRH阳性纤维表达情况,具体操作按SABC法检测试剂盒说明书进行,用PBS做阴性对照,有棕黄色反应的为阳性。
1.7 统计学处理
2 结果
2.1 睾丸H-E染色切片观察
空白对照组和阴性对照组睾丸生精小管直径宽,排列密集,生精上皮厚,生殖细胞层次和数量多,生精小管均见精子形成,两者生精小管形态结构变化无统计学意义(P>0.05)(图1A、B),模型组睾丸生精小管直径缩小,间距增宽,生精上皮变薄,生殖细胞数量减少,生精小管腔多未见精子形成,与空白对照组比较其生精小管结构变化显著(P<0.01)(图1C);淫羊藿苷治疗组与模型组比较生精小管壁增厚,含有精子的生精小管明显增多(P<0.01)(图1D),各组睾丸生精小管直径、面积、生殖细胞数见表1。
2.2 睾丸生殖细胞凋亡的观察
空白对照组和阴性对照组睾丸生殖细胞凋亡较少(图2A、B),两组生殖细胞凋亡数量差异无统计学意义(P>0.05);模型组与空白对照组比较其生殖细胞凋亡增多(图2C),差异有统计学意义(P<0.01);治疗组与模型组比较生殖细胞凋亡数量明显减少(P<0.01)(图2D,表2)。

表1 各组睾丸生精小管直径、面积、生殖细胞数Tab 1 Diameter,area,number of germ cells of testis seminiferous tubule in each group (n=10,
**P<0.01vsblank control group;△△P<0.01vsmodel group
2.3 正中隆起GnRH阳性纤维观察
空白对照组和阴性对照组GnRH阳性纤维较少,染色浅(图3A、B),两组阳性纤维光密度差异无统计学意义(P>0.05);模型组与空白对照组比较其阳性纤维增多,染色深(图3C),光密度变化有统计学意义(P<0.01);治疗组与模型组比较其GnRH阳性纤维明显减少,染色浅(P<0.01)(图3D,表2)。

表2 各组生殖细胞凋亡数、GnRH阳性纤维光密度Tab 2 The number of germ cell apoptosis and optical density of GnRH-positive fibers in each group (n=10,
**P<0.01vsblank control group;△△P<0.01vsmodel group
2.4 血清睾酮、卵泡刺激素(FSH)及黄体生成素(LH)检测
空白对照组和阴性对照组血清血睾酮水平差异无统计学意义(P>0.05);模型组与空白对照组比较血清睾酮明显降低,差异有统计学意义(P<0.01);治疗组与模型组比较其血清睾酮明显增加(P<0.01),血清FSH、LH水平各组间差异无统计学意义(表3)。
3 讨论
睾丸是产生精子和分泌睾酮的重要器官,既受神经内分泌免疫网络调控,也受到睾丸自身分泌的各种细胞因子的调控;本研究选用15周龄性完全成熟大鼠,用药超过50d后,处理动物,因大鼠精子发生所需时间为50~60d,以便观察环磷酰胺和淫羊藿苷对睾丸生殖细胞的影响,探讨一个精子发生周期的变化。
环磷酰胺是常用的抗肿瘤药物和免疫抑制剂,容易导致精子DNA损伤、少精症、后代畸形;环磷酰胺能诱导睾丸生精障碍,本实验建模成功,说明环磷酰胺可作为建立生精障碍动物模型的药物,结合本人前期的研究和已发表的论文[6],其机制为诱导生精细胞凋亡,干扰A型精原细胞自我更新增殖及分化功能,损伤精子发生微环境,环磷酰胺损伤生殖细胞遗传物质,同时具有生殖毒性,引起睾酮水平降低、生殖细胞数目减少[7]。
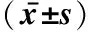
表3 各组大鼠血清睾酮、FSH、LH水平Tab 3 Serum Testosterone,FSH and LH levels in each group
**P<0.01vsblank control group;△△P<0.01vsmodel group
从本实验结果观察,淫羊藿苷对环磷酰胺诱导生精障碍大鼠睾丸生精小管结构有明显改善作用,减少生精细胞凋亡,促进精子发生,模型组血清睾酮水平显著降低,淫羊藿苷治疗组血清睾酮水平明显提高,说明淫羊藿苷有明显的性激素样作用可直接刺激性腺[8],肾阳虚小鼠血清睾酮含量,性腺雄激素受体mRNA 和蛋白质的表达与正常组相比均有所下降,淫羊藿苷能够抑制其下降,缓解肾阳虚症状,因缓解肾阳虚小鼠睾酮及性腺雄激素受体基因的表达下调[9]。通过观察淫羊藿苷对衰老大鼠睾丸组织基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9) 表达的影响,显示淫羊藿苷对 D-半乳糖所致的衰老大鼠睾丸损伤有明显的保护作用,其机制可能与上调 MMP-2、MMP-9水平有关[10]。黄酮类药物具有抗氧化、抗肿瘤和抗炎等作用,淫羊藿苷是黄酮类药物的一种,具有保护血管内皮细胞的作用,减少内皮细胞凋亡[11]。淫羊藿苷能减少生精细胞凋亡,促进精子发生,淫羊藿苷可通过调控蛋白激酶B(protein kinase B,AKT)通路,进一步增加p-AKT 蛋白的表达,从而抑制P53蛋白表达,抑制活性氧(reactive oxygen species,ROS)和保护线粒体膜电位,抑制细胞色素C释放和caspase-3活化,从而抑制细胞凋亡,淫羊藿苷还具有抑制S-亚硝基谷胱甘肽诱导细胞凋亡的作用[12]。不同哺乳动物的GnRH神经元分布明显不同,人类主要分布于弓状核和视前区,而啮齿动物在弓状核中几乎不能检测到GnRH神经元,与本实验结果相符合,啮齿动物最明显的GnRH神经元网络的组成神经元形成了一个松散而连续的隔区视前区-漏斗区通路[13],通过免疫细胞化学观察,显示模型组大鼠正中隆起处GnRH 阳性纤维的光密度却增加,正中隆起是GnRH分泌的最后通路,参与垂体促性腺激素合成和释放的管理,在正中隆起处刺激或抑制GnRH神经末梢,能够影响GnRH向垂体门脉系统的释放,低水平睾酮能促进GnRH神经元合成,增加轴浆运输,同时,环磷酰胺可能抑制GnRH神经纤维末梢释放GnRH,使GnRH并没有全部进入垂体门脉系统而是发生了GnRH的蓄集;而淫羊藿苷治疗组未见GnRH在正中隆起的蓄集现象,高水平睾酮能抑制GnRH神经元合成,减少轴浆运输[14]。本研究结果显示各组血清FSH、LH水平无显著改变,与章振保等[15]研究结果相似,但并不能说明环磷酰胺和淫羊藿苷对腺垂体前叶促性腺细胞没有直接作用,因垂体-性腺轴存在负反馈调节机制,睾酮水平降低能促进腺垂体前叶促性腺细胞分泌FSH、LH,睾酮水平提高负反馈调节促性腺细胞分泌FSH、LH减少,而FSH、LH的分泌也受GnRH的调控,故各组FSH和LH维持相对平衡。总之,本研究结果表明,环磷酰胺能诱导睾丸生精障碍,促进生殖细胞凋亡,淫羊藿苷可改善睾丸生精小管结构,促进精子发生,减少生殖细胞凋亡,为男性不育症中药治疗提供理论依据,具有重要的临床意义。

图1 睾丸组织观察,H-E染色,标尺=100μm,×100。A:空白对照组;B:阴性对照组;C:模型组;D:淫羊藿苷治疗组.
图2 睾丸生殖细胞凋亡的观察,TUNEL,标尺=100μm,×100。↑:凋亡细胞。A:空白对照组;B:阴性对照组;C:模型组;D:淫羊藿苷治疗组.
图3 正中隆起()GnRH阳性纤维观察,SABC法,标尺=100μm,×100。↑:GnRH阳性纤。A:空白对照组;B:阴性对照组;C:模型组;D:淫羊藿苷治疗组.
Fig 1 Observation of testicular tissue,H-E staining,bar=100μm,×100.A:Blank control group; B:Negative control group; C:Model group; D:Icariin treatment group.
Fig 2 Observation of germ cell apoptosis in testicular seminiferous tubules,TUNEL method,bar=100μm,×100.↑:Apoptotic cells.A:Blank control group; B:Negative control group; C:Model group; D:Icariin treatment group.
Fig 3 Observation of GnRH-positive fibers in median eminence (),SABC method,bar=100μm,×100.↑:GnRH-positive fibers.A:Blank control group; B:Negative control group; C:Model group; D:Icariin treatment group.
参 考 文 献
[1] Dada R,Gupta N P,Kucheria K. Mdecular screening for Yq microdeletion in men with idiopathic oligozoospermia and azoospermia[J]. J Biosci,2003,28(2):163-168.
[2] Van den Berg H,Furstner F,van den Bos C,et al.Decreasing the number of MOPP courses reduces gonadal damage in survivors of childhood Hodgkin disease[J].Pediatr Blood Cancer,2004,42(3):210-215.
[3] 徐叔云,卞如濂,陈修,主编.药理学实验设计及统计学分析[M].第3版.北京:人民卫生出版社,2003:198-201.
[4] 章振保,杨庆涛,杨镜秋,等.淫羊藿甙、菟丝子提取物对雄激素部分缺乏大鼠生殖保护作用的比较研究[J].中国男科学杂志,2006,20(8):13-18.
[5] Paxinos G,Watson C.The rat brain in stereotaxic coordinates[M].Australia:Academic Press,1986.
[6] 韩咪莎,林珊,高学勇.环磷酰胺对雄性大鼠生殖免疫功能的影响[J].中国组织化学与细胞化学杂志,2011,20(6):596-600.
[7] Das U B,Mallick M, Debnath J M,et al.Protective effect of ascorbic acid on cyclophosphamide-induced testicular gametogenic and androgenic disorders in male rats[J].Asian J Androl,2002,4(3):201-207.
[8] 佘白蓉,秦达念,王晨,等.淫羊蕾总黄酮对雄性大鼠生殖功能影响的初步研究[J].中国男科学杂志,2003,17(5):294-296.
[9] 包宇,杨建雄,孙润广.淫羊藿苷可缓解肾阳虚小鼠睾酮及性腺雄激素受体基因的表达下调[J].中国生物化学与分子生物学报,2011,27(2):174-179.
[10] 谢高宇,陈凯,刘浩然,等.淫羊藿苷对D-半乳糖致衰老大鼠睾丸组织MMP-2及 MMP-9表达的影响[J].中国老年学杂志,2012,32(16):3458-3460.
[11] Wang Y K,Hung Y J,Wei M,et al. Curculigoside attenuates human umbilieal vein endothelial cell iniury induced by H2O2[J]. J Ethnopharmacol,2010,132(1):233-239.
[12] 黄熹,项涛,徐石,等.淫羊藿苷通过AKT/P53通路抑制S-亚硝基谷胱甘肽诱导的内皮细胞凋亡[J].中华心血管病杂志,2016,44(8):707-713.
[13] Silverman A J,Jhamandas J, Renaud L P.Localization of luteinizing hormone-releasing hormone (LHRH) neurons that project to the median eminence[J].J Neurosci,1987,7:2312-2316.
[14] Cho B N,Seong J, Progesterone stimulates GnRH gene expression in the hypothalamus of ovariectomized,estrogen treated adult rats[J].Brain Res,1994,652:177-180.
[15] 章振保,杨庆涛,杨镜秋,等.淫羊藿甙、菟丝子提取物对雄激素部分缺乏大鼠生殖保护作用的比较研究[J].中国男科学杂志,2006,20(8):13-18.
(编辑: 叶 文)