苦蘵查尔酮合成酶编码基因(PaCHS1)的克隆及表达谱分析
2018-05-21朱宇佳卢江杰冯尚国展晓日应奇才孟一君沈晨佳王慧中
朱宇佳,郭 宏,孙 涛,卢江杰,冯尚国,展晓日,应奇才,孟一君,沈晨佳,王慧中
(杭州师范大学生命与环境科学学院 浙江省药用植物种质改良与质量控制技术重点实验室,浙江 杭州 310036)
类黄酮在植物体内具有重要生物学意义,已知它们有着控制生长素的运输、根系发育及向地性、种子萌发、植物与共生微生物的信号互作、紫外保护、抵御外来生物等作用[1]。类黄酮化合物中的花青素和花青素原是植物花、果实和种子色素的主要成分,其含量及成分的变化易于观察。同时,花青素和花青素原合成途径已成为研究植物次生代谢基因表达及调控的模式途径[2]。在高等植物中,类黄酮类物质是广泛存在的次生代谢物,在植物与环境的相互作用中起到了重要作用[3]。
查尔酮合成酶(chalcone synthase,CHS)是黄酮类物质代谢合成途径中的关键酶,它催化了该途径的第一步,即1分子的香豆酰CoA(coumaryl-CoA)与3分子的丙酚CoA (malonyl-CoA)生成4,5,7-三羟基黄烷酮(naringenin chalcone),该产物进一步衍生转化构成了各类黄酮化合物,进而作为多种黄酮类化合物的前体参与下游次生代谢产物的最终形成[4]。查尔酮合成酶是CHS超基因家族的核心酶,该超基因家族还包括一系列通过基因复制和功能分化衍生出的类CHS(CHS-like)蛋白[5]。从功能角度来看,查尔酮合成酶超基因家族的所有成员均属于生物聚酮合酶(polyketide synthases,PKS)中结构最简单的类型[6-7]。查尔酮合成酶超基因家族成员之间均具有高水平的序列同源性,在结构和催化机制上也具有极大的相似性,均是由40~45 ku亚基构成的同型二聚体,并且在活化位点处均含有由3个保守氨基酸Cys-His-Asn构成的三联体活性中心结构[8-9]。
苦蘵(PhysalisangulataL.),为茄科(Solanaceae)酸浆属(Physalis)一年生草本植物,广泛分布于海拔500~1 500 m的我国南方地区。作为一种有着悠久历史的药用植物,许多中药地方志都对苦蘵的药用性状及价值有着详细的描述[10]。现代医学最新研究表明,苦蘵主要化学成分为醉茄内酯、酸浆苦素、黄酮、多种酯的甙化合物、生物碱及甾醇等[11]。在苦蘵叶片的提取物中,分离得到一种黄酮苷类化合物myricetin 3-O-neohesperidoside,被证实是一种新的具有细胞毒性的黄酮类化合物[12]。此外,苦蘵中也分离出多种其他黄酮类物质,它们作为重要的活性物质,发挥着一系列抗氧化活性的作用[13]。由此可见,黄酮类物质是形成苦蘵药效的一类重要物质。已有研究表明,CHS是植物黄酮、异黄酮类物质合成的限速酶[14]。通过对苦蘵CHS 基因的研究,有助于进一步了解CHS 酶的催化机理,为进一步丰富和完善苦蘵类黄酮合成代谢途径研究奠定基础。
1 材料与方法
1.1 供试材料
苦蘵材料取自浙江省药用植物种质改良与质量控制技术重点实验室的温室大棚中,大肠埃希菌取自本实验室保存菌种DH5α;超表达载体pDL28-DHA,克隆载体pMD19-T采购自TaKaRa公司。
1.2 化学试剂
酵母提取物、蛋白胨、氯化钠、Agar、牛肉浸膏、酵母浸膏、蛋白胨、蔗糖、硫酸镁、Amp、Kan、X-Gal、IPTG、液氮、三氯甲烷、异丙醇、20×TBE缓冲液、DNA Marker(Trans2000)等。TaKaRa公司T4 DNA连接酶、T缓冲液10×、BSA(10×)、KpnⅠ、SalⅠ、PrimeSTAR Max DNA PolymerasePCR、 MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0、pMDTM19-T Vector Cloning Kit,康为世纪的高纯度质粒小提试剂盒、HiFiScript cDNA第一链合成试剂盒、Trizol。
1.3 苦蘵RNA提取以及cDNA模板的合成
取苦蘵果实,使用Trizol法提取总RNA。通过琼脂糖凝胶电泳和超微量紫外分光光度计检测RNA质量和浓度。把合格的RNA合成第一链cDNA,采用的是康为世纪的HiFiScript cDNA第一链合成试剂盒。根据反应体系,加入到PCR管中。轻轻振荡混匀,短暂离心防止管壁上残留溶液。42 ℃孵育40 min,85 ℃孵育5 min。冰置冷却后,-20 ℃保存。用苦蘵Actin引物(表1)PCR扩增cDNA,PCR反应条件:94 ℃ 5 min; 98 ℃ 30 s; 55 ℃ 30 s,72 ℃ 30 s,27个循环; 72 ℃ 10 min。并用1%琼脂糖凝胶进行电泳,检测得到的cDNA质量。

表1 引物名称及相关引物序列
1.4 PCR扩增目的基因
我们从中选取了CHS家族基因PaCHS1和PaCHS2,基于其全长序列,设计相应引物,并在引物末端添加KpnⅠ、BamHⅠ酶切识别位点,引物交由生工生物工程股份有限公司合成(表1)。目的基因扩增使用TaKaRa的PrimeSTAR Max DNA Polymerase PCR,20 μL反应体系。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 45 s,32个循环;72 ℃ 10 min。PCR结束后用1%琼脂糖凝胶进行电泳,并将PCR产物回收。在PCR产物3’端添加dA碱基,将平末端处理为黏性末端。按操作手册将试剂加好后在72 ℃下处理15 min,再进行电泳,并且琼脂糖回收。目的片段的纯化回收采用的是TaKaRa公司的胶回收试剂盒:MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0。把纯化的目的片段与T载体连接,连接使用的是TaKaRa的pMDTM19-T Vector Cloning Kit。按操作手册中的反应体系加好后16 ℃反应30 min。
1.5 重组质粒的提取,质粒的鉴定及测序
采用康为世纪的高纯度质粒提取试剂盒提取重组质粒。用1%琼脂糖凝胶电泳检测质粒长度。将提取的质粒37 ℃双酶切2 h,然后电泳验证酶切条带,双酶切体系试剂用量:质粒5 μL,T缓冲液10×3 μL,BSA(10×) 2 μL,KpnⅠ 1 μL,BamHⅠ 1 μL,ddH2O加到20 μL。将正确的菌液送到测序公司进行测序分析(上海桑尼生物技术有限公司)。
1.6 苦蘵查尔酮合成酶蛋白的生物信息学分析
利用ExPASy Proteomics Server上的在线工具Protparam(http://web.expasy.org/protparam/) 对PaCHS1/2基因编码蛋白的理化性质进行分析预测;采用SOMPA(http://www.expasy.ch/tools)和Phyre2在线软件(http://www.sbg.bio.ic.ac.uk/~phyre2/) 分别对PaCHS1/2基因编码蛋白进行二级结构分析与3D结构建模; SignalP4.0 Server ((http://www.cbs.dtu.dk/services/SignalP/)进行分泌蛋白预测;利用在线软件ProtComp v. 9.0 (http://linux1.softberry.com/berry.phtml) 进行蛋白定位信号预测。PaCHS1/2蛋白氨基酸序列比对利用NCBI的蛋白质序列数据库进行搜索,并通过ClustalW软件进行作图。通过MEGA 6.1 构建Neighbor-joining系统进化树,bootstrap重复次数为1 000次,其他采用默认设置。
1.7 35S亚细胞定位载体的构建
用相同的限制性内切酶KpnⅠ、BamHⅠ将测序正确的质粒和pCAMBIA1300GFP亚细胞定位载体进行双酶切37 ℃、6 h。酶切产物进行1.5%琼脂糖凝胶电泳,并将目的基因片段与GFP1300亚细胞定位空载酶切片段进行切胶回收;将目的片段连接到亚细胞定位载体GFP1300上,使用的是T4 DNA连接酶,将试剂按表格用量加入PCR管中,轻弹混匀并短暂离心,16 ℃过夜。将连接产物转化到大肠埃希菌感受态,然后在含Kan的LB固体培养基上培养12 h左右。挑选单菌落,将其扩大培养,并进行质粒提取,并用1%琼脂糖凝胶电泳检测质粒质量。采用双酶切法鉴定质粒连接情况,并进行1%琼脂糖凝胶电泳。
1.8 植物激素处理
采取坐果14 d后的未成熟果实为实验材料。将果实于10 μmol·L-1浓度生长素、细胞分裂素、水杨酸、脱落酸、茉莉酸乙烯中浸泡3 h。取出,以ddH2O漂洗3遍后,冻于液氮中待用。以未处理的果实为对照。
2 结果与分析
2.1 基于苦蘵转录组数据的CHS注释,序列拼接及克隆
搜索苦蘵转录组数据,得到12条与查尔酮合成酶相关的序列。利用上述得到的12条序列进行拼接,得到一条完整的苦蘵CHS编码基因序列,命名为PaCHS1。针对得到的序列,设计扩增引物。该基因的长度均在1 200 bp左右,最终扩增出与目的基因长度相仿的片段。将扩增出的DNA片段进行切胶回收,TA克隆后送测序公司测序。测序结果与转录组测序所得序列相一致。
2.2 苦蘵PaCHS1/2蛋白的理化性质
通过DNAStar软件,分析得到PaCHS1基因具有一个完整的开放阅读框(ORF),共有1 170个碱基。利用在线软件ProtParam对PaCHS1基因的编码蛋白的理化性质进行分析,结果表明,PaCHS1基因预测编码一个含有389个氨基酸的蛋白,该蛋白分子式为C1890H3040N508O562S20,分子质量为42.5 ku,蛋白等电点pI 6.28,带正电残基(Arg+Lys)为43个,带负电残基(Asp+Glu)为46个,该蛋白的不稳定系数为36.57,脂肪系数为93.47,平均亲水性系数为-0.049。
2.3 PaCHS1蛋白的结构比对
利用在线SignalP4.1Server 软件分析发现,PaCHS1蛋白均不含信号肽。利用在线工具WOLF PSORT分析PaCHS1蛋白的亚细胞定位,预测结果相同:分泌系统小泡定位系数48.0%,质膜定位系数36.0%,细胞骨架定位系数16.0%。利用Phyre2在线软件进行蛋白3D结构建模,PaCHS1蛋白的保守结构域三维结构模型如图1所示,结构模型以番茄CHS (Solyc05g053550.2.1)为模板,PsCHS1的211个氨基酸残基(占整个蛋白的54.2%)与对照模型具有100%的相似度。
2.4 不同植物CHS蛋白序列的比对及进化分析
将克隆得到PaCHS1蛋白序列提交至美国国立信息技术中心(NCBI)的数据库,进行相似性搜索。从搜索结果中,下载得到了12条与PaCHS1高度同源的蛋白序列。本研究选取的物种包括:甜辣椒(Capsicumannuum, NP_001311934), 番茄(Solanumlycopersicum, NP_001234036.2), 马铃薯(Solanumtuberosum,NP_001275296.1), 野茶树(Camelliasinensis,AGI02994.1), 小金鱼草(Misopatesorontium,CAJ44127), 杜鹃花(Rhododendronsimsii,CAC88858), 雷蒙德氏棉(Gossypiumraimondii,XP_012481763.1), 棉花(Gossypiumhirsutum,XP_016747999.1), 矮牵牛(Petuniaxhybrid,BAM17287.1),乌桕(Triadicasebifera,ARW29605.1), 麻风树(Jatrophacurcas,NP_001295723.1)和浙江红山茶(Camelliachekiangoleosa,AFC37242.1)。利用ClustalX2.1软件,将PaCHS1蛋白序列与下载得到的12条蛋白序列进行序列同源比对,结果表明,上述蛋白具有极高的序列相似度(图2)。这进一步说明,克隆得到的PaCHS1是苦蘵查尔酮合成酶的编码基因。

图1 PaCHS1蛋白的保守结构域三维结构模型

图2 PaCHS1蛋白序列与下载得到的12条蛋白序列的同源比较
为了分析PaCHS1蛋白与其他物种序列的进化关系,通过MEGA6.1软件(N-J法)构建不同植物之间CHS蛋白的系统进化树(图3)。结果表明,克隆得到的两个PaCHS1蛋白与1,2下载得到的同源蛋白形成两个主要的分支:聚类Ⅰ、聚类Ⅱ和聚类Ⅲ。其中,苦蘵PaCHS1属于聚类Ⅰ和小金鱼草的MoCHS1亲缘关系最近。
2.5 PaCHS1蛋白的亚细胞定位
利用克隆到的PaCHS1的全长序列,构建35S∶PaCHS1∶GFP载体,通过农杆菌介导,转入苦蘵叶肉细胞中,通过荧光共聚焦显微镜,观察PaCHS1蛋白的亚细胞定位情况。实验结果表明,35S∶GFP空载体定位于细胞各处,作为阳性对照。PaCHS1蛋白定位与细胞质和细胞膜中,这与生物信息学分析的结果基本一致。细胞质定位这一点,与PaCHS1蛋白的生物酶功能相一致(图4)。

图3 不同植物CHS蛋白系统进化树

图4 PaCHS1蛋白的亚细胞定位
2.6 PaCHS1基因的表达模式
实时定量RT-PCR检测基因在苦蘵的不同组织器官中的表达图谱。结果表明,PaCHS1基因在各个器官中都有一定的表达,其中在果实中的表达水平最高,在茎中的表达水平最低。此外,在叶片,根和花器官中皆有一定的表达(图5)。我们又分析了PaCHS1基因在不同激素处理下的表达变化。结果表明,PaCHS1基因的表达水平受到不同激素的调控。PaCHS1受到茉莉酸(JA)的强烈诱导,而受到赤霉素(GA)、乙烯(ethylene)和细胞分裂素(cytokinin)的强烈抑制。有意思的是,PaCHS1的表达水平在茉莉酸的处理下上升超过5倍,这说明PaCHS1和茉莉酸密切相关(图6)。
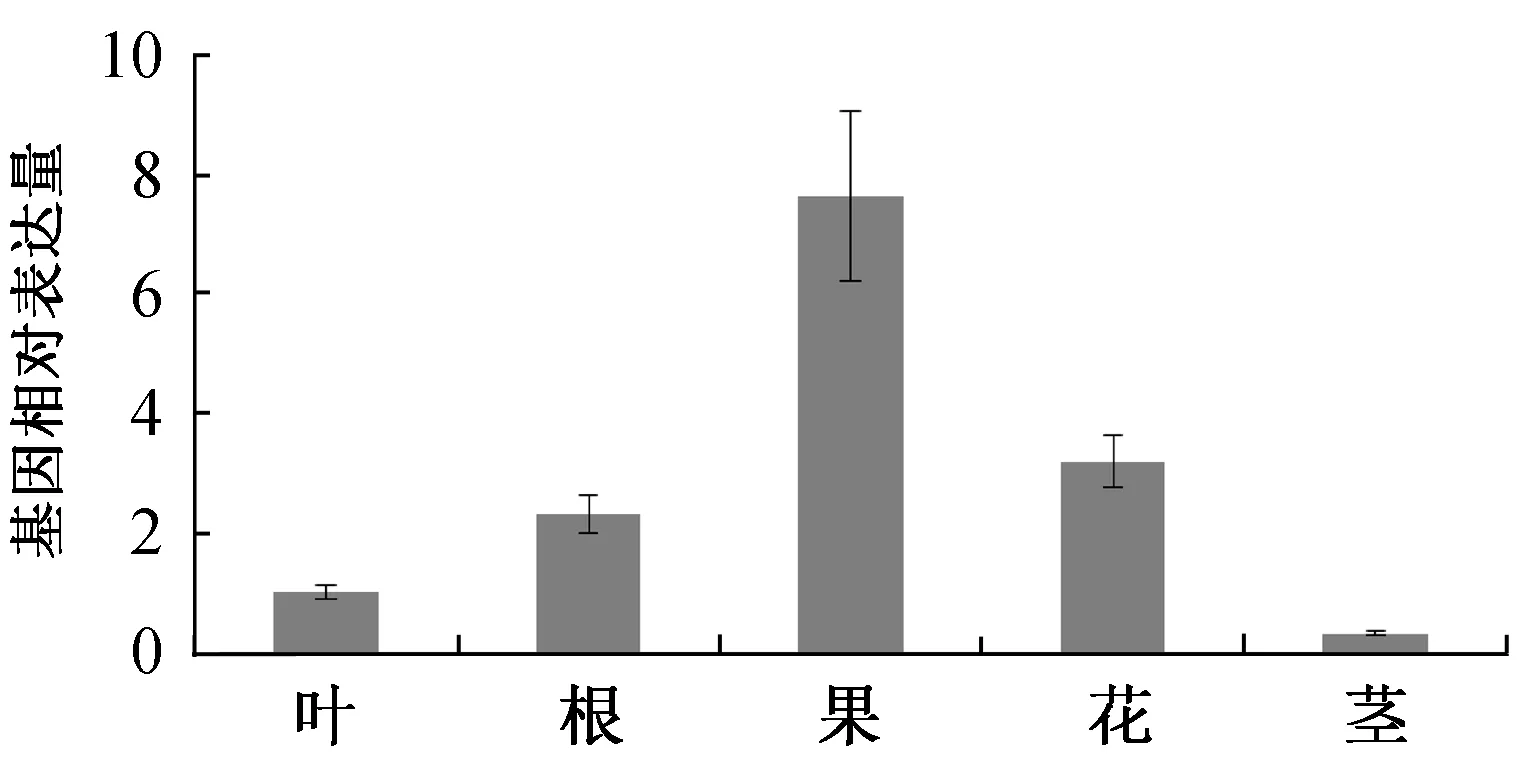
图5 PaCHS1基因在苦蘵不同组织器官中的表达

图6 PaCHS1基因在不同激素调控下的表达水平
3 讨论
苦蘵作为一种历史悠久的药用植物,较早地被记载于药典中。近年来,苦蘵的药用价值得到了深入的开发,多种活性物质陆续得到了鉴定[15]。最近的研究表明,苦蘵中存在的多种抗癌物质,如酸浆苦素A和B(physalin A 和B)等,都具有体外的抗肿瘤活性[16-17]。随着科技的进步,更多苦蘵活性物质的功能和药效也将得到解析。黄酮类物质,作为一种常见代谢物质,广泛参与植物活性物质的合成。同时,作为其他代谢途径的前体物,黄酮类物质还影响着植物其他次生代谢途径[18]。
通过转录组测序,我们得到了大量基因序列,从中筛选得到了一个CHS的编码序列。本实验中PaCHS1序列是采用同源克隆方法首次从苦蘵中克隆到CHS的编码基因,并对其进行了初步的生物信息学分析。PaCHS1与其他物种的CHS有较高的同源度。同时,其他生物信息学分析还表明,PaCHS1蛋白没有跨膜结构,不含有信号肽,是非分泌蛋白。而亚细胞定位预测将蛋白定位于细胞膜和细胞质中,符合其为代谢酶的特征,满足CHS蛋白发挥催化作用的要求[4]。由此可见,所克隆的PaCHS1为查尔酮合成酶编码基因CHS的同源基因,这为更加全面地研究苦蘵次生代谢的调控机制以及黄酮合成与激素之间的相互联系提供了参考。
取苦蘵不同部位的组织器官进行PaCHS1的表达分析实验,为进一步研究PaCHS1的作用方式具有一定的参考价值。定量PCR的实验结果表明,PaCHS1基因在苦蘵各个组织中均有表达,这说明黄酮类物质广泛存在于苦蘵体内。有研究表明,不同成熟期金樱子果黄酮类物质的含量和种类有着很大的差别[19]。此外,桃果实成熟过程中类黄酮类物质的积累也存在显著的变化[20]。我们的结果表明,PaCHS1的表达量在不同组织器官中的高低不同,存在明显的组织特异性。尤其在果实中,PaCHS1含量显著高于其他组织。这暗示了黄酮类物质的积累,可能与苦蘵果实成熟密切相关。苦蘵果实积累了大量次生代谢活性物质,研究果实发育成熟相关P450基因,为我们揭示苦蘵活性物质的生物合成提供了基础[21-22]。
大量研究表明,外源植物激素对植物次生代谢过程中的主要代谢物积累有着动态的影响。诸如,赤霉素、细胞分裂素、茉莉酸等植物激素,都能改变药用植物有效次生代谢物的含量和分布[23-24]。在本实验中,我们选取了其中常见的植物激素,如生长素、细胞分裂素、水杨酸、赤霉素、乙烯、油菜素内酯和茉莉酸等,比较了PaCHS1在多种激素处理下的表达变化。在药用植物中,茉莉酸甲酯是一种重要的次生代谢调控分子,外源施加茉莉酸甲酯可以明显的提高包括黄酮类物质在内的多种次生代谢物的积累[25-26]。我们发现,PaCHS1基因在茉莉酸的处理下,表达水平上升超过5倍。这说明,茉莉酸参与了PaCHS1控制的苦蘵黄酮合成途径的调控。
目前对苦蘵次生代谢功能基因鉴定和克隆尚未见诸报道,但其他高等植物的次生代谢调控关键基因的研究已经为苦蘵基因的克隆和代谢途径解析奠定了一定的基础。对苦蘵PaCHS1的克隆和表达谱的研究,可为研究苦蘵以黄酮类物质为代表的次生代谢途径打下基础,同时结合分子育种,为苦蘵活性物质的生产做出理论和实践的指导。
参考文献:
[1] HANASAKI Y, OGAWA S, FUKUI S.The correlation between active oxygens scavenging and antioxidative effects of flavonoids[J]. Free Radical Biology & Medicine,1994, 16(6):845-850.
[2] 诸姮, 胡宏友, 卢昌义, 等.植物体内的黄酮类化合物代谢及其调控研究进展[J]. 厦门大学学报(自然版), 2007, 46(增刊1):136-143.
[3] 沈忠伟, 许昱, 夏犇, 等.植物类黄酮次生代谢生物合成相关转录因子及其在基因工程中的应用[J]. 分子植物育种, 2008, 6(3):542-548.
[4] MARTIN C R. Structure, function, and regulation of the chalcone synthase[J]. International Review of Cytology-a Survey of Cell Biology, 1993, 147:233-284.
[5] JEZ J M, FERRER J L, BOWMAN M E, et al. Structure and mechanism of chalcone synthase-like polyketide synthases[J]. Journal of Industrial Microbiology & Biotechnology, 2001, 27(6):393-398.
[6] AUSTIN M B, NOEL J P. The chalcone synthase superfamily of type III polyketide synthases[J]. Natural Product Reports, 2003, 20(1):79-110.
[7] SCHRÖDER J. A family of plant-specific polyketide synthases: facts and predictions[J]. Trends in Plant Science, 1997, 2(10):373-378.
[8] 包颖, 郭昌锋, 陈少华, 等. 植物查尔酮合成酶超基因家族的分子进化[J]. 植物学报,2015, 50(1):55-71.
[9] SCHRÖDER J. The family of chalcone synthase-related proteins: Functional diversity and evolution[J]. Recent Advances in Phytochemistry,2000, 34:55-89.
[10] 中国科学院中国植物志编辑委员会. 中国植物志 第67卷第1册茄科[M]. 北京:科学出版社,1990.
[11] 杨燕军, 陈梅果, 胡玲, 等.苦蘵的化学成分研究[J]. 中国药学杂志,2013, 48(20):1715-1718.
[12] ISMAIL N, ALAM M. A novel cytotoxic flavonoid glycoside fromPhysalisangulata[J]. Fitoterapia,2001, 72(6):676-679.
[13] AUGUSTINE A A, UFUOMA O. Flavonoids from the leaves ofPhysalisangulataLinn[J]. Planta Medica,2013,79:PJ5.
[14] 牛天敏, 马会勤, 陈尚武.大豆查尔酮合成酶(CHS)基因的克隆、表达及其在雪莲提取液中的代谢产物分析[J]. 中国生物工程杂志,2007, 27(2):58-63.
[15] 陈喆, 朱凡凡, 马忠俊, 等.苦蘵内酯P在制备抗肿瘤药物中的应用: CN201410209628.2 [P]. 2014-08-06.
[16] ZHU F, DAI C, FU Y, et al. Physalin A exerts anti-tumor activity in non-small cell lung cancer cell lines by suppressing JAK/STAT3 signaling[J]. Oncotarget, 2016, 7(8):9462-9476.
[17] 方春生, 杨燕军. 酸浆苦素B的体外抗肿瘤活性研究[J]. 广州中医药大学学报, 2015(4):652-655.
[18] 王军妮, 黄艳红, 牟志美, 等. 植物次生代谢物黄酮类化合物的研究进展[J]. 蚕业科学, 2007, 33(3):499-505.
[19] 严振宇. 不同成熟期金樱子果黄酮类物质的含量与类别分析[D]. 衡阳:南华大学,2014.
[20] 周君, 陈宗玲, 张琼, 等. 套袋对桃果实成熟过程中酚酸类和类黄酮类物质积累的影响[J]. 园艺学报,2009, 36(12):1717-1724.
[21] 张辉.毛酸浆宿萼的化学成分研究[D]. 苏州:苏州大学,2010.
[22] 张初航. 锦灯笼的活性成分及质量评价研究[D]. 沈阳:沈阳药科大学,2009.
[23] 符小发. 外源植物激素对葡萄果实发育过程中主要次生代谢产物积累动态的影响[D]. 石河子:石河子大学,2010.
[24] 田娇, 刘园, 房敏峰.外源茉莉酸类激素对药用植物次生代谢的影响研究[J]. 天然产物研究与开发,2015, 27(1):185-190.
[25] 杨英, 郑辉, 李赟, 等.茉莉酸甲酯与二氢茉莉酮酸甲酯对悬浮培养的甘草细胞生长和黄酮积累的影响[J]. 植物生理学报,2008, 44(5):903-906.
[26] 刘雅静, 邢菊展, 张宇婷, 等.茉莉酸甲酯,蔗糖和氮源对蒙古黄芪愈伤组织生长和黄酮含量的影响[J]. 内蒙古大学学报(自然版), 2012, 43(1):65-70.
