ERF6基因在5种柑橘属植物的表达差异及启动子分析
2018-05-21叶杰君邬怡静何芯磊朱友银陈文荣郭卫东廖芳蕾
徐 瑞,叶杰君,邬怡静,何芯磊,朱友银,陈文荣,郭卫东,廖芳蕾*
(1.浙江师范大学 化学与生命科学学院, 浙江 金华 321004; 2.松阳县 松阳一中,浙江 丽水 323000;3.金华职业技术学院 农业与生物工程学院,浙江 金华 321007)
低温作为植物生长发育的一个重要环境因素,严重影响了农作物的产量和品质[1-2]。在低温条件下,植物细胞膜透性发生变化,丙二醛(MDA)数值越低,植物细胞受到的伤害越小,植物的抗寒性就越强[3]。柑橘属植物在我国的种植面积相对较大,其用途也十分广泛,但其抗寒能力却相对较弱[4],寒冷环境严重制约了柑橘属植物的产量。
佛手是生长在热带亚热带地区特有的芸香科植物,属香橼变种,无籽[5]。在我国其栽培地主要集中分布在浙江、四川等地区,其中浙江地区栽培的佛手是开发价值较高的观果植物[6-8]。但是佛手的抗寒能力较弱,低温易引起佛手冻伤致死。本地早、瓯柑和处红柚是三种耐寒性不同的柑橘属植物。枳是一种抗寒性很高的植物,与柑橘属植物亲缘关系也很近,常常用作植物抗寒性研究的重要材料。柑橘属植物的抗寒性差异与生理指标的相关性,仍需要相应的实验证据来说明。
为了适应环境,植物在长期的进化中也形成一套复杂的调节机制,以抵抗各种非生物胁迫。转录因子就在植物的非生物胁迫中发挥重要的作用。转录因子能与各种应激相关基因的启动子序列中的顺式作用元件相互作用,来上调或者下调下游基因的表达量[9]。AP2/ERF是与植物的非生物逆境胁迫相关的基因家族[10],可分为5个亚家族,分别是AP-2亚家族、RAV亚家族、DREB亚家族、ERF亚家族和其他亚家族[11];也可以根据AP2(DNA结合功能结构域)分为3类,具有单个AP2的为ERF亚家族[12]。AP2/ERF主要参与了植物的生物性、非生物性的胁迫应答[13]、转录后调控[14]、发育调控[15]及初生代谢物和次生代谢物的调控[16-17]。AP2/ERF家族的CBF亚家族在低温胁迫应答中发挥重要作用[18-19]。拟南芥在冷胁迫下被诱导的主要基因是DREB1/CBF,过表达的CBF2拟南芥植株可以增加调节冷胁迫相关基因的表达量,从而延缓植物叶片的衰老[22]。过表达的AtCBF甘薯中,其MDA和H2O2水平降低,增加了甘薯的抗氧化防御体系,耐寒性得到改善[20]。此外,CBF亚家族基因在各种植物如水稻、大豆和小麦中也发挥重要作用[21]。过表达这些基因的转基因植物表现出对多种非生物胁迫的耐受性。柑橘中已经分离到126个AP2/ERF的同源蛋白[23],但ERF基因在柑橘属植物中的抗寒分子机制还需要进一步研究。本实验研究柑橘属植物ERF6转录因子与5种柑橘属植物抗寒能力的关系,并克隆了佛手和枳ERF6基因的启动子序列,对启动子顺式作用元件的分析将有助于探索柑橘属植物抗寒分子机理。
1 材料与方法
1.1 植物材料
实验选取长势基本一致的两年生青皮佛手(C.medicacv. Qingpi)、本地早(C.aurantiumLinn)、瓯柑(C.suavissima. Hort. ex Tanaka)、枳(PoncirustrifoliateRaf.)和处红柚(C.grandischuhongyou)的盆栽苗为材料。其中佛手盆栽苗系浙江师范大学佛手实验基地——浙江锦林佛手有限公司提供,其他盆栽材料均为本实验室基地自行栽培。实验材料置于人工气候室,温度20 ℃(白天)/28 ℃(夜晚)条件下预培养3周,而后转至低温条件下(4 ℃)培养7 d。温度设置参照刘祖祺等[24]的方法。
1.2 柑橘属植物低温处理及生理特性分析方法
对5种柑橘类植物,在-4 ℃低温处理下设置不同的处理时间,分别为0、12、24、36、48和60 h,摘取植株当年生春夏枝由顶梢向下数5~11叶位的叶片为实验材料,确保叶片完整、无病虫害,测定其MDA含量[25]。
1.3 实时定量PCR(qRT-PCR)分析
在4 ℃低温条件下对5种柑橘属植物分别处理0、12、24、36、48 h,以0 h低温处理样品为对照组[26]。采用CTAB法提取总RNA,再将RNA样品使用宝生物公司的PrimeScript®Reverse Transcriptase试剂盒进行逆转录合成第一链cDNA。按照TaKaRa公司的SYBR Premix EX Taq试剂盒进行操作。反应条件为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸35 s,85 ℃延伸5 s,40个循环[27]。
1.4 青皮佛手和枳ERF6基因启动子克隆
采用Tail-PCR的方法对ERF6基因cDNA编码区序列的5’端进行未知侧翼序列的扩增,从而得到基因的启动子序列,3条特异引物由5’端到3’端的排列顺序分别为SP3、SP2、SP1(分别为第三轮、第二轮、第一轮巢式PCR特异引物,表1),PCR反应体系及程序参考叶杰君[28]的方法。
采用甜橙基因组库(http://citrus.hzau.Edu.cn/orange/tools/blast.p hp)在线获得枳ERF6(Cs1g14460)基因的信息,在该基因上游约2.0 kb区域设计引物,克隆枳ERF6基因启动子的序列,克隆所用的引物为5′-ACAGCTTCAATCAT AAGGCAGGTG-3′,3′-TGATATTTTAAGTAGCATAT GGCT-5′。
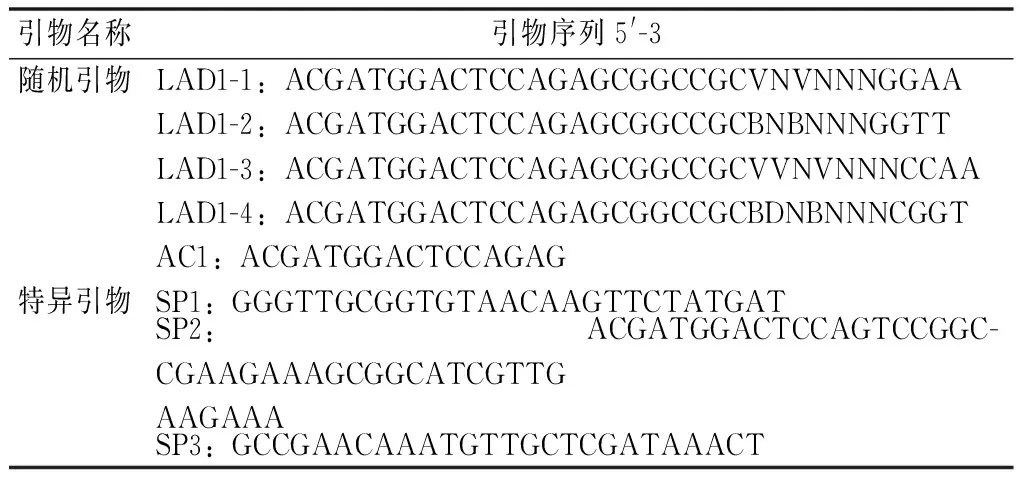
表1 ERF6基因Tail-PCR反应引物
PCR反应使用Premix ExTaq(version 2 plus dye) (TaKaRa,RR901 A)25 μL反应体系。用1%琼脂糖凝胶电泳检测扩增产物,并将扩增产物送公司测序,利用BLAST对测序结果进行序列同源性比对。
1.5 青皮佛手和枳ERF6基因启动子分析
对于克隆得到的青皮佛手和枳ERF6基因启动子序列,利用植物顺式元件数据库PlantCARE分析预测软件对上述启动子顺式作用元件进行预测分析。
2 结果与分析
2.1 不同处理时间对柑橘属植物MDA含量的影响
MDA是植物在逆境胁迫下膜脂过氧化的产物,其含量反映组织细胞在胁迫后的损伤程度。从图1中可以看出,随着低温处理时间的延长,这5种柑橘属植物叶片中的MDA含量逐渐增加,柑橘属植株叶片中的MDA含量与处理时间呈正相关的趋势。在低温冷胁迫的0~60 h,佛手和处红柚中MDA的含量明显要大于瓯柑、枳和本地早。而且,这5种柑橘属植物在低温处理的60 h内,佛手叶片中的MDA含量约增加4倍。处红柚叶片中的MDA含量增加3倍,瓯柑、本地早叶片中的MDA含量增加约3倍。MDA的最终含量由高到低依次为:佛手>处红柚>本地早>瓯柑>枳。MDA的最终含量可以反映植物遭受逆境胁迫的程度,即与抗逆能力呈负相关。因而,上述5种植物的抗逆能力大小依次为:枳>瓯柑>本地早>处红柚>佛手。相较于瓯柑、枳和本地早,佛手与处红柚遭受低温冷害的受损程度较大,其抗寒性也较弱。
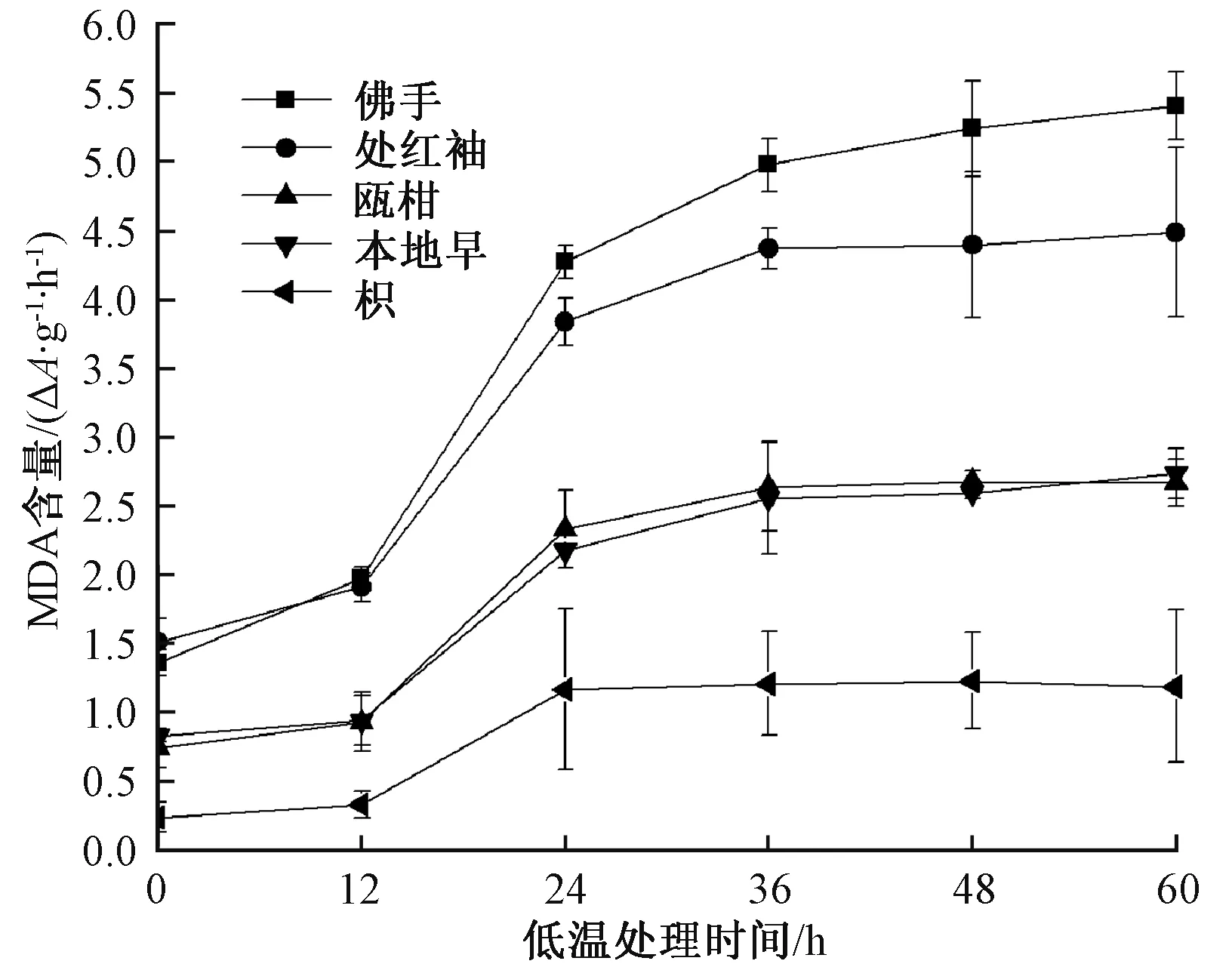
图1 不同低温处理条件下5种柑橘属植物叶片中MDA含量变化
2.2 不同处理时间对柑橘属植物ERF6表达量的影响
低温处理不同时间后分析ERF6基因在5种柑橘属植物的表达情况,结果如图2所示。5种柑橘属植物中ERF6基因表达量在12 h内都被低温诱导上调。在低温胁迫12 h后,佛手ERF6基因表达量呈下调趋势,48 h后表达量与对照相比没有差异。枳、本地早和处红柚ERF6基因均在胁迫36 h内表达量上调。上述结果说明,ERF6基因的响应时间有物种差异,以佛手ERF6对冷胁迫最敏感,响应时间最短。冷胁迫后,枳的最大诱导表达量为对照的316倍。本地早的最大诱导量为对照的61倍。处红柚的最大诱导表达量为对照的6倍。该结果表明,枳的ERF6基因对低温的响应最强烈。低温胁迫36 h后,枳、瓯柑、本地早、处红柚ERF6的表达都接近或达到了48 h内的最高值。48 h后,佛手、本地早、处红柚ERF6基因表达量下降至接近对照水平,但枳与瓯柑的ERF6表达量仍然是对照的2倍,说明枳与瓯柑的ERF6基因对冷胁迫的响应时间较长。根据ERF6表达量上调倍数排序,枳>瓯柑>本地早>处红柚>佛手,这与生理指标检测的抗寒性强弱顺序一致。
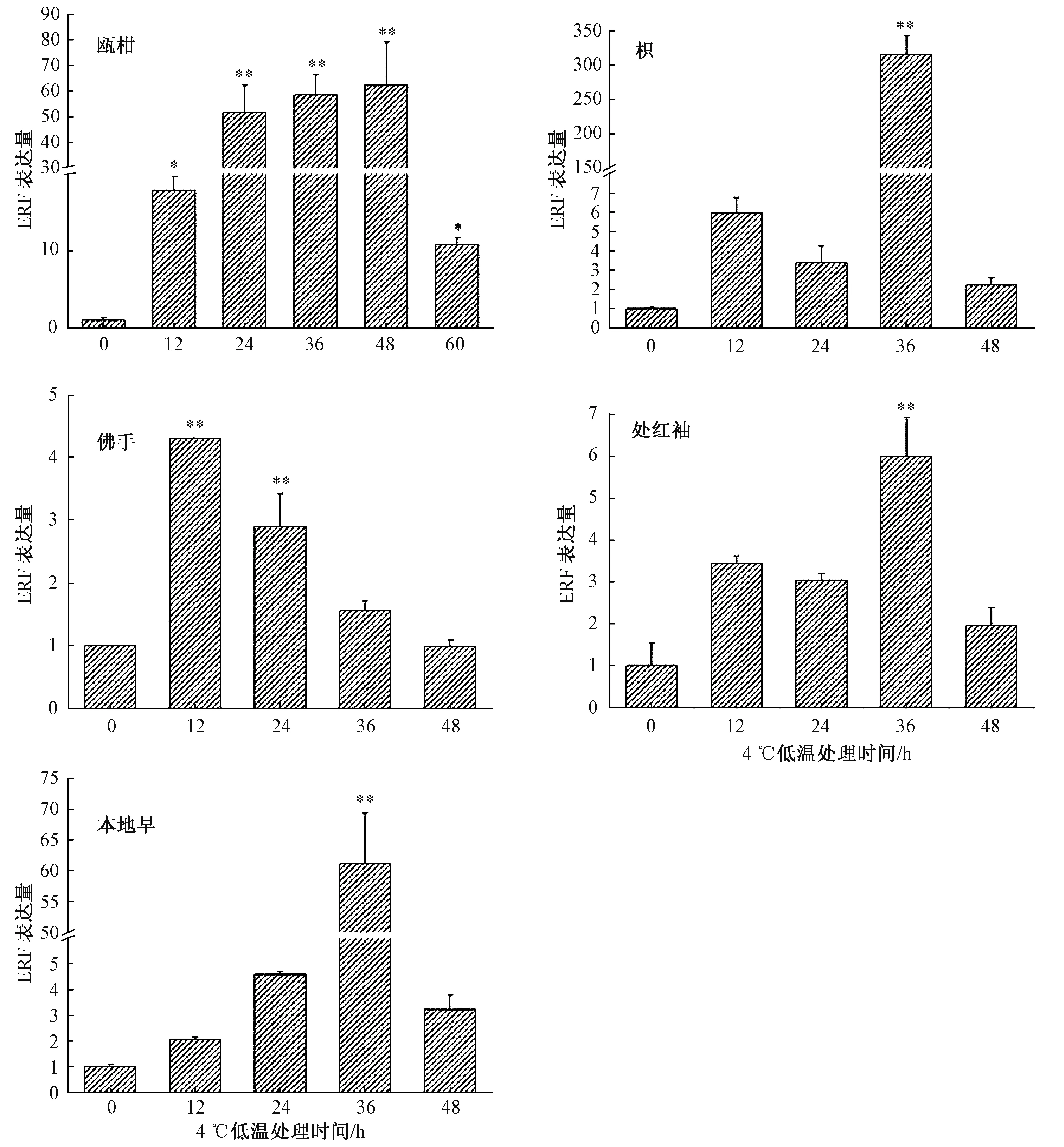
*,与0 h对照比较差异显著(P<0.05);**,与0 h对照比较差异极显著(P<0.01)图2 低温胁迫下5种柑橘属植物叶片中ERF6基因的表达差异
2.3 佛手和枳ERF6基因启动子序列
将克隆出的佛手、枳ERF6基因启动子的基因序列在NCBI中比对,发现其相似度为98%。用PlantCARE在线软件对ERF6启动子进行预测分析,佛手和枳ERF6基因启动子分析结果如图3和表2。两个启动子序列中都含有高等植物基因启动子的保守功能元件,表明它是具有潜在活性的启动子。佛手ERF6基因启动子序列有19个CAAT-box,这些顺式元件是控制和调节许多真核基因的转录的重要顺式作用因子;佛手ERF6启动子序列有23处也发现了RNA聚合酶Ⅱ的特异结合位点TATA-box,该位点是决定基因转录起始的选择,为RNA聚合酶的结合处之一。枳的ERF6启动子序列有33处发现了多个CAAT-box;枳ERF6启动子序列有28处发现了RNA聚合酶Ⅱ的特异结合位点TATA-box。枳ERF6启动子序列比佛手多出元件LTR和ABRE,LTR是植物冷响应基因启动子上对低温信号敏感的顺式作用元件,在低温胁迫下,会使得冷响应基因的转录活性增强,提高植物的耐寒性。此外,两段序列中都预测到了WRKY转录因子的结合位点W-box,以及ABRE、ERE、TATC-box、TCA-element等与激素信号传导途径相关的顺式作用元件。

图3 佛手和枳ERF6基因启动子序列及结构

元件名称元件功能元件比较佛手(数目)枳(数目)A-box顺式作用调节元件11ARE厌氧反应3AT-richsequence最大激发剂介导激活的元件1ATCT-motif参与光反应23Box4光反应31CAAT-box启动子增强区1933CATT-motif光响应元件1CCAAT-boxMYBHv1结合位点12ERE乙烯反应元件11F-box11G-Box顺式作用调节元件参与光反应12TATA-box转录起始元件2328TATC-box顺式作用元件参与赤霉素反应1TATCCAT/C-motif1TCA-element顺式作用元件参与水杨酸反应11TGA-element生长素反应元件11TGACG-motif顺式作用调节元件参与茉莉酸甲酯反应1Unnamed__4110circadian参与昼夜节律调控144cl-CMA2b光响应元件1ABRE顺式作用元件参与脱落酸反应性2GAG-motif光响应元件1GT1-motif光响应元件1LTR顺式作用元件参与低温反应1LTR顺式作用元件参与低温反应MBSMYB结合位点参与干旱诱导性1P-box赤霉素反应元件1Skn-1_motif顺式作用调节元件需要胚乳表达1Unnamed__32TC-richrepeats顺式作用元素参与防御和压力反应1
3 讨论
温度是影响植物生长发育的重要环境因素,低温对植物幼苗生长会产生一定抑制作用。抗寒性是植物在进化中为适应低温胁迫形成的一种重要能力,表现在一些特征化的生理指标上。前人在葡萄[29]、菊花[30]、木兰[31]等植物上以MDA含量等指标来表征抗寒性。本研究也测定了5种柑橘属植物经低温胁迫后上述生理指标,以比较柑橘属植物间的抗寒性。在低温条件下,植物受低温胁迫其膜脂将过氧化,MDA作为膜脂过氧化的最终产物,从膜上释放并在植物体内积累,从而对植物本身产生伤害,即MDA含量和抗寒性呈负相关。在本研究中,通过对低温胁迫下5种柑橘属植物的MDA含量进行测定,结果表明,其抗寒性强弱为枳>瓯柑>本地早>处红柚>佛手。瓯柑与本地早的抗寒能力比较接近,枳在5种柑橘属植物里抗寒能力最强,佛手最弱,这一结果与生产实践情况一致,也与前人的工作吻合[26,32]。
植物在低温胁迫下会发生一系列复杂的生理变化,涉及到基因表达调控、转录水平调节及转录后调节等。研究不同植物在低温胁迫下相关基因的表达差异,为揭示植物抗寒性的分子机制奠定一定的基础。本课题前期研究中,将佛手材料在4 ℃条件下处理24 h,获取低温胁迫后的佛手总RNA,利用抑制消减杂交技术筛选到与佛手冷胁迫差异的ESTs片段,并对于克隆得到的冷胁迫诱导基因进行测序比对鉴定,从而分离出了ERF6基因[33]。此结果表明,ERF6参与了佛手的低温胁迫应答。在此基础上,本文测定了4 ℃下ERF6基因在佛手、枳、本地早、瓯柑、处红柚等5种柑橘属植物中的表达,发现ERF6基因在5种植物中的表达量均会上调,确证了除佛手之外,ERF6基因在其他柑橘属植物中也参与了低温胁迫应答。
本实验也再次验证了佛手对低温条件敏感,在低温下ERF6基因的表达量很快上升,随后逐步下降并恢复到对照水平[26,33]。此外,ERF6在低温处理前后的表达量上调倍数及响应时间,也和这5种植物的抗寒性强弱呈正相关。枳在处理36 h内ERF6基因上调倍数最大,其次为瓯柑、本地早、处红柚,最后为佛手,与生理指标测定的抗寒性结果一致。因此,ERF6基因在冷胁迫后上调表达程度和响应周期,可以作为植物抗寒能力强弱的分子特征指标。启动子作为驱动基因转录的重要调控元件,在植物转录调控方面发挥重要作用,启动子中一些顺式作用元件可以与一些反式作用因子相结合来调控下游基因的表达,从而使植物对于外界信号刺激做出一定的响应。ERF亚家族番茄TSRF1可以与病程相关基因的启动子结合,增加水稻的耐旱性[34]。杨树转录因子ERF76参与了盐胁迫,该启动子区段长度不同,转录活性不同[35]。ERF启动子在柑橘属植物中的作用机制报道较少,启动子中响应低温胁迫的元件分析也较少。本研究克隆了佛手和枳的ERF6启动子,经生物信息学对启动子结构预测和比较,发现了在佛手和枳ERF6基因启动子序列上,分布着许多顺式作用元件。枳与佛手相比,在启动子区域多了1个LTR顺式作用元件,2个ABRE顺式作用元件。LTR顺式作用元件存在于低温胁迫应答基因启动子中,在低温信号的刺激下,冷响应基因的转录活性增强,对调控植物的低温响应起到重要的作用。LTR(CCGAAA)[36]顺式作用元件最初在大麦中被分离,参与植物的低温应答[37],后来在杨树中再次确认了该元件对低温胁迫的应答[38]。ABRE是拟南芥中对冷应激反应的顺式调节元件,参与脱落酸应答[39]。较多的LTR或ABRE顺式作用元件,表明该基因对低温胁迫的响应能力较强,在枳ERF6的启动子里LTR、ABRE元件较佛手多,可能使得枳的抗寒性较佛手强。综上,启动子低温胁迫响应的顺式元件的差异,是导致佛手和枳抗寒性差异的原因。
参考文献:
[1] GUO Q, FORD G M, AGRAWAL R, et al. Ink formulation and low-temperature incorporation of sodium to yield 12% efficient Cu (In, Ga)(S, Se) 2 solar cells from sulfide nanocrystal inks[J]. Progress in Photovoltaics: Research and Applications, 2013, 21(1): 64-71.
[2] KASUGA M, MIURA S, SHINOZAKI K, et al. A combination of the Arabidopsis DREB1A gene and stress-inducible rd29A promoter improved drought-and low-temperature stress tolerance in tobacco by gene transfer[J]. Plant and Cell Physiology, 2004, 45(3): 346-350.
[3] 陈钰,郭爱华,姚延梼.低温胁迫对杏电解质外渗率的影响[J].河南农业科学,2008,37(2):85-87.
[4] HARA M, TERASHIMA S, FUKAYA T, et al. Enhancement of cold tolerance and inhibition of lipid peroxidation by citrus dehydrin in transgenic tobacco[J]. Planta, 2003, 217(2): 290-298.
[5] 廖芳蕾,陈民管,桑丹,等.佛手种质资源遗传多样性的ISSR分析[J].园艺学报,2013,40(11):2222-2228.
[6] YANG L, YE J, GUO W D, et al. Differences in cold tolerance and expression of two fatty acid desaturase genes in the leaves between fingered citron and its dwarf mutant[J]. Trees, 2012, 26(4): 1193-1201.
[7] YANG X, LI H, LIANG M, et al. Genetic diversity and phylogenetic relationships of citron (CitrusmedicaL.) and its relatives in southwest China[J]. Tree Genetics & Genomes, 2015, 11(6): 129.
[8] XU H, WU J, DU K, et al. Application of kinetic models and neural networks to predict the embedding rate during storage of fingered citron essential oil microcapsules[C]//Proceedings of the 2012 International Conference on Applied Biotechnology (ICAB 2012). Springer Berlin Heidelberg, 2014: 3-14.
[9] REHMAN S, MAHMOOD T. Functional role of DREB and ERF transcription factors: regulating stress-responsive network in plants[J]. Acta Physiologiae Plantarum, 2015, 37(9): 178.
[10] AGARWAL P K, AGARWAL P, REDDY M K, et al. Role of DREB transcription factors in abiotic and biotic stress tolerance in plants[J]. Plant Cell Reports, 2006, 25(12): 1263-1274.
[11] SAKUMA Y, LIU Q, DUBOUZET J G, et al. DNA-binding specificity of the ERF/AP2 domain of Arabidopsis DREBs, transcription factors involved in dehydration-and cold-inducible gene expression[J]. Biochemical and Biophysical Research Communications, 2002, 290(3): 998-1009.
[12] LICAUSI F, OHME-TAKAGI M, PERATA P. APETALA2/Ethylene Responsive Factor (AP2/ERF) transcription factors: mediators of stress responses and developmental programs[J]. New Phytologist, 2013, 199(3): 639-649.
[13] JISHA V, DAMPANABOINA L, VADASSERY J, et al. Overexpression of an AP2/ERF type transcription factor OsEREBP1 confers biotic and abiotic stress tolerance in rice[J]. PloS One, 2015, 10(6): e0127831.
[14] LICAUSI F, VAN DONGEN J T, GIUNTOLI B, et al. HRE1 and HRE2, two hypoxia-inducible ethylene response factors, affect anaerobic responses in Arabidopsis thaliana[J]. The Plant Journal, 2010, 62(2): 302-315.
[15] QI W, SUN F, WANG Q, et al. Rice ethylene-response AP2/ERF factor OsEATB restricts internode elongation by down-regulating a gibberellin biosynthetic gene[J]. Plant Physiology, 2011, 157(1): 216-228.
[16] XU Y, WU H, ZHAO M, et al. Overexpression of the transcription factors GmSHN1 and GmSHN9 differentially regulates wax and cutin biosynthesis, alters cuticle properties, and changes leaf phenotypes in Arabidopsis[J]. International Journal of Molecular Sciences, 2016, 17(4): 587.
[17] SHI J X, MALITSKY S, DE OLIVEIRA S, et al. SHINE transcription factors act redundantly to pattern the archetypal surface of Arabidopsis flower organs[J]. PLoS Genetics, 2011, 7(5): e1001388.
[18] ZHANG G, CHEN M, LI L, et al. Overexpression of the soybean GmERF3 gene, an AP2/ERF type transcription factor for increased tolerances to salt, drought, and diseases in transgenic tobacco[J]. Journal of Experimental Botany, 2009, 60(13):3781-3796.
[19] ZHAI Y, SHAO S, SHA W, et al. Overexpression of soybean GmERF9 enhances the tolerance to drought and cold in the transgenic tobacco[J]. Plant Cell, Tissue and Organ Culture, 2017, 128(3): 607-618.
[20] JIN R, KIM B H, JI C Y, et al. Overexpressing IbCBF3 increases low temperature and drought stress tolerance in transgenic sweetpotato[J]. Plant Physiology and Biochemistry, 2017,118:45-54.
[21] WANG H, WANG H, SHAO H, et al. Recent advances in utilizing transcription factors to improve plant abiotic stress tolerance by transgenic technology[J]. Frontiers in Plant Science, 2016(7):67.
[22] SHARABI-SCHWAGER M, LERS A, SAMACH A, et al. Overexpression of the CBF2 transcriptional activator in Arabidopsis delays leaf senescence and extends plant longevity[J]. Journal of Experimental Botany, 2010, 61(1): 261-273.
[23] XIE X, SHEN S, YIN X, et al. Isolation, classification and transcription profiles of the AP2/ERF transcription factor superfamily in citrus[J]. Molecular Biology Reports, 2014, 41(7): 4261-4271.
[24] 刘祖祺,张连华,朱培仁.用放射免疫法分析柑桔抗寒锻炼中游离和结合态脱落酸的变化[J].园艺学报, 1990, 17(3):197-202.
[25] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007: 152-155.
[26] 曹诣斌,石瑞,陈文荣,等.低温胁迫下佛手和枳乙烯应答因子6 (ERF6) 表达变化的比较分析[J]. 园艺学报, 2011, 38(10): 1873-1882.
[27] 廖芳蕾,韩晓霞,陈文荣,等.佛手果形发育观察及果形相关基因表达分析[J].园艺学报, 2016, 43(11): 2141-2150.
[28] 叶杰君.柑橘类植物ERF6和GRAS基因的低温胁迫应答及启动子序列分析[D].金华:浙江师范大学,2013.
[29] 金明丽,徐继忠,张钢. 苹果砧木枝条电阻抗参数与其抗寒性的关系[J]. 园艺学报, 2011,38(6):1045-1051.
[30] 许瑛,陈煜,陈发棣, 等. 菊花耐寒特性分析及其评价指标的确定[J]. 中国农业科学, 2009,42(3):974-981.
[31] 李刚,姜卫兵,翁忙玲, 等. 木兰科6种常绿树幼苗抗寒性的初步研究[J]. 园艺学报, 2007,34(3):783-786.
[32] 陈文荣, 叶杰君, 李永强,等. 佛手低温胁迫相关基因的差异表达[J]. 生态学报, 2013, 33(5):1594-1606.
[33] 石瑞. 寒胁迫下佛手差异表达基因的研究[D]. 金华:浙江师范大学, 2011.
[34] QUAN R, HU S, ZHANG Z, et al. Overexpression of an ERF transcription factor TSRF1 improves rice drought tolerance[J]. Plant Biotechnology Journal, 2010, 8(4):476.
[35] YAO W, WANG S, ZHOU B, et al. Characterization of ERF76 promoter cloned fromPopulussimonii×P.nigra[J]. Acta Physiologiae Plantarum, 2017, 39(11):249.
[36] LUAN D D, KORMAN M H, JAKUBCZAK J L, et al. Reverse transcription of R2Bm RNA is primed by a nick at the chromosomal target site: a mechanism for non-LTR retrotransposition[J]. Cell, 1993, 72(4): 595-605.
[37] DUNN M A, WHITE A J, VURAL S, et al. Identification of promoter elements in a low-temperature-responsive gene (blt4.9) from barley (HordeumvulgareL.)[J]. Plant Molecular Biology, 1998, 38(4): 551-564.
[38] MAESTRINI P, CAVALLINI A, RIZZO M, et al. Isolation and expression analysis of low temperature-induced genes in white poplar (Populusalba)[J]. Journal of Plant Physiology, 2009, 166(14): 1544-1556.
[39] MUNDY J, YAMAGUCHI-SHINOZAKI K, CHUA N H. Nuclear proteins bind conserved elements in the abscisic acid-responsive promoter of a rice rab gene[J]. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(4): 1406-1410.
