血清Irisin水平与肱-踝动脉脉搏波传导速度、踝臂指数相关性分析
2018-05-21宋昌鹏伍熙郭颖郑欣馨鲁洁房晓楠黄晓红
宋昌鹏,伍熙,郭颖,郑欣馨,鲁洁,房晓楠,黄晓红
Irisin是新发现的由肌肉组织分泌的肽类激素,主要由FNDC5裂解产生。运动刺激机体表达过氧化物酶体增殖受体γ辅激活因子α(PGC1-α),而PCG-1α可上调肌肉FNDC5基因表达,增加血清Irisin浓度[1]。动物实验[1]发现,Irisin能促使小鼠白色脂肪细胞发生棕色脂肪细胞样改变,此外Irisin增加白色脂肪组织解偶联蛋白1(UCP1)的表达,引起线粒体氧化呼吸的电子传递和脂肪细胞氧耗的增加,增加能量消耗和改善胰岛素抵抗[2]。尽管其病理生理机制不是很明确,但近期研究发现血清Irisin水平与肥胖、2型糖尿病等代谢综合征之间存在相关性。而肥胖、2型糖尿病、代谢综合征是动脉粥样硬化发生发展的重要危险因素[3-6]。研究发现血清Irisin水平是十年冠心病风险的重要预测因子[6,7]。但Irisin与大动脉硬化及外周血管疾病相关性尚少有研究。脉搏波传导速度(PWV)能反映动脉顺应性僵硬度,比较常用的测量部位是颈-股动脉、肱-踝动脉(Ba)、颈-踝动脉及颈-桡动脉[8,9]。踝臂指数是无创探测周围动脉硬化的方法,是外周血管病、心脑血管事件的强有力预测因子[10,11]。本研究拟通过分析血清Irisin水平与Ba-PWV和踝臂指数的相关性来评价血清Irisin在大动脉硬化及外周动脉粥样硬化诊治中的价值。
1 资料与方法
对象:连续入组2015-04至2016-04于阜外医院特需中心18病区住院的患者147例患者,其中男性120例,平均年龄60.25岁。纳入标准:(1)年龄在18~80岁之间;(2)患者均知情同意,自愿参加。排除标准:(1)脑梗死、脑出血等脑血管事件急性期;(2)心肌梗死急性期;(3)肝功能不全、肾功能不全;(4)造血系统疾病、肿瘤。按照上述标准,共入选患者147例。详尽收集患者的临床资料,包括病史及住院期间的相关化验检查。
血清Irisin水平检测:入院后次日清晨空腹抽取静脉血5 ml,于抗凝管中静置后,3 000转/min离心15 min,分离血清取上清液,存放在-80℃冰箱保存,集中处理。采用酶联免疫吸附(ELISA)法检测血清Irisin水平,所用试剂盒为Irisin Competitive ELISA Kit (BIOVISION, 美国 )。
Ba-PWV及踝臂指数的测定:使用日本欧姆龙动脉硬化测定仪(型号OMRON BP-203 RPE III)自动测得Ba-PWV及肱动脉和踝动脉收缩压。研究对象在检测前至少休息5 min后,平卧于检查床上,保持全身放松,将袖带分别缚于双上臂及双下肢踝部,上臂气囊对准肱动脉,读出肱动脉收缩压,下肢袖带气囊处于下肢内侧,读出踝动脉收缩压,按照踝臂指数=踝动脉收缩压/肱动脉收缩压公式,计算一侧踝臂指数,同法计算另一侧踝臂指数(取踝臂指数值较低的纳入本研究)仪器自动测出两侧Ba-PWV,取测量值较高者为该研究对象的Ba-PWV。
分组:依据Ba-PWV[12]将入组患者分为Ba-PWV较高组(n=93,Ba-PWV≥1 400 cm/s)和Ba-PWV较低组(n=54,Ba-PWV<1 400 cm/s);依据踝臂指数[13]将入组患者分为踝臂指数较低组(n=31,踝臂指数<0.9)和踝臂指数较高组(n=116,踝臂指数≥0.9)。
统计学方法:采用SPSS 22.0软件进行统计学分析。计量资料以均数±标准差表示,采用t检验或U检验进行两组间比较。计数资料以百分数表示,采用Pearson卡方检验或Fisher精确检验进行两组间比较。所有表中有统计学意义的相关变量纳入多因素Logistic回归分析,判定外周动脉硬化的独立相关因素。所有分析以P<0.05为差异有统计学意义。
2 结果
入选患者的基础临床资料:表1显示,(1)Ba-PWV:与Ba-PWV较低组比较,Ba-PWV较高组患者年龄大(P=0.035)、高血压病发病率高(P=0.006)、血沉快(P=0.020)、空腹血糖高(P=0.002)、血清Irisin水平低(P=0.007)。(2)踝臂指数:与踝臂指数较低组比较,踝臂指数较高组患者年龄小(P=0.005)、血清低密度脂蛋白胆固醇低(P=0.004)、血清总胆固醇低(P=0.002)、空腹血糖低(P=0.007)、载脂蛋白B低(P=0.030)、吸烟人数多(P=0.045)、血清Irisin水平高(P=0.014)。
表1 147例患者基础临床资料(±s)
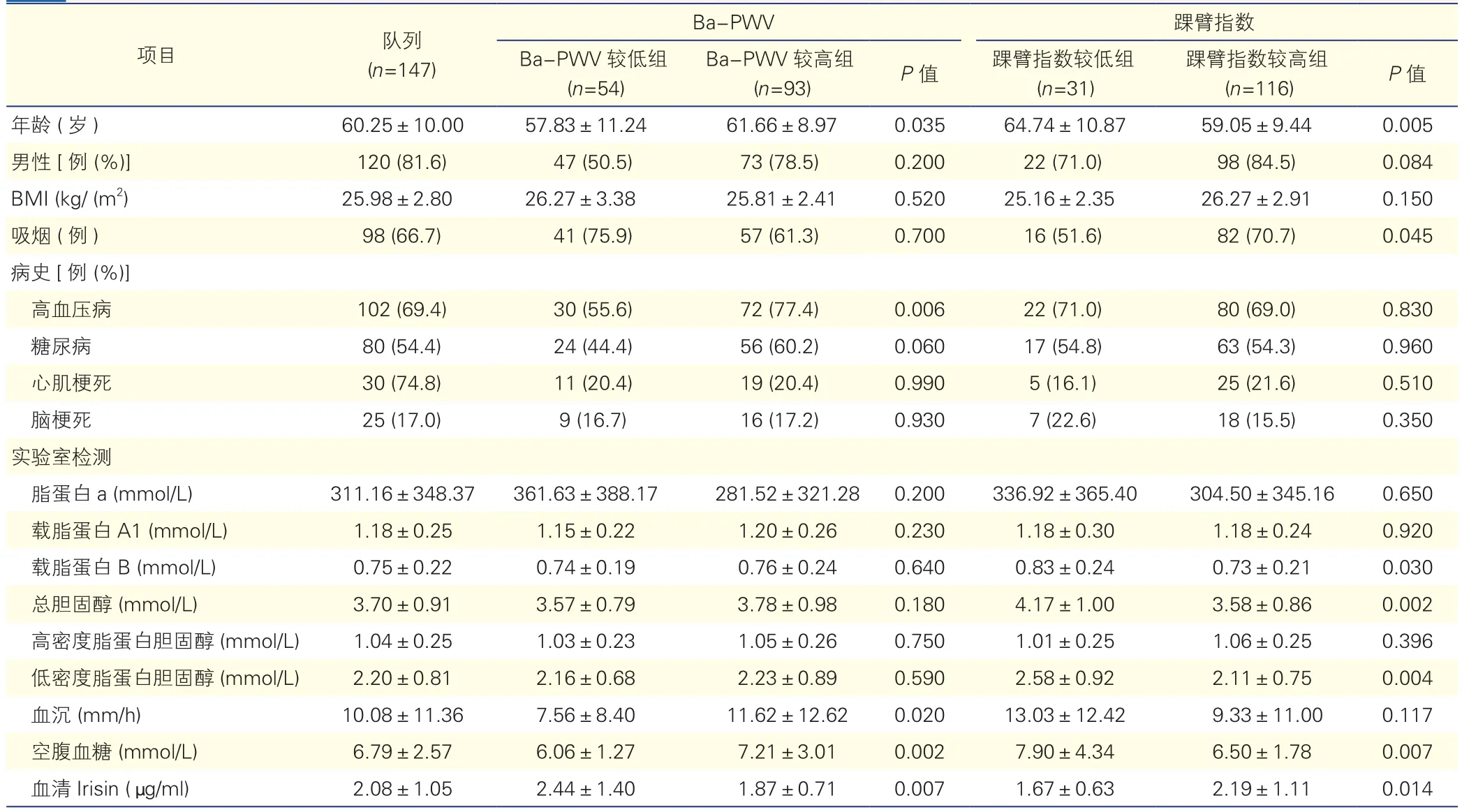
表1 147例患者基础临床资料(±s)
注:BMI:体重指数;Ba-PWV:肱-踝动脉脉搏波传导速度
项目 队列(n=147)踝臂指数Ba-PWVP值 踝臂指数较低组(n=31)踝臂指数较高组(n=116) P值年龄 (岁) 60.25±10.00 57.83±11.24 61.66±8.97 0.035 64.74±10.87 59.05±9.44 0.005男性 [例 (%)] 120 (81.6) 47 (50.5) 73 (78.5) 0.200 22 (71.0) 98 (84.5) 0.084 BMI (kg/ (m2) 25.98±2.80 26.27±3.38 25.81±2.41 0.520 25.16±2.35 26.27±2.91 0.150吸烟 (例) 98 (66.7) 41 (75.9) 57 (61.3) 0.700 16 (51.6) 82 (70.7) 0.045病史[例 (%)]高血压病 102 (69.4) 30 (55.6) 72 (77.4) 0.006 22 (71.0) 80 (69.0) 0.830糖尿病 80 (54.4) 24 (44.4) 56 (60.2) 0.060 17 (54.8) 63 (54.3) 0.960心肌梗死 30 (74.8) 11 (20.4) 19 (20.4) 0.990 5 (16.1) 25 (21.6) 0.510脑梗死 25 (17.0) 9 (16.7) 16 (17.2) 0.930 7 (22.6) 18 (15.5) 0.350实验室检测脂蛋白a (mmol/L) 311.16±348.37 361.63±388.17 281.52±321.28 0.200 336.92±365.40 304.50±345.16 0.650载脂蛋白A1 (mmol/L) 1.18±0.25 1.15±0.22 1.20±0.26 0.230 1.18±0.30 1.18±0.24 0.920载脂蛋白B (mmol/L) 0.75±0.22 0.74±0.19 0.76±0.24 0.640 0.83±0.24 0.73±0.21 0.030总胆固醇 (mmol/L) 3.70±0.91 3.57±0.79 3.78±0.98 0.180 4.17±1.00 3.58±0.86 0.002高密度脂蛋白胆固醇 (mmol/L) 1.04±0.25 1.03±0.23 1.05±0.26 0.750 1.01±0.25 1.06±0.25 0.396低密度脂蛋白胆固醇 (mmol/L) 2.20±0.81 2.16±0.68 2.23±0.89 0.590 2.58±0.92 2.11±0.75 0.004血沉 (mm/h) 10.08±11.36 7.56±8.40 11.62±12.62 0.020 13.03±12.42 9.33±11.00 0.117空腹血糖 (mmol/L) 6.79±2.57 6.06±1.27 7.21±3.01 0.002 7.90±4.34 6.50±1.78 0.007血清 Irisin (μg/ml) 2.08±1.05 2.44±1.40 1.87±0.71 0.007 1.67±0.63 2.19±1.11 0.014
血清Irisin与Ba-PWV的相关性(表2):将表1中Ba-PWV指标有差异的变量(年龄、高血压病史、血沉、空腹血糖、血清Irisin)纳入多因素向后逐步Logistic回归分析模型,结果显示:血清Irisin水平与高Ba-PWV呈负相关(偏相关系数为-0.559,P=0.003,OR=0.572,95%CI:0.394~0.831)。

表2 多因素向后逐步回归分析Ba-PWV≥1 400 cm/s的危险因素
血清Irisin与踝臂指数的相关性(表3):将表1中踝臂指数指标有差异的变量(年龄、空腹血糖、低密度脂蛋白胆固醇、总胆固醇、载脂蛋白B、吸烟、血清Irisin)纳入多因素向后逐步Logistic回归分析模型,结果显示:血清Irisin水平与低踝臂指数呈负相关(偏相关系数为-0.734,P=0.035,OR=0.480,95%CI:0.243~0.949)。
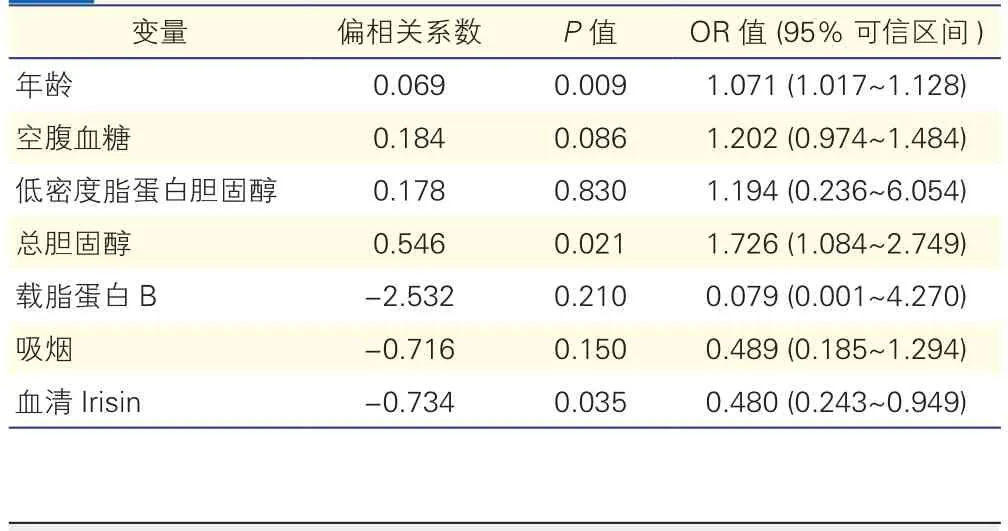
表3 多因素向后逐步回归分析踝臂指数≤0.9的危险因素
3 讨论
本研究旨在评价血清Irisin水平与大动脉硬化、弹性降低以及外周血管疾病之间的相关性,结果显示:血清Irisin浓度与大动脉硬化及外周血管疾病的发生有关。
Irisin是一种肌肉释放因子,最初由Bostrom等[1]报道,由FNDC5裂解产生,运动可增加FNDC5表达及裂解,增加血清Irisin水平。
有研究评价Irisin同动脉粥样硬化的相关性。Lee等[14]发现血清Irisin水平与颈动脉内膜中层厚度(CIMT)之间存在负相关,低血清Irisin水平是颈动脉粥样硬化的独立预测因素。另一项研究比较分析了高Syntax评分组(≥23分)、低Syntax评分组(<23分)、健康对照组患者血清Irisin水平后发现,Irisin可能是冠状动脉严重程度独立预测因子[15]。Park等[16]发现对冠心病经皮冠状动脉介入治疗(PCI)术后患者进行随访发现:Irisin是冠心病患者PCI术后1年内发生心血管事件的独立预测因子。
本研究结果与上述研究结果基本一致。该研究结果显示Ba-PWV较高组人群血清Irisin水平明显低于Ba-PWV较低组。此外踝臂指数较低组人群血清Irisin水平同样明显低于踝臂指数较高组,对常见大动脉硬化及动脉粥样硬化的相关危险因素进行多因素Logistic回归分析后,上述相关性仍存在,提示血清Irisin浓度与大动脉硬化及外周动脉疾病相关。目前认为动脉粥样硬化是大动脉硬化和外周动脉疾病的最常见原因。Ba-PWV及踝臂指数除可以反映大动脉及外周动脉粥样硬化严重程度,提示血清Irisin水平与机体大动脉及外周动脉粥样硬化存在相关性。
其可能的机制包括:Irisin增加白色脂肪组织解偶联蛋白1(UCP1)的表达,引起线粒体氧化呼吸的电子传递和脂肪细胞氧耗的增加,增加能量消耗。血清Irisin水平减低与肥胖显著相关,而肥胖是动脉粥样硬化的重要危险因素。血清Irisin水平减低增加胰岛素抵抗,研究发现Irisin与2型糖尿病的发生有明显相关性,而糖尿病与动脉粥样硬化存在明确相关性[5]。另一项研究发现:Irisin通过抑制AMPKSREBP2信号转导通路能抑制肝脏合成胆固醇。此外研究发现Irisin与动脉内皮功能相关:动物实验发现Irisin能通过腺苷酸活化蛋白激酶(AMPK)、丝/苏氨酸蛋白激酶(Akt)、内皮一氧化氮合成酶(eNOS)磷酸化,增加一氧化氮(NO)信号通路增加一氧化氮释放,减少内皮损伤,改善血管内皮功能[17]。
该研究存在一些不足:(1)该研究是单中心横断面研究;(2)该研究样本量相对较少,对于血清Irisin与Ba-PWV及踝臂指数的关系仍需大样本临床试验来验证。
总之,该研究发现血清Irisin浓度与Ba-PWV及踝臂指数之间存在相关性,提示血清Irisin浓度可能与大动脉硬化及外周动脉粥样硬化相关,可能成为机体动脉粥样硬化疾病研究的新的生物标记物。
参考文献
[1] Bostrom P, Wu J, Ye L, et al. A PGC1-alphadependentmyokine that drives brown-fat-like development of white fat andthermogenesis[J].Nature, 2012, 481(7382): 463-468. DOI: 10. 1038/nature10777.
[2] Roca-Rivada A, Castelao C, Senin LL, et al. FNDC5/irisinis not only a myokine but also an adipokine[J]. PLoS One, 2013, 8(4): e60563. DOI:10. 1371/journal. pone. 0060563.
[3] Stengel A, Hofmann T, Goebel-Stengel M, et al. Circulatinglevels of irisin in patients with anorexia nervosa and different stages of obesitycorrelation with body mass index[J]. Peptides, 2013, 39: 125-130.DOI: 10. 1016/j. peptides. 2012. 11. 014.
[4] Park KH, Zaichenko L, Brinkoetter M, et al. Circulatingirisin in relation to insulin resistance and the metabolic syndrome[J]. J Clin Endocrinol Metab, 2013, 98(12): 4899-4907. DOI: 10. 1210/jc. 2013-2373.
[5] Liu JJ, Wong MD, Toy WC, et al. Lower circulating irisin isassociated with typeIIdiabetes mellitus[J]. J Diabetes Complications, 2013, 27(4):365-369. DOI: 10. 1016/j. jdiacomp. 2013. 03. 002.
[6] Deng W. Association of serum irisinconcentrations with presence and severity of coronary artery disease[J]. Med SciMonit, 2016, 22: 4193-4197. DOI: 10. 12659/MSM. 897376.
[7] 卢俊颜, 向光大, 梅稳, 等. 鸢尾素改善载脂蛋白E基因敲除糖尿病小鼠动脉粥样硬化[J]. 中国循环杂志, 2015, 30(5): 492-497.DOI: 10. 3969/j. issn. 1000-3614. 2015. 05. 019.
[8] 唐世凡, 王朝晖, 程锡华, 等. 踝臂脉搏波速预测及诊断冠心病患者的价值[C]. 2017中国心脏大会(CHC), 2017, 32(z1): 82-82.
[9] Willum-Hansen T, Staessen JA, Torp-Pedersen C, et al. Prognostic value of aortic pulse wave velocity as index of arterial stiffness in the general population[J]. Circulation, 2006, 113(5): 664-670. DOI: 10.1161/CIRCULATIONAHA. 105. 579342.
[10] Criqui MH, Mitchell ME, Taylor HA, et al. Ankle-brachial index (ABI),abdominal aortic calcification(AAC), and coronary artery calcification(CAC): the Jacksonheart study[J]. Int J Cardiovasc Imaging, 2013,29(4): 891-897. DOI: 10. 1007/s10554-012-0145-y.
[11] 叶岚, 郑心田, 许纲, 等. 低踝臂血压指数与冠心病高危人群1年内因缺血性事件再住院的关系[C]. 2013中国心脏大会(CHC),2013, 28(z1): 91-91.
[12] Yamashina A, Tomiyama H, Arai T, et al. Brachial-ankle pulse wave velocity as a marker of atherosclerotic vascular damage and cardiovascular risk[J]. Hypertens Res, 2003, 26(8): 615-622. DOI: 10.1291/hypres. 26. 615.
[13] Newman AB, Shemanski L, Manolio TA, et al. The ankle-arm index as a predictor of thecardiovascular disease and the mortality in the cardiovascular health study[J]. Arterioscler Thromb Vasc Biol, 1999,19(3): 538-545. DOI: 10. 1161/01. atv. 19. 3. 538.
[14] Lee MJ, Lee SA, Nam BY, et al. Irisin, a novel myokine is an independent predictor for sarcopenia and carotid atherosclerosis in dialysis patients[J]. Atherosclerosis, 2015, 242(2): 476-482. DOI: 10.1016/j. atherosclerosis. 2015. 08. 002.
[15] Efe TH, Aar B, Ertem AG, et al. Serum Irisin level can predict the severity of coronary artery diseasein patients with stable angina[J].Korean Circ J, 2017, 47(1): 44-49. DOI: 10. 4070/kcj. 2016. 0079.
[16] Park SE, Park CY, Sweeney G. Biomarkers of insulin sensitivity andinsulin resistance: past, present and future[J]. Crit Rev Clin Lab Sci, 2015, 52(4): 180-190. DOI: 10. 3109/10408363. 2015. 1023429.
[17] Fu J, Han Y, Wang J, et al. Irisin Lowers blood pressure by improvement of endothelial dysfunction via AMPK-Akt-eNOS-NO pathway in the spontaneously hypertensive rat[J]. J Am Heart Assoc,2016, 5(11). Pii: e003433. DOI: 10. 1161/JAHA. 116. 003433.
