美花石斛SSR-PCR体系的优化研究
2018-05-21,
,
(1.贵阳中医学院药学院, 贵州 贵阳 550025; 2.贵州省农科院旱粮研究所, 贵阳 550006)
美花石斛(D.loddigesiiRolfe)又名粉花石斛,别名小环钗、环钗斛、小黄草等,为兰科石斛属多年生附生草本植物,以茎用,为贵州地道药材。早在《神农本草经》中就有记载,是被《中华人民共和国药典》(2000版)收载的石斛属原植物之一,自古以来就被认为是一种优质的药用石斛品种,具有滋阴清热、生津益胃、润肺止咳、延年益寿等功效;用于热病伤津、食少干呕、病后虚弱、阴伤目暗、食欲不振、遗精、肺结核、腰膝酸软无力等症[1]。由于其较高的药用价值,目前国内外市场的需求量越来越大。但是由于美花石斛对生境要求苛刻,生长缓慢,自然繁殖率极低,再加上环境污染和大量采伐树木,石斛赖以生存的野生生境遭到破坏,导致野生美花石斛资源已经严重枯竭,变为濒危植物种。
尽管当前关于导致物种濒危的原因以及应该采取什么样的方法和手段来有意义地保护物种等问题存在着不同的观点甚至争论[2],但毫无疑问,遗传多样性对物种的生存和发展起着决定性的作用。物种保护策略和措施的制定必须建立在对物种多样性水平和居群遗传结构充分了解的基础上。
目前研究植物遗传多样性和居群结构最常用的检测方法是采用DNA分子标记技术,特别是以电泳和PCR为基础的分子标记展现了良好的优越性,尤其是SSR标记(Simple Sequence Repeats),呈孟德尔方式遗传的共显性标记,揭示的多态性高,重复性好,被广泛用于遗传多样性检测。基于此,本研究拟采用正交设计方法,通过对影响PCR反应的5大因素组合优化,建立美花石斛的SSR-PCR成熟检测体系,为美花石斛的种质资源评价和遗传多样性分析奠定基础。
1 材料与方法
1.1 材 料
实验材料来自贵州省兴义市清水河居群,经花期鉴定为兰科石斛属植物美花石斛(D.loddigesiiRolfe)。
1.2 材料与引物
用于SSR-PCR反应的10×Buffer、MgCl2、TaqDNA聚合酶、dNTP来自大连宝生物有限公司;SSR引物序列来自于NCBI公共数据库,初步筛选后,选择条带清晰的CXY 06作为本次正交试验的供试引物,该引物的前引物与后引物序列:F:5’GAAAAGCAATCCAACAAC 3’ R:5’GTAAAGGAGAATAATGACC 3’。
1.3 基因组DNA的提取
选取幼嫩的叶片,采用CTAB改良法[3-4]提取石斛基因组DNA,利用核酸蛋白测定仪测定DNA样本的浓度,用1%的琼脂糖检测提取DNA的质量。
1.4 美花石斛SSR-PCR反应体系正交试验设计
对影响反应的5个因素Mg2+、dNTP、Taq酶、Primer、模板DNA,采用正交设计L16(45)进行试验,各因素水平见表1,共16个反应体系,2次重复。试验设计见表2。
表1 PCR反应因素水平

因素水平1234Mg2+(mmol/L)2.02.53.03.5dNTP(mmol/L)0.10.20.30.4Taq酶(U)0.50.751.01.5Primer(μmol/L)0.10.20.30.4DNA模板(ng)10203040
1.5 PCR扩增及产物的检测
PCR反应在美国Bio-Rad伯乐T 100 PCR仪上进行扩增,扩增程序见表3,采用6%的聚丙烯酰胺测序胶对扩增产物进行分离检测,银染,读带。
1.6 最佳反应体系的验证
从美花石斛引物中,选取多态性较好的引物CXY 01(F:5’GATAACGCAAGAGGAAAC 3’,R:5’ATGGCTCAAACTGTAGGC 3’),对5个不同居群的美花石斛的DNA进行扩增,通过电泳检测,以验证优化的美花石斛SSR-PCR反应的稳定性。
表2 PCR反应L16(45)正交试验设计

处理组合因素及水平Mg2+(mmol/L)dNTP(mmol/L)Taq酶(U)Primer(μmol/L)DNA模板(ng)12.00.10.50.11022.00.20.750.22032.00.31.00.33042.00.41.50.44052.50.10.750.34062.50.20.50.43072.50.31.50.12082.50.41.00.21093.00.11.00.420103.00.21.50.310113.00.30.50.240123.00.40.750.130133.50.11.50.230143.50.21.00.140153.50.30.750.410163.50.40.50.320
表3 PCR反应扩增程序
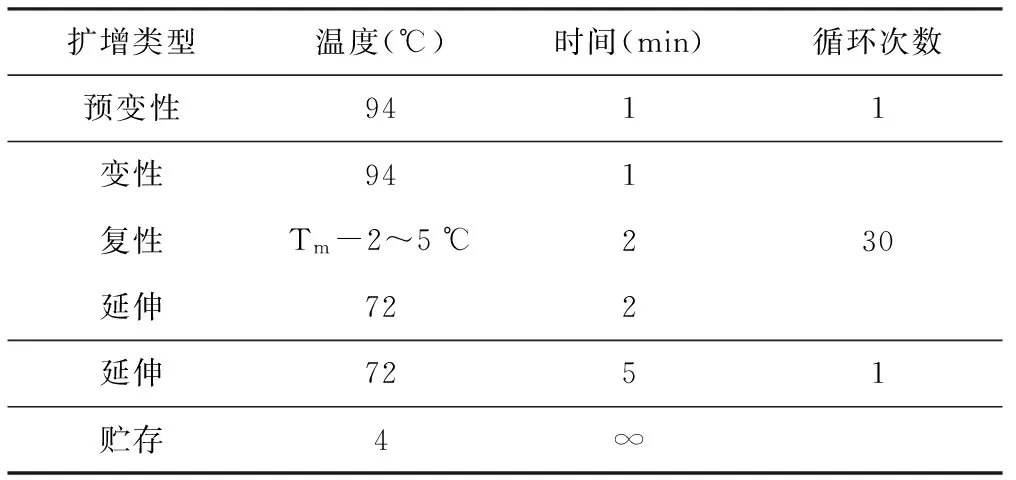
扩增类型温度(℃)时间(min)循环次数预变性9411变性941复性Tm-2~5℃230延伸722延伸7251贮存4∞
2 结果与分析
2.1 PCR扩增结果分析
从正交设计的16个处理的扩增检测结果(图1)可以看出,由于SSR-PCR体系的5个主要因素浓度的不同组合,在扩增效果上表现出明显的差异。处理4表现最佳,具有清晰稳定的条带,而处理1、2、3、5、6、7、8、9、14、15、16都呈现出条带模糊不清晰,处理10、11、12、13虽然具有一定的条带,但扩增效果与处理4具有一定的差异,在实际统计上,可操作性不强。PCR扩增体系中,5大因素各有其作用,Mg2+浓度是影响PCR结果的重要变量之一,它可以通过影响TaqDNA聚合酶的活性来影响PCR的扩增;dNTP是PCR扩增反应的原料,适当的浓度会提高反应的精确度,但浓度过高,错配几率会提高;Taq酶数量的变化对SSR条带强弱影响较大,浓度过高时也会出现更多的特异性条带;随着引物浓度的升高,扩增条带会逐渐增加;DNA与引物浓度有相同的变化规律,且模板浓度高时,有时背景则会较重[5]。因此,充分考虑各个主要因素,选择最佳的处理组合是下一步分子检测的关键所在。综合考虑各因素,处理4为最佳组合,即2.0 mmol/L Mg2+,0.4 mmol/L dNTPs,1.5 UTaq酶,0.4μmol/L引物,40 ng模板DNA。

图2 SSR标记CXY 02对不同居群的美花石斛的扩增电泳图
2.2 最佳反应体系的验证
为了检测利用供试引物筛选获得的最优反应体系的扩增效果,进一步选用CXY 02引物,应用上述获得的反应体系对美花石斛5个不同居群的48株样品的DNA进行了PCR扩增,扩增产物利用6% PAGE胶检测,都可获得清晰可读的条带(图2),说明该体系具有较好的稳定性和通用性,可用于美花石斛遗传多样性的SSR标记分析。
3 讨 论
SSR-PCR反应体系的优化是开展遗传分析的关键。目前,开展SSR-PCR优化的报道已广泛在苦参[6]、甘草[7]、菊花[8]、莪术[9]等药用植物中报道过,但关于美花石斛的SSR-PCR体系优化还未见报道。PCR反应体系是一个综合的多因素体系,不仅要考虑单个组分在PCR体系中发挥的作用,还要综合考虑组分之间的互作影响。有部分研究者对SSR-PCR反应体系的优化采用了单因素的梯度实验法,该方法虽然具有一定的参考作用,但是费时且成本高,最大的缺点是不能反映各因素间的互作影响。因此,此方法设计具有一定的局限性。本研究中采用L16(45)正交设计表对影响PCR反应体系的5大因素的4个水平共计16个处理进行了优化对比,最终获得处理4(2.0 mmol/L Mg2+,0.4 mmol/L dNTP,1.5 UTaq酶,0.4μmol/L引物,40 ng模板DNA)具有较好的检测效果。获得的SSR-PCR最佳反应体系可为今后的遗传多样性和遗传结构分析、基因定位、物种鉴定及遗传图谱构建奠定一定的技术基础。
参考文献:
[1]肖培根,连文琰.中药植物原色图鉴[M].北京:中国农业出版社.1999,10:596.
[2]Schemeske DW,Husband BC,Ruckelhaus MH.Evaluating approaches to the conservation of rare and endangered plants.Ecology,1994,75:584-606.
[3]Saghai-Maroof MA,Soliman KM,Jorgensen RA et al.Ribosomal DNA spacer-length polymorphisms in barly:Mendelian inheritance, chromosomal location and population dynamics[J].Proceedings of the National Academy of Sciences,USA,1984,81:8 014-8 018.
[4]赵树进.中药材生物多样性及核酸分析技术[M].北京:科学出版社,2009:64-70.
[5]王伟,杨文鹏,关琦,等.玉米SSR分子标记技术操作规程的优化[J].安徽农业科学,2008,36(11):4 459-4 464.
[6]段永红,渠云芳,王长彪,等.药用植物苦参SSR-PCR体系的优化与验证[J].中国农业大学学报,2014,19(5):95-100.
[7]刘亚令,宋美玲,候俊玲,等.药用甘草SSR-PCR反应体系的优化与引物筛选[J].时珍国医国药,2017,28(3):740-744.
[8]何仁锋,冯尚国,陈喆,等.药用菊花SSR-PCR反应体系优化及引物筛选[J].分子植物育种,2015,13(2):367-378.
[9]杨妮,苏伟敏,靳雅慧,等.广西莪术SSR-PCR反应体系优化和引物筛选研究[J].湖北农业科学,2016,55(23):6 271-6 275.
