替格瑞洛与西洛他唑对氯吡格雷抵抗的急性缺血性脑卒中患者的疗效及安全性比较
2018-05-21田艳华李国山张然
田艳华 李国山 张然
血小板在动脉粥样硬化部位的的黏附、活化和聚集在急性缺血性脑卒中(acute ischemic stroke,AIS)发病机制中起着至关重要的作用,因此抗血小板聚集治疗在AIS急性期治疗和二级预防中占有重要地位。阿司匹林+氯吡格雷的双联抗血小板聚集治疗方案是目前AIS患者的标准抗血小板治疗方案,但临床上部分患者存在“阿司匹林抵抗”兼或“氯吡格雷抵抗”现象[1],即患者经阿司匹林兼或氯吡格雷治疗后实验室测得的相关血小板功能指标与未经治疗者相近。目前临床上常见的替代治疗方案有2种:(1)将氯吡格雷换用新型P2Y12受体拮抗剂替格瑞洛;(2)将氯吡格雷换用磷酸二酯酶Ⅲ抑制剂西洛他唑。而2种方案哪个抗血小板药的疗效更好?出血并发症更少以及如何选择适应症才能寻求抗血小板聚集药的疗效及出血并发症间的平衡点,目前少有临床研究报道。本研究旨在分析上述2种抗血小板聚集治疗方案对氯吡格雷抵抗的AIS患者抗血小板聚集药的疗效及不良反应的影响,现报道如下。
1 对象与方法
1.1 研究对象 入选标准:(1)符合2014年中华医学会神经病学分会脑血管病学组修定的《中国急性期缺血性脑卒中诊治指南2014》中AIS诊断标准[2],首次发病或既往发病未留下神经功能缺损,本次发病有局灶性神经系统体征(如运动、语言、认知功能的损害及视觉缺损、凝视障碍),严重程度达到美国国立卫生研究院卒中量表(national institute of health stroke scale,NIHSS)评分>10分;(2)经CT或MRI检查确诊,有与定位体征一致的脑梗死病灶,脑干梗死不包括在内,并排除脑出血、脑部肿瘤;(3)入院后接受标准双联抗血小板治疗(阿司匹林100 mg/d+氯吡格雷75 mg/d)至少3 d[3],之后检测ADP诱导的血小板聚集率(platelet aggregation rate,PAR)>50%,定义为氯吡格雷抵抗[4];(4)无出血性疾病及出血倾向。包括无近期手术或外伤史,无严重高血压病(收缩压<180 mHg,舒张压<110 mHg);(5)无严重心、肝、肾功能不全,无精神及智能障碍,意识清楚,无吞咽困难,能按时按疗程服药,能配合检查;(5)无氯吡格雷、阿司匹林、替格瑞洛、西洛他唑过敏史及禁忌症;(6)签知情同意书。本研究遵照人体试验管理规范执行,并经本院医学伦理委员会批准。2组患者的性别、年龄、体重指数(body mass index,BMI)、伴发危险因素、血小板计数(platelet count,PLT)、发病时间、脑梗死体积、NIHSS、病灶部位及入院后不同的用药等基线资料比较均无明显差异(P均>0.05),具有可比性(表1)。

表1 2组患者的基线资料和治疗情况
注:BMI为体重指数;PLT为血小板计数;rt-pA为重组织型纤溶酶原激活剂
1.2 治疗 所有患者入院后给予常规治疗:(1)静脉溶栓。对于发病时间≤4.5 h且符合静脉溶栓适应症的患者及时给予静脉溶栓,应用重组组织型纤溶酶原激活剂注射用阿替普酶,按照0.9 mg/kg体重计算总量,但最大量≤90 mg;先将总量的10% 在1 min内缓慢静脉推注,剩余剂量溶入生理盐水50 mL中微泵推注60 min;(2)酌情给予适当的脱水、扩容、吸氧、脑细胞保护、改善脑循环、降压、降糖、防治感染、保持水和电解质平衡、康复等常规治疗;(3)入院后经双联抗血小板聚集治疗(阿司匹林+氯吡格雷)筛查出氯吡格雷抵抗的患者80例,并按照数字表法随机分为2组:替格瑞洛组(入组40例,完成37例)将氯吡格雷换用替格瑞洛片,90 mg/次,2次/d;西洛他唑组(入组40例,完成39例)将氯吡格雷换用西洛他唑,100 mg/次,2次/d。
1.3 观察指标
1.3.1 神经功能缺损评分 于改变治疗方案前及改变治疗方案后12个月分别检测,采用美国国立卫生研究院卒中量表 (national Institutes of health stroke scale,NIHSS)评分标准进行评分,评分越高表示患者神经功能缺损越显著。NIHSS该量表内容共包括意识、凝视、面瘫、上肢肌力、下肢肌力、共济失调、失语、构音障碍、感觉、视野、忽视症等条目。
1.3.2 PAR检测 于改变治疗方案前及改变治疗方案后1、3、6、12个月分别检测PAR。患者于晨起空腹采集肘静脉血2.7 mL,置于含有0.3 mL3.8%柠檬酸钠抗凝管中,充分混匀。(1)制备富血小板血浆(PRT):将试管离心5 min(转速5 000 r/min,半径12.70 cm),取上层富含血小板血浆(PRP)0.5 mL;(2)制备贫血小板血浆(PPP):吸取PRP后将剩余的血样离心15 min(转速22 500 r/min,半径2.10 cm),得到贫血小板血浆(PPP)。将PRP与PPP混合,血小板浓度稀释至2×105μmol/L,加入6 μmol/L的ADP诱导血小板聚集,之后测定PAR。测定仪器为HELENA公司的packs 4血小板聚集分析仪。ADP试剂为Sigma公司提供,配制好后分装置-20 ℃冰箱保存。
1.4 疗效评定 根据1995年全国第四届脑血管病学术会议通过的《脑卒中患者临床神经功能缺损程度评分标准》[5]评定,治疗后按缺损分值的减少判断疗效。①基本痊愈:神经功能缺损评分减少91%~100%,病残程度为0级;②显著进步:神经功能缺损评分减少46%~90%,病残程度为1~3级;③进步:神经功能缺损评分减少18%~45%;④无效:神经功能缺损评分减少0%~17%或神经功能缺损评分较治疗前增加;⑤死亡。治疗总有效率为基本治愈、显著进步、进步之和。
1.5 预后及不良反应随访 所有患者随访12个月。(1)缺血事件:再发缺血性脑卒中、不稳定型心绞痛、急性心肌梗死、心力衰竭、心源性猝死;(2)出血事件。出血判定标准[6]为轻微出血:临床可见的出血(包括影像学),伴血红蛋白水平下降<30 g/L,不需要干预的其他出血,如瘀斑、牙龈出血及注射部位渗血等;次要出血:临床可见的出血(包括影像学),伴血红蛋白水平下降30~50 g/L,需要药物干预或治疗;主要出血:致命性颅内出血,血红蛋白下降≥50 g/L或输血≥4 U,需要升压药物或手术治疗的低血压,伴心脏压塞的心包内出血,低血容量性休克;其他主要出血:显著的功能丧失如眼内出血伴永久性失明,输血2~3 U或血红蛋白下降30~50 g/L;(3)安全性指标:监测所有患者生命体征、心电图、血尿常规、凝血功能、肝肾功能等指标,记录患者用药过程中出现的不良反应。
1.6 统计学处理 采用SPSS 22.0统计软件,应用正态分布检验,正态分布计量资料以±s表示,2组之间的比较采用独立样本均数t检验,非正态分布计量资料采用秩和检验;2组间在不同时间点重复测量数椐的比较采用重复测量方差分析, 两组间临床疗效比较采用等级资料的秩和检验;计数资料以率(%)表示,组间的比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 2组临床疗效比较 改变治疗方案12个月替格瑞洛组总有效率显著高于西洛他唑组(z=-2.086,P=0.037)(表2)。

表2 2组患者临床疗效比较
注:BMI为体重指数;PLT为血小板计数;rt-pA为重组织型纤溶酶原激活剂
2.2 预后及不良反应随访
2.2.1 缺血事件 改变治疗方案后12个月内随访,替格瑞洛组40例中再发不稳定型心绞痛1例,累计缺血事件1例,共2例(2.5%);西洛他唑组40例中再发AIS 4例,再发急性心肌梗死并心源性猝死1例,不稳定型心绞痛3例,共8例(20.0%)。替格瑞洛组缺血事件发生率低于西洛他唑组(χ2=4.057,P=0.034)。
2.2.2 出血事件 改变治疗方案后12个月内随访,替格瑞洛组40例中发生主要出血1例(其中颅内出血1例),经抢救无效死亡,未发生次要出血,发生轻微出血9例(其中眼结膜出血1例、鼻腔出血2例、牙龈出血2例、皮肤瘀点4例),共10例(25.0%);西洛他唑组40例中未发生主要出血及次要出血,发生轻微出血3例(皮肤瘀点1例,注射部位渗血2例),经对症治疗后出血停止,共3例(7.5%)。替格瑞洛组的出血事件发生率高于西洛他唑组(χ2=4.501,P=0.034)。
2.2.3 呼吸困难 改变治疗方案后12个月内随访,替格瑞洛组发生呼吸困难共6例(15.0%),其中1例胸闷较重,因不能耐受而停药,余下5例轻、中度呼吸困难,持续时间较短,1~3 d后缓解,未影响继续用药;西洛他唑组未发生呼吸困难。替格瑞洛组的呼吸困难发生率高于西洛他唑组(χ2=4.505,P=0.034)。
2.2.4 其他不良反应 改变治疗方案后12个月内随访,替格瑞洛组发生肌酐水平升高4例,血尿酸水平升高3例,缓慢性心律失常3例,肝功能异常1例,共11例(27.5%);西洛他唑组头晕1例,恶心1例,肝功能异常1例,过敏性皮疹1例,共4例(10.0%)。2组的不良反应均较轻微,未影响继续用药。替格瑞洛组的其他不良反应发生率高于西洛他唑组(χ2=4.021,P=0.045)。
2.3 疗程完成情况 替格瑞洛组40例中1例因不能耐受呼吸困难停药,1例死于脑出血,1例中途失访,最终完成疗程37例;西洛他唑组40例中1例再发急性心肌梗死并心源性猝死,最终完成疗程39例。
2.4 血小板的功能 改变治疗方案前2组患者的PAR比较无明显差异(t=0.326,P=0.745),具有可比性。改变治疗方案后1、6、3、12个月2组患者的PAR较治疗前均呈逐渐下降趋势,替格瑞洛组患者的PAR低于西洛他唑组(F=15.320,P=0.000)(表3)。
3 讨 论
替格瑞洛是一种新型环戊基三唑嘧啶类P2Y12受体拮抗剂,本身及其代谢产物均具有生物活性,抗血小板聚集作用强[6],且无需经过肝脏代谢酶生物转化激活就能直接作用于P2Y12受体[7],起效迅速,同时也避免了在代谢活化过程中因代谢酶活性差异而导致药物疗效的个体差异[8],有效性不受肝CYP2C19基因多态性的影响,疗效稳定,作用持久;这点非常重要,因为氯吡格雷易受肝CYP2C19基因多态性的影响,氯吡格雷作为一种前体药物,须在肝内通过肝细胞色素P450酶(CYP)的作用下经两步代谢为活性代谢产物方可发挥抑制血小板聚集作用。因此,肝CYP2C19基因多态性是造成氯吡格雷抵抗的主要原因之一。但替格瑞洛也存在一些缺点,它通过抑制腺苷转运体1(ENT-1)升高血浆中腺苷的水平,增强了腺苷介导的生物学作用[9],还可通过促进三磷酸腺苷(ATP)释放以及通过平衡型ENT-1通道抑制红细胞腺苷再摄取而介导呼吸困难[10]。腺苷水平升高可降低肾小球入球小动脉压力,从而降低肾小球滤过压来改变肾血流动力学导致肌酐升高。同时在替格瑞洛治疗早期嘌呤(腺苷)代谢产物—尿酸升高也可能升高肌酐[11]。替格瑞洛可以抑制红细胞再摄取腺苷,可能与心动过缓和呼吸困难有关。本研究中6例发生呼吸困难,除1例因胸闷停药外,其余5例均为一过性或轻-中度呼吸困难,持续时间较为短暂(1~3d),并未影响心肺功能,停药后并无明显不良事件发生[12]。
西洛他唑是一种选择性磷酸二酯酶3(PDE3)的拮抗剂,其活性多样,可抑制血小板细胞内磷酸二酯酶活性,抑制环磷腺苷酸(cAMP)降解,增加cAMP在血小板内的浓度,不仅能可逆性地抑制二磷酸腺苷(ADP)、胶原、花生四烯酸、凝血酶导致的血小板聚集反应,还能抑制血栓素A2的产生及其导致的血小板聚集[13-14]。另外,西洛他唑还抑制内皮细胞血小板衍生生长因子的产生,还能直接舒张血管平滑肌,具有抗炎作用,增加细胞内一氧化氮的生成,减少新生内膜的增生和重构[15],可以减少血栓形成。
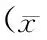
表3 2组患者改变治疗方案前后各时间点血小板聚集率的比较±s,%)
注:与替格瑞洛组比较,*P=0.000
本研究比较换用替格瑞洛与换用西洛他唑对氯吡格雷抵抗AIS患者的疗效、不良反应及血小板功能的影响。改变治疗方案后12个月,与西洛他唑组比较,替格瑞洛组总有效率较高,缺血事件发生率及血小板聚集率较低,但出血事件发生率、呼吸困难发生率及其他不良反应发生率较高。这与国内徐晓宇等[16]关于两种药物对氯吡格雷抵抗的急性冠状动脉综合征患者的研究结果相一致。总之,替格瑞洛的作用较强,不良反应较多;西洛他唑作用较弱,不良反应较少。该结果为氯吡格雷抵抗AIS患者的抗血小板聚集治疗方案提供了优化选择。对于临床上出血风险较低、血栓风险较高(如高脂血症、TIA发作、糖尿病、颈动脉斑块等)的患者,建议选择阿司匹林+替格瑞洛,而出血风险较高且血栓风险较低(如高龄、高血压病、既往出血史等)的患者,建议选择阿司匹林+西洛他唑。
[1] Siasos G,Oikonomou E,Vavuranakis M,et al.Genotyping,platelet activation,and cardiovascular outcome in patients after percutaneous coronary intervention:two pieces of the puzzle of clopidogrel resistance[J].Cardiology,2017,137(2):104-113.
[2] 中华医学会神经病学分会.中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.
[3] 彭文星,徐晓宇,石秀锦,等.PCI术后患者CYP2C19基因多态性与氯吡格雷抵抗关联性研究[J].中国药物应用与监测,2015,12(6):334-338.
[4] Bliden KP,Dichiara J,Tantry US,et al.Increased risk in patients with high platelet aggregation receiving chronic clopidogrel therapy undergoing percutaneous coronary intervention:is the current antiplatelet therapy adequate?[J].J Am Coll Cardiol,2007,49(6):657-666.
[5] 中华神经内科学会.脑卒中患者神经功能缺损程度评分标准(1995)[J].全国第四届脑血管病学术会议中华神经科杂志,1996,29(6):381.
[6] Culic V.Ticagrelor versus Aspirin in Acute Stroke or Transient Ischemic Attack[J].N Engl J Med,2016,375(14):1394-1395.
[7] Goel D.Ticagrelor:the first approved reversible oral antiplatelet agent[J].Int J Appl Basic Med Res,2013,3(1):19-21.
[8] 李慕鹏,熊艳,陈小平.抗血小板药物替格瑞洛药代药效动力学及遗传药理学研究进展[J].中国临床药理学与治疗学,2014,19(2):214-222.
[9] 杨影红,孙鑫,田野.替格瑞洛增强腺苷生物学效应的研究进展[J].临床心血管病杂志,2015,31(2):22-124.
[10] 李丹丹,李虹伟,沈素.替格瑞洛致呼吸困难机制研究进展[J].药物不良反应杂志,2016,18(4):282-285.
[11] 张士庆(综述),朱永宏(审校).替格瑞洛引起肌酐升高机制的研究进展[J].中国循环杂志,2016,31(7):718-719.
[12] 周学敏,郭莉青,王燕庆,等.氯吡格雷与替格瑞洛治疗急性冠状动脉综合征合并慢性阻塞性肺病的疗效及安全性比较[J].中国介入心脏病学杂志,2016,24(4):211-215.
[13] Hassan AE,Zacharatos H,Grigoryan M,et al.Open-Label phase I clinical study to assess the safety and efficacy of cilostazol in patients undergoing internal carotid artery stent placement[J].Interv Neurol,2017,6(1/2):42-48.
[14] Ohnuki Y,Ohnuki Y,Kohara S,et al.Dual therapy with aspirin and cilostazol May improve platelet aggregation in noncardioembolic stroke patients:a pilot study[J].Intern Med,2017,56(11):1307-1313.
[15] Imai T,Matsukawa H,Takagi T,et al.The phosphodiesterase III inhibitor cilostazol protects the brain microvasculature from collagenase injury[J].Neuroreport,2017,28(10):555-560.
[16] 徐晓宇,石秀锦,彭文星,等.不同抗血小板治疗方案对氯吡格雷抵抗急性冠状动脉综合征患者血小板功能的影响[J].中国医药,2017,12(4):496-499.
