马钱子碱抑制乳腺癌细胞体外血管生成拟态的形成及其可能机制研究
2018-05-19索明珠朱耀东徐梦冉李为雨
索明珠,李 平,张 梅,朱耀东,徐梦冉,李为雨
1.安徽医科大学第一附属医院中西医结合肿瘤科,安徽 合肥,230022;
2. 首都医科大学肿瘤医学院2014级五年临床三班,北京 100069
实体恶性肿瘤需要丰富的血液供应来支持生长和转移。长期以来,肿瘤血管生成(angiogenesis)被认为是肿瘤可以获得足够的血液供应的唯一手段。1999年Maniotis等[1]在人类葡萄膜恶性黑色素瘤中发现了新的肿瘤血供模式,血管壁是由变形的恶性黑色素瘤细胞和基质细胞构成的。由于其结构与正常血管相似,它们被称为血管生成拟态(vasculogenic mimicry,ⅤM)。近年来,研究者相继在乳腺癌等多种高度侵袭性的肿瘤中也发现了这一现象,肿瘤细胞在无内皮细胞参与下,通过自身变形及与细胞外基质的相互作用,形成环状并具有肿瘤血供作用的图案样网络[2]。血管生成拟态是对经典的内皮性血管生成之外肿瘤血管生成方式的重要补充,为肿瘤的抗血管治疗提供了新的思路。传统的抗肿瘤血管治疗药物仅针对血管内皮细胞,容易诱发肿瘤内部逃逸,使肿瘤细胞的表型发生转化。肿瘤细胞通过自身变形,在无需内皮细胞参与的情况下,可直接形成血管生成拟态[3]。在这种情况下,单纯抗内皮血管治疗可能意义不大,应考虑联合抗血管生成拟态治疗。因此,寻找抑制血管拟态的关键作用靶点,筛选有效的治疗药物,对提高肿瘤的治疗效果有着重要的意义。
马钱子碱(brucine)为通络药马钱子的主要生物碱单体,广泛用于各种肿瘤、癌性疼痛和风湿顽痹以及骨病的治疗[4]。本课题组前期研究发现,马钱子碱对裸鼠移植性乳腺癌骨转移具有明显的抑制作用,能够降低肿瘤组织中血管内皮生长因子(vascular endothelial growth factor,ⅤEGF)的表达,降低微血管密度(microvessel density,MⅤD)[5]。既往研究表明,马钱子碱具有潜在的抗血管生成作用[6-8],缺乏针对血管生成拟态的相关性研究。恩度(Endostar)为血管生成抑制类药物,其作用机制是通过抑制肿瘤血管的生成,阻断肿瘤细胞的营养供给,从而发挥抑制肿瘤增殖或转移的作用[9]。
本研究通过观察马钱子碱对于乳腺癌细胞系MDA-MB-231的抑制增殖、诱导凋亡的作用,并进行乳腺癌细胞体外三维培养,探讨马钱子碱对人乳腺癌细胞MDA-MB-231体外形成血管生成拟态的影响及其可能的作用机制。
1 材料和方法
1.1 主要试剂及细胞株
马钱子碱(批号:16042903,HPLC≥98%)购自成都普菲德生物技术有限公司,恩度购自山东先声麦得津生物制药有限公司,高糖的DMEM培养基购自美国Hyclone公司,胎牛血清、胰蛋白酶-EDTA消化液购自美国Gibco公司,二甲基亚砜(DMSO)购自美国Sigma公司,MTT粉末购自美国Biosharp公司,Matrigel基质胶(货号:356234)购自美国Corning公司,Dispase®Ⅱ(neutral protease,gradeⅡ)(货号:04942078001)购自瑞士Roche公司,Annexin Ⅴ-FITC/碘化丙啶(propidium iodide,PI)双染细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司,糖原PAS染色试剂盒购自美国Solarbio公司,ⅤEGFA抗体购自美国Proteintech公司,MMP-2抗体(8B4)、MMP-9抗体(2C3)购自美国Santa Cruz Biotechnology公司,人EphA2抗体购自美国RD Systems公司,ⅤE-cadherin抗体(D87F2)购自美国Cell Signaling Technology公司,GAPDH抗体购自美国Millipore Chemicon公司,抗兔、抗鼠、抗羊IgG抗体购自美国Promega公司,增强型化学发光自显影试剂盒(enhanced chemiluminescence,ECL)购自美国Biological Industries公司,人乳腺癌细胞系MDA-MB-231购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。
1.2 方法
1.2.1 细胞培养
MDA-MB-231细胞于DMEM高糖培养基(含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素)中培养,置于37 ℃、CO2体积分数为5%的培养箱中。细胞贴壁生长,每2~3天传代1次。
1.2.2 药物配制和分组
马钱子碱用DMSO溶解后,用培养基配制成浓度为800 μg/mL的母液,然后用DMEM高糖培养基分别稀释至50、100、200和400 μg/mL实验组浓度。阳性对照组恩度浓度为250 μg/mL,空白对照组不含药,用等量培养液替代。
1.2.3 MTT法细胞增殖检测
消化MDA-MB-231细胞,以8×103个/孔接种于96孔培养板上,于37 ℃培养箱中贴壁生长后,弃掉旧培养液,分别加入各处理组的培养液200 μL。每组设复孔5个。培养24 h、48 h后各孔加入5 μg/mL MTT至终浓度0.5 mg/mL。继续培养4 h后吸弃原有培养液。每孔加入150 μL DMSO,于摇床上摇晃至结晶溶解完全。然后在酶联免疫检测仪490 nm处测定各孔的吸光度值(D)。按照下列公式计算细胞增殖抑制率。

1.2.4 AnnexinⅤ-FITC/PI细胞凋亡实验
把不同浓度马钱子碱处理24 h后的各组细胞培养液吸出至离心管,PBS洗涤细胞后加入适量胰酶进行消化。然后加入之前收集的细胞培养液以终止消化。将收集到的细胞悬液1 000×g离心5 min后弃上清液,加入195 μL AnnexinⅤ-FITC结合液轻轻重悬。加入5 μL AnnexinⅤ-FITC,轻轻混匀。加入10 μL PI,轻轻混匀。室温阴暗处温育15 min后,立即用流式细胞仪进行分析。
1.2.5 HO/PI细胞死亡检测
使用Hoechst 33342/PI(propidium iodide)(HO/PI)进行染色分析。不同浓度马钱子碱处理各组细胞24 h,用培养基配制10 mmol/ L HO(C1022,上海碧云天生物技术有限公司)和10 mmol/L PI(ST511,上海碧云天生物技术有限公司)混合液,于37 ℃培养箱进行细胞染色。20 min后,置于荧光显微镜下拍照。
1.2.6 乳腺癌细胞体外三维培养
将预先于4 ℃解冻的Matrigel基质胶加至预冷的24孔板中,每孔200 μL,置于37 ℃培养箱中固化2 h。消化处于对数生长期的MDA-MB-231细胞用于实验,用完全培养基重悬混匀,调整细胞密度为105个/mL,然后缓慢加入500 μL细胞悬液于24孔板的Matrigel基质胶的表面。于37 ℃继续培养,随时在倒置显微镜下观察细胞形态变化及管道形成情况。10 h后,镜下观察到MDA-MB-231细胞之间相互连接,形成管道、网络样结构,即血管生成拟态结构(血管生成拟态管道)形成。
1.2.7 PAS染色
将上述培养10 h后形成的血管生成拟态结构进行PAS染色,用于验证血管生成拟态结构是否由肿瘤细胞直接形成,不含血管内皮细胞。吸弃孔板中的培养液,PBS清洗;PAS固定液固定10 min,蒸馏水清洗;入过碘酸溶液,室温氧化15 min,蒸馏水清洗;置于Schiff液于室温阴暗处浸染10 min;亚硫酸钠溶液滴洗2次,每次2 min;蒸馏水多次冲洗;入苏木精染色液,复染2 min;蒸馏水冲洗,镜检。
1.2.8 马钱子碱对乳腺癌细胞血管生成拟态的影响
于24孔板中加入200 μL/孔预先于4 ℃过夜解冻的Matrigel基质胶,置于37 ℃培养箱中固化2 h。期间,消化处于对数生长期的MDA-MB-231细胞,分别用含有不同浓度马钱子碱(50、100、200和400 μg/mL)的完全培养基重悬混匀,调整细胞密度为105个/mL,然后缓慢加入500 μL细胞悬液于24孔板的Matrigel基质胶的表面,继续置于37 ℃培养10 h,观察各孔血管生成拟态结构的形成状况,比较不同浓度马钱子碱对于血管生成拟态影响的差异。重复3次独立实验。在形成血管生成拟态管道的孔中加入10 mg/mL的Dispase分散酶,振荡5 min,将细胞从基质胶中分离出来,进行后续实验。
1.2.9 蛋白质印迹法(Western blot)检测血管生成拟态各标志蛋白的表达
采用Western blot检测血管生成拟态相关标志分子表达的变化,如血管内皮生长因子A(vascular endothelial growth factor-A,ⅤEGF-A)、血管内皮钙黏蛋白(vascular endothelial cadherin,ⅤE-cadherin)、EphA2和基质金属蛋白酶(matrix metalloprotein,MMP)。
将收集到的细胞加入RIPA细胞裂解液进行裂解,然后加入等体积的电泳上样缓冲液。于沸水中煮10 min制成电泳样品,将样品等量上样后进行电泳分离,冰水浴中恒压湿转至硝酸纤维素膜。5%脱脂牛奶室温封闭1 h。配制适当浓度一抗(ⅤEGF-A为1∶200,ⅤE-cadherin为1∶1 000,EphA2为1∶1 000,MMP-2为1∶200,MMP-9为1∶200,GAPDH为1∶200),温育一抗4 ℃过夜。TBST缓冲液(Tris-HCl,NaCl,吐温20)室温振荡清洗3次,每次10 min。用一抗相对应的二抗室温温育1 h,TBST室温振荡清洗3次,每次10 min。用ECL显影试剂盒进行显色检测。使用Image J进行统计分析。
1.3 统计学处理
采用SPSS 20.0软件进行统计分析。组间比较采用单因素方差分析,各组之间的数据比较采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 马钱子碱对乳腺癌细胞增殖的抑制作用
MTT结果表明,不同浓度的马钱子碱均可抑制乳腺癌细胞MDA-MB-231的生长,对细胞的增殖抑制作用随着药物浓度、作用时间的增加而增强,呈明显的剂量-效应、时间-效应关系(P<0.05,图1)。
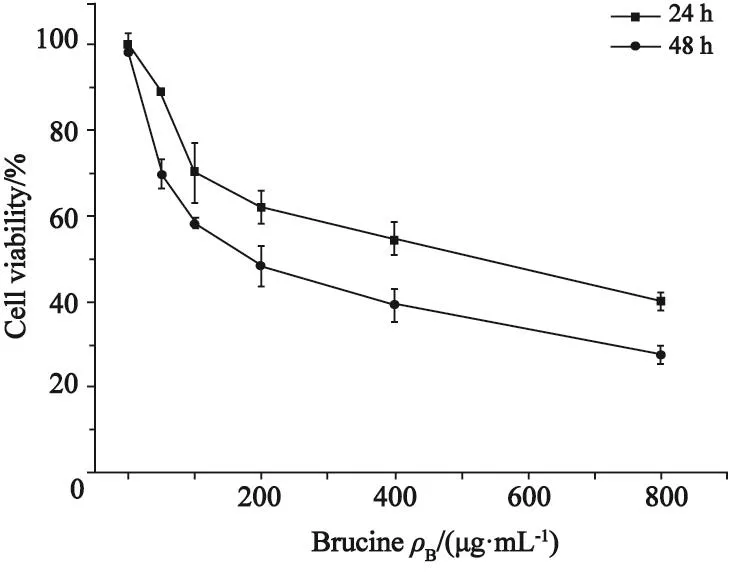
图 1 马钱子碱作用24和48 h后对MDA-MB-231细胞增殖的影响Fig. 1 The effect of Brucine on the proliferation of the MDAMB-231 after 24 and 48 hours
2.2 HO/PI染色细胞死亡检测
由于PI不可以透过活细胞的细胞膜,只能透过破损的细胞膜而对核染色呈现红色荧光,所以可以指示死细胞;HO可以将死细胞和活细胞的细胞核均染上蓝色,所以可以代表细胞总数。HO/PI结果显示,与MTT分析结果一致,细胞死亡数随着马钱子碱浓度增高而增多(图2)。
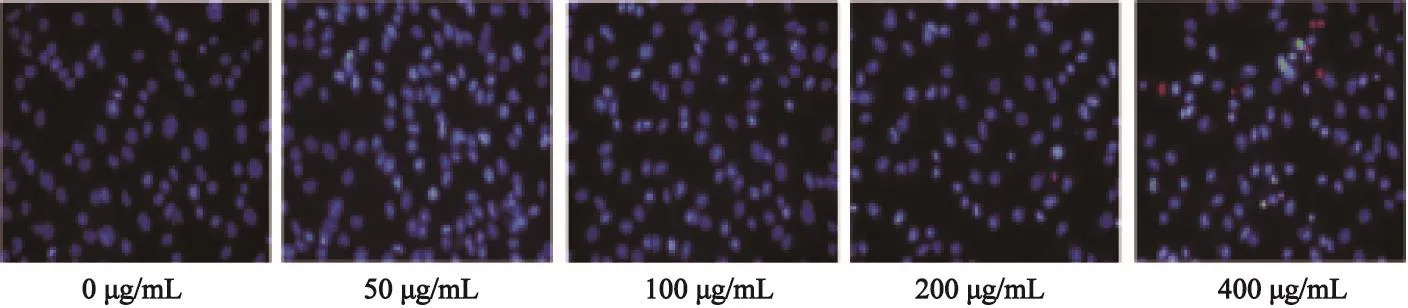
图 2 马钱子碱增加MDA-MB-231细胞的死亡 (×400)Fig. 2 Brucine with different concentrations promoted MDA-MB-231 cell death
2.3 Annexin Ⅴ-FITC/PI双染流式细胞术检测细胞凋亡
将Annexin Ⅴ与PI联合使用时,PI则被排除在活细胞(Annexin V-/PI-)和早期凋亡细胞(Annexin V+/PI-)之外,而晚期凋亡细胞和坏死细胞同时被FITC和PI结合双染呈现双阳性(Annexin V+/PI+)。
Annexin V-FITC/PI结果表明,各浓度马钱子碱组作用24 h后,当马钱子碱剂量为100 μg/mL时,细胞的早期凋亡率与空白对照组相比,早期凋亡细胞所占比例显著增加(P<0.05),各剂量组间差异有统计学意义(P<0.05),24 h早期凋亡细胞随着马钱子碱剂量的增加而逐渐增加(n=3,图3)。
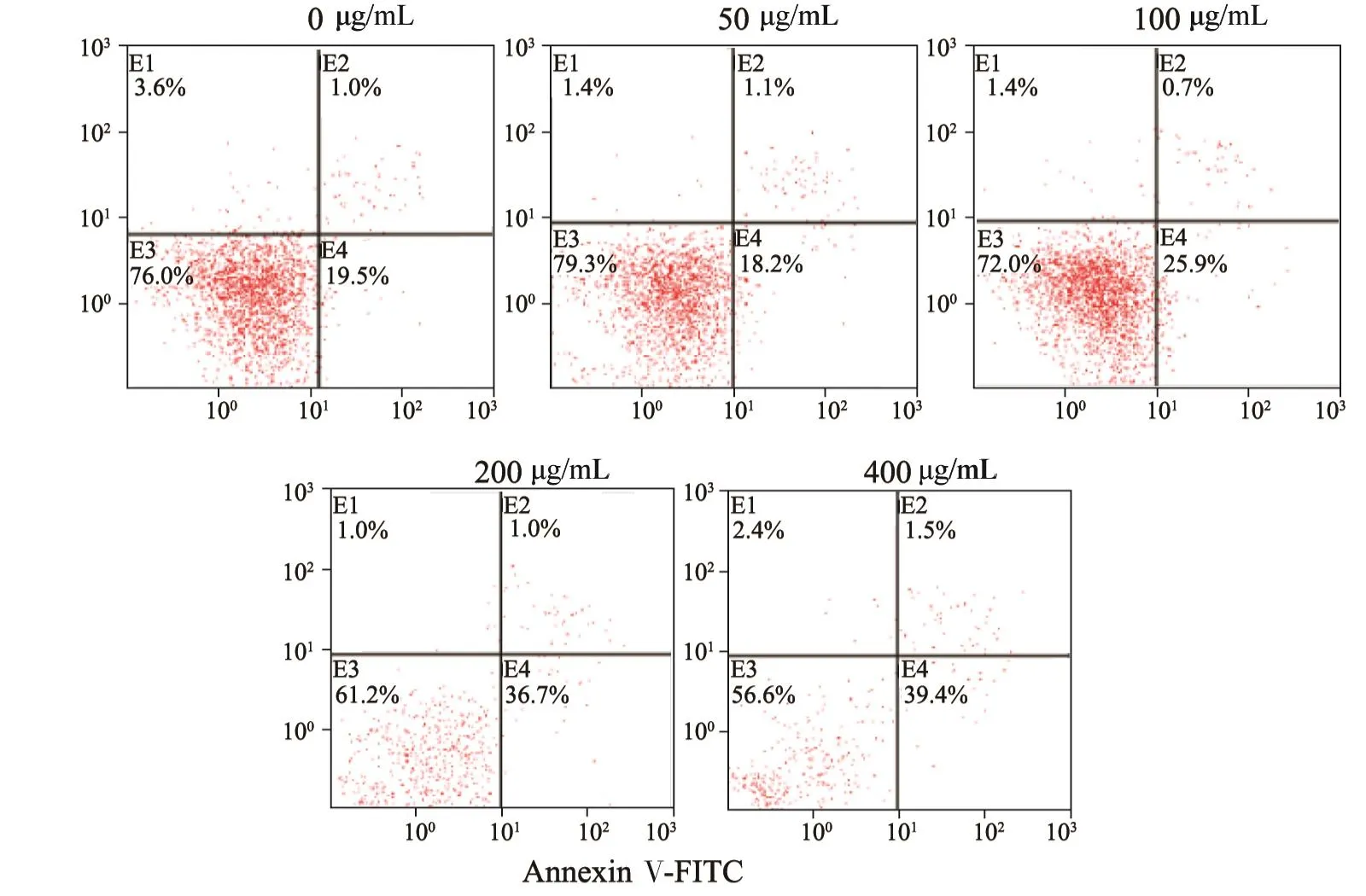
图 3 马钱子碱作用24 h对MDA-MB-231细胞凋亡率变化的影响Fig. 3 The effects of brucine and positive control on MDA-MB-231 apoptosis rate
2.4 PAS染色
MDA-MB-231细胞接种后10 h,细胞贴附在Matrigel基质胶原表面,细胞变形,彼此相互连接,围成空腔样、环状结构(图4)。PAS染色显示,由肿瘤细胞相互连接(不含内皮细胞)的PAS阳性的管网状结构(图5)。拟态血管由肿瘤细胞围成,无内皮细胞衬覆的管道样结构。
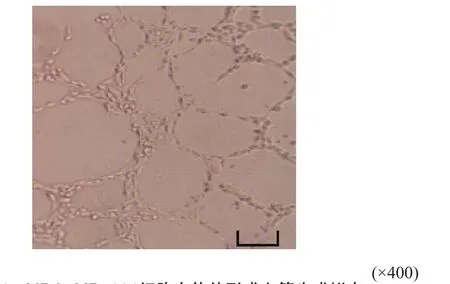
图 4 MDA-MB-231细胞在体外形成血管生成拟态Fig. 4 The vasculogenic mimicry formation of MDA-MB-231 in vitro(scale: 100 μm)
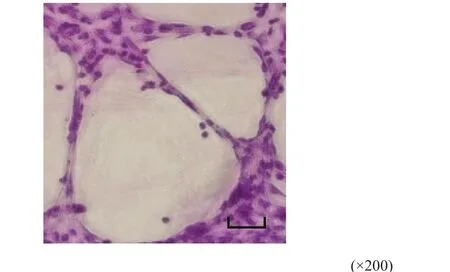
图 5 血管生成拟态的PAS染色Fig. 5 PAS staining of vasculogenic mimicry (scale: 100 μm)
2.5 马钱子碱对血管生成拟态的影响
10 h后,于倒置显微镜下观察并拍照记录。与空白对照和阳性对照相比,随着马钱子碱浓度的增加,管道结构形成的数目减少,节点数、血管分支数减少;且当马钱子碱浓度达到100 μg/mL时,抑制血管生成拟态结构效果开始明显(图6)。说明马钱子碱可以有效抑制乳腺癌细胞血管生成拟态结构,更好地发挥抗肿瘤作用。
2.6 马钱子碱对血管生成拟态相关蛋白的影响
Western blot检测结果显示,与空白对照和阳性对照相比,Brucine处理组内随着药物浓度的增加,ⅤEGF、ⅤE-cadherin、EphA2、MMP-9和MMP-2蛋白水平明显下降(图7)。马钱子碱抑制体外乳腺癌细胞的血管生成拟态结构,可能与下调ⅤEGF、ⅤE-cadherin、EphA2、MMP-9和MMP-2蛋白有关。
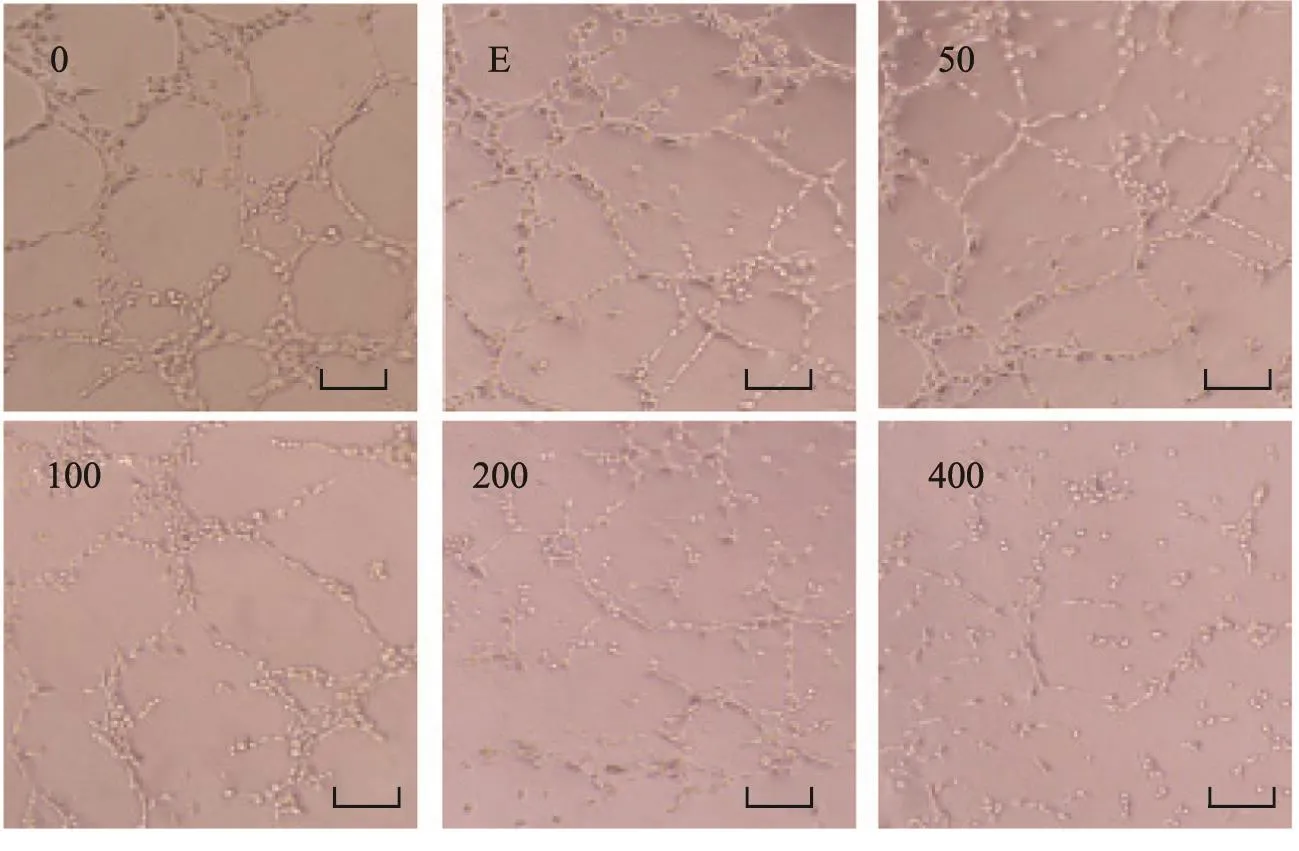
图 6 马钱子碱及恩度(250 μg/mL)对血管生成拟态的影响 (×400)Fig. 6 The effects of Brucine and positive control on vasculogenic mimicry (scale: 100 μm)
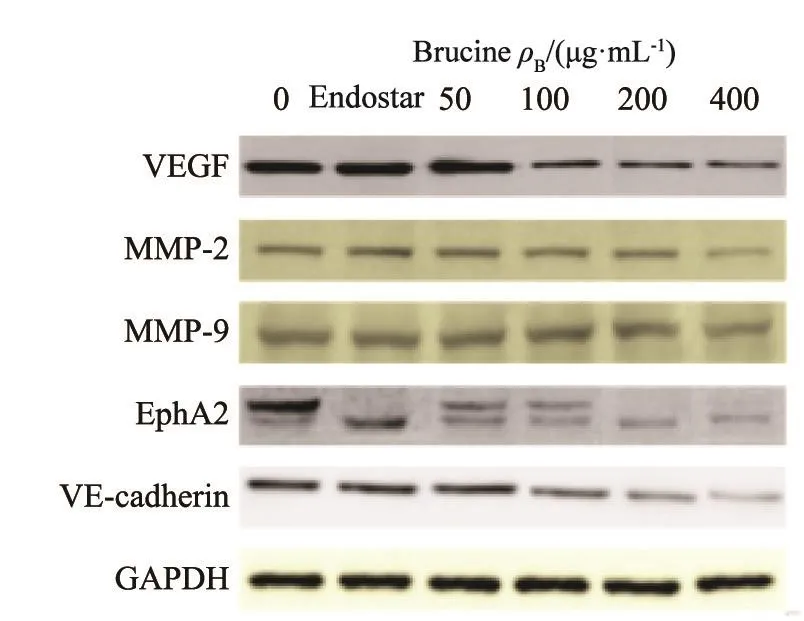
图 7 马钱子碱下调血管生成拟态相关蛋白的表达Fig. 7 Brucine down regulated the expression of vasculogenic mimicry related protein
3 讨 论
乳腺癌是导致女性死亡的常见恶性肿瘤。导致乳腺癌患者死亡的最主要原因是侵袭和转移,而肿瘤血管生成是导致肿瘤浸润的一个重要因素[10]。以往人们一直认为来自机体的血管内皮细胞进入肿瘤组织内,形成的新生血管是肿瘤获得血液供应的唯一途径。因此,临床上应用的抗血管生成药物大多针对血管内皮细胞,通过抑制内皮细胞生长和血管生成,来阻止肿瘤细胞的血液供应,达到遏制肿瘤生长的目的[11]。但在实际治疗过程中这种方法的临床效果并不理想[12]。因此如何提高抗肿瘤血管治疗的临床疗效,是目前研究的热点。
血管生成拟态是近年来被发现的存在于多种高度侵袭性肿瘤内的一种新的肿瘤血液供应方式。血管生成拟态是由具有多潜能性、干细胞表型的高度恶性的肿瘤细胞所形成的管腔样结构,是实体肿瘤中独立于血管内皮细胞依赖性血管的微循环结构,其管壁呈过碘酸希夫(periodic acid schiff,PAS)染色阳性,而CD34、CD31等内皮细胞标志物染色为阴性,表明血管生成拟态的管壁不含有血管内皮细胞,而是由肿瘤细胞直接构成[13]。因此,在三维培养中能否形成拟态管腔样结构,常用于鉴定体外是否具有形成血管生成拟态的能力。
在血管生成拟态过程中,肿瘤细胞能够模仿内皮细胞的生物学行为,表达多种与内皮细胞相关的基因,如VEGF-A、VE-cadherin、EphA2和MMPs等[14-17]。已有研究表明,ⅤEGF/EphA2/MMPs信号通路可能是卵巢癌血管生成拟态的重要调节通路[18];ⅤEGF/ⅤE-cadherin/MMPs信号通路可能是胃癌血管生成拟态的重要调节通路[19]。由此推测,ⅤEGF/EphA2/ⅤE-cadherin/MMPs信号通路可能在乳腺癌血管生成及血管生成拟态过程中,起到关键性的调控作用。
在本研究中,我们发现马钱子碱可以有效地抑制MDA-MB-231细胞的增殖,并诱导细胞的凋亡、坏死;同时在Matrigel基质胶原上构建了一个三维培养的乳腺癌细胞模型,观察到MDAMB-231细胞可以在体外形成血管生成拟态结构,马钱子碱可以抑制乳腺癌细胞的血管生成拟态,其机制可能与ⅤEGF/ⅤE-cadherin/EphA2/MMP-9/MMP-2表达的下调有关。本研究为肿瘤的抗血管治疗提供了新的思路,并将拓展马钱子碱的临床应用。本研究同时也存在不足,在其他乳腺癌细胞系及其相关动物模型中是否同样存在血管生成拟态,马钱子碱对这一结构是否具有类似作用,尚需进一步研究。
[参 考 文 献]
[1] MANIOTIS A J, FOLBERG R, HESS A, et al. Vascular channel formation by human melanoma cellsin vivoandin vitro:vasculogenic mimicry [J] . Am J Pathol, 1999, 155(3): 739-752.
[2] QIAO L, LIANG N, ZHANG J, et al. Advanced research on vasculogenic mimicry in cancer[J]. J Cell Mol Med, 2015,19(2): 315-326.
[3] VARTANIAN A A. Signaling pathways in tumor vasculogenic mimicry[J]. Biochemistry, 2012, 77(9): 1044-1055.
[4] 杨福伟, 王 辰, 王光明. Bricine抗肿瘤的分子水平研究进展[J]. 中国老年医学杂志, 2014, 34(9): 5022-5024.
[5] LI P, ZHANG M, MA W J, et al. Effects of brucine on vascular endothelial growth factor expression and microvessel density in a nude mouse model of bone metastasis due to breast cancer[J]. Chin J Integr Med, 2012, 18(8): 605-609.
[6] AGRAWAL S S, SARASWATI S, MATHUR R, et al. Cytotoxic and antitumor effects of brucine on Ehrlich ascites tumor and human cancer cell line[J]. Life Sci, 2011, 89(6): 147-158.
[7] SARASWATI S, AGRAWAL S S. Brucine, an indole alkaloid from Strychnos nux-vomica attenuates VEGF-induced angiogenesis via inhibiting VEGFR2 signaling pathwayin vivoandin vitro[J]. Cancer Lett, 2013, 10(1): 83-93.
[8] LUO W, WANG X, ZHENG L, et al. Brucine suppresses colon cancer cells growth via mediating KDR signalling pathway[J]. J Cell Mol Med, 2013, 17(10): 1316-1324.
[9] O’REILLY M S, BOEHM T, SHING Y, et al. Endostatin: an endogenous inhibitor of angiogenesis and tumor growth [J].Cell, 1997, 88(2): 277-285.
[10] SHERBET G V. Therapeutic potential of thalidomide and its analogues in the treatment of cancer[J]. Anticancer Res,2015, 35(11): 5767-5772.
[11] VISCIANO C, PREVETE N, LIOTTI F. Tumor-associated mast cells in thyroid cancer[J]. Int J Endocrinol, 2015, 26(8):705169-705175.
[12] HUANG D, LAN H, LIU F. Anti-angiogenesis or proangiogenesis for cancer treatment: focus on drug distribution[J]. Int J Clin Exp Med, 2015, 8(6): 8369-8376.
[13] FAN Y L, ZHENG M, TANG Y L, et al. A new perspective of vasculogenic mimicry: EMT and cancer stem cells [J]. Oncol Lett, 2013, 6(5): 1174-1180.
[14] HESS A R, SEFTOR E A, GRUMAN L M. VE-cadherin regulates EphA2 in aggressive melanoma cells through a novel signaling pathway: implications for vasculogenic mimicry [J].Cancer Biol Ther, 2006, 5(2): 228-233.
[15] DU J, SUN B, ZHAO X, et al. Hypoxia promotes vasculogenic mimicry formation by inducing epithelial mesenchymal transition in ovarian carcinoma [J]. Gynecol Oncol, 2014,133(3): 575-583.
[16] KIRSCHMANN D A, SEFTOR E A, HARDY K M. Molecular pathways: vasculogenic mimicry in tumor cells: diagnostic and therapeutic implications [J]. Clin Cancer Res, 2012, 18(10):2726-2732.
[17] GUO J Q, ZHENG Q H, CHEN H. Ginsenoside Rg3 inhibition of vasculogenic mimicry in pancreatic cancer through downregulation of VE-cadherin/EphA/MMP9/MMP2 expression[J]. Int J Oncol, 2014, 45(3): 1065-1072.
[18] WANG J Y, SUN T, ZHAO X L. Functional significance of VEGF-a in human ovarian carcinoma: role in vasculogenic mimicry [J]. Cancer Biol Ther, 2008, 7(5): 758-766.
[19] LI M, GU Y, ZHANG Z. Vasculogenic mimicry: a new prognostic sign of gastric adenocarcinoma [J]. Pathol Oncol Res, 2010, 16(2): 259-266.
