酸奶中双歧杆菌浓度的快速分子检测
2018-05-18杨禹宸杨志峰苏婧暄
赵 丹,杨禹宸,杨志峰,苏婧暄
(山西农业大学信息学院,山西太谷030800)
现代研究表明,肠道中的有益菌群对人类健康有重要影响,可以增强人体识别和排除异己的反应、加快肠道蠕动等[1-3]。肠道中重要的生理性菌群有乳杆菌、双歧杆菌、链球菌等[4]。在人体胃肠内有着400多类微生物,数量超过1.0×1015个,双歧杆菌是其中之一,它拥有加强免疫和防备患病的生理作用,例如,生物屏障、加强免疫、增强胃肠动力、加快维生素分解等多类生理功效[5-6]。酸奶的营养价值受到大众越来越多的关注,降低血清胆固醇水平、缓解乳糖不耐症、控制腹泻症状、增强免疫系统、控制炎症性肠病以及结肠癌及防止便秘的功能都离不开益生菌的存在[7-8]。因此,建立一种及时有效的检测酸奶中双歧杆菌浓度的方法对消费者具有重要的意义。
传统方法原理简单,但分离种类复杂,检测灵敏度偏低[9-11]。荧光定量PCR可以准确地检测双歧杆菌含量,但成本较高[12-15]。本研究采用聚合酶链式反应来检测双歧杆菌,该检测方式是以双歧杆菌的基因为模板,验证引物的可行性及灵敏度,然后再通过使用凝胶成像分析系统图像分析法检测灰度值,根据已知双歧杆菌的浓度和灰度值进行相关性分析,建立线性方程式[16-17]。
1 材料和方法
1.1 材料与试剂
1.1.1 材料 乳双歧杆菌菌属来源于山西农业大学信息学院微生物实验室;蒙牛冠益乳、天润酸奶、伊利大果粒、伊利优酸乳、君乐宝每日活菌均购自超市。
1.1.2 试剂 PCR引物,DNA Maker,TRIS,Goldeen view,EDTA,琼脂糖,电泳缓冲液,DNA提取试剂盒全部购自上海生工公司;氯仿、异丙醇、乙醇均为分析纯。
1.1.3 主要仪器 培养箱、PCR仪、-20℃冰箱、冷冻离心机、灭菌锅、电子天平、pH计、电泳仪、凝胶成像系统。
1.2 方法
1.2.1 引物设计 根据NCBI网站查找的双歧杆菌16S rDNA的特异基因序列,通过生物信息学网站Primer3 Input(http://primer3.ut.ee/)设计引物,上游引物为:TCTGGCTCAGGATGAACGC;下游引物为:CACCGTTACACCGGGAATTC,目的扩增区间1 500 bp。
1.2.2 酸奶中总DNA提取 在研钵中放入5 mL柠檬酸盐溶液 (含 10.0 mg蛋白酶及 8.0%的SDS)和1 mL发酵乳混合研磨,充分混合后移入EP管中,摇动混匀;在60℃水浴保温30 min;拿出离心管,以13 000 r/min离心10 min,取上面液体放入新的离心管;弃上清液,用DNA提取试剂盒提取DNA,分别在260,280 nm波长处评估DNA纯度。-20℃保存。
1.2.3 扩增方法 利用试验引物,PCR扩增体系共 25 μL。10×PCRbuffer 2.5 μL,上下游引物各1.0 μL,dNTP Mixture 2.0 μL,去离子水补足 25 μL。PCR反应条件:94℃(30 s)→56℃(30 s)→68 ℃(1.5 min)进行35个循环。
2 结果与分析
2.1 基因组DNA的提取
通过DNA提取试剂盒进行双歧杆菌基因组DNA的提取,提取的DNA通过分光光度计检测OD值,并在260,280 nm波长处进行OD260/280比值检测,以鉴定DNA纯度。经测定,提取的DNA OD260/280比值均在1.8左右,说明DNA纯度良好。
2.2 引物特异性检验
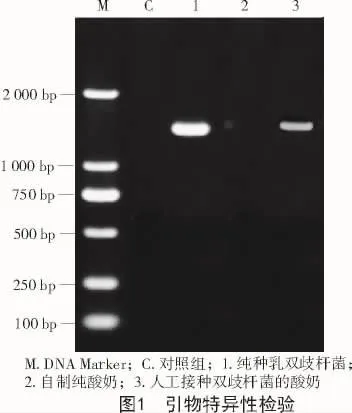
以从自制纯酸奶(未添加双歧杆菌)、纯种双歧杆菌和人工接种乳双歧杆菌的酸奶中提取的DNA为模板,进行PCR扩增及电泳检测,结果如图1所示。试验设置空白对照组,对照组未添加任何DNA模板,结果显示,对照组无条带,表明本体系无外源DNA的干扰,能特异性扩增出双歧杆菌的条带。
2.3 引物灵敏性检验
为检验本PCR体系的检验精度,本试验进行人为污染设置,即将不同浓度的双歧杆菌接种于未污染的酸奶中,最终得到双歧杆菌浓度为2×105cfu/mL(稀释 5 倍),1.0×105CFU/mL(稀释 10 倍),0.75×105cfu/mL(稀释 15 倍),0.5×105cfu/mL(稀释 20 倍),0.2×105cfu/mL(稀释50倍)5种不同浓度的双歧杆菌接种的酸奶,命名为1~5号样品。
分别将试验样品进行DNA提取,以总基因为模板,进行PCR体外扩增及电泳检测(图2)。PCR结果显示,随着样品中双歧杆菌含量的减少,PCR扩增条带亮度依次减弱,检验准确性降低。为了保证分子生物学手段检测的准确性,本次试验检测双歧杆菌含量的最低值为0.75×105cfu/mL。

2.4 标准方程的建立
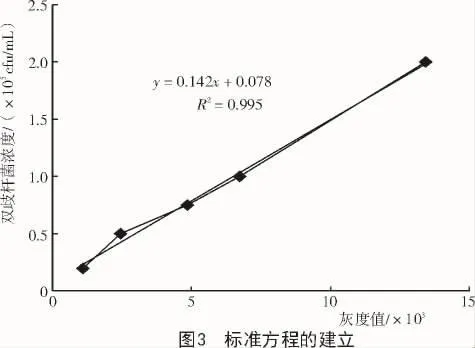
利用凝胶成像系统IMAGE对图2中5种样品的泳带图像进行灰度值测试,以构建双歧杆菌浓度与电泳条带灰度值的对应关系,形成线性方程式。图3以双歧杆菌浓度为纵坐标,以灰度值为横坐标,得到回归方程 y=0.142x+0.078,R2=0.995。根据此线性方程式,对待检测样品进行双歧杆菌DNA的提取并扩增、电泳,根据电泳条带灰度值,可知样品中双歧杆菌的浓度。
2.5 检测体系的应用
速检测酸奶中双歧杆菌浓度,将市售的蒙牛冠益乳、天润酸奶、伊利大果粒、伊利优酸乳、君乐宝每日活菌5种发酵乳应用本体系进行实际检测,结果表明,不同厂家生产的发酵乳中双歧杆菌含量有所不同,有些产品(如伊利大果粒、伊利优酸乳)中双歧杆菌含量并未达到其产生生理功效的含量(表1)。
上述试验建立了新型的分子生物学体系,以快

表1 不同品牌酸奶中双歧杆菌浓度的检测
3 结论
发酵乳中蛋白和脂肪含量较高,对提取其中所含乳酸菌DNA有一定影响,本试验提取前处理中,加入蛋白酶E和SDS能有效水解乳蛋白,去除脂肪,以获取高纯度DNA。最终本试验中使用DNA均为OD260/280比值在1.8左右的高纯度、高质量DNA。
本试验设计通用引物对双歧杆菌16SrRNA基因进行扩增,结果表明,引物设计成功,且通过无模板对照试验表明本体系无外源基因干扰。为了保证分子生物学手段检测的准确性,引物灵敏性试验表明,本试验体系检测双歧杆菌含量的最低值为0.75×105cfu/mL。
最终,本试验建立了基于凝胶成像系统灰度值的检测体系:将待检测发酵乳样品进行双歧杆菌DNA的提取,通过通用型引物进行PCR扩增后进行凝胶电泳,利用凝胶成像系统对样品的泳带图像进行灰度值测试。根据线性方程式y=0.142x+0.078,R2=0.995,可得样品中双歧杆菌的浓度。
将市售的5种发酵乳应用本体系进行检测,结果表明,本试验体系具有操作简便、直接、节省样本等特点,不同厂家生产的发酵乳中双歧杆菌含量有所不同,有些产品中双歧杆菌含量并未达到其产生生理功效的含量,消费者购买时需谨慎。
参考文献:
[1] ISHIBASHI N,SHIM A U S.Bifidobacteria:research and development in Japan[J].Food Technology,1993,47(6):126-135.
[2]金世琳.双歧杆菌的功能:健康科学的探索[J].中国乳品工业,1999,27(3):40-43.
[3]种克.双歧杆菌高效浓缩型酸奶发酵剂制备关键技术研究[D].保定:河北农业大学,2006.
[4]孟祥晨.双歧杆菌生理功能特性及其应用的研究 [D].哈尔滨:东北农业大学,2002.
[5] SHAN T D,DENG Z Y,ZHANGF X,et al.Comparative study of molecular biology on acute high altitude and plain intestinal Bifidobacterium in rats[J].Chinese Journal of Microecology,2011,23(3):197-200.
[6]MUKAMOLVA GV,KAPRELYANTS A S,KELL DB,et al.Adoption of the transiently non-culturable state:a bacterial survival strategy[J].Advances in Microbial Physiology,2003,47:65-129.
[7]徐营,李霞,杨利国.双歧杆菌的生物学特性及对人体的生理功能[J].微生物学通报,2001,28(6):94-96.
[8]张明江,孟祥晨,王丽群.双歧杆菌用于肿瘤基因治疗的研究现状[J].中国微生态学杂志,2006,18(2):145-146.
[9]中华人民共和国卫生部.GB 4789.35—2010 食品微生物学检验:乳酸菌检验[S].北京:中国标准出版社,2010.
[10]LAROIA S,MARTINJ H.Methods for enumerating and propagating Bifidobacteria[J].Cult Dairy Prod,1991,26(2):32-37.
[11]YOUNS Y,SEOJ M,JI G E.Evaluation of the PCRmethod for identification of Bifidobacterium,species[J].Letters in Applied Microbiology,2008,46(1):7-13.
[12]吴燕涛,刘晓莉,王立平.实时荧光定量PCR法测定发酵乳中双歧杆菌[J].食品科学,2013(8):172-175.
[13]黄留玉.PCR最新技术原理、方法及应用[M].北京:化学工业出版社,2011.
[14]吴拥军,王嘉福.应用16SrDNA鉴定食品中的双歧杆菌[J].食品科学,2009,30(18):359-361.
[15]王超,孟祥晨.分子信标-实时PCR法快速检测双歧杆菌的研究[J].微生物学通报,2007,34(6):1163-1168.
[16]杜珍武,王茜,张玉成,等.凝胶成像分析系统检测DNA含量的适用范围研究 [C]//吉林大学中日联谊医院中心实验室.第十二届中国体视学与图像分析学术年会论文集.佳木斯:中国体视学会,2008:225-227.
[17]杜珍武,王茜,张玉成,等.应用凝胶成像分析系统定量测定DNA含量的检测范围 [J].中国体视学与图像分析,2008,13(4):264-267.
