镉对背角无齿蚌鳃组织抗氧化酶活性的影响
2018-05-18井维鑫
井维鑫,刘 娜,王 兰
(山西大学生命科学学院,山西太原030006)
随着经济的快速发展,镉成为水系表层沉积物中含量最高的重金属之一[1]。水生生物通过呼吸、摄食等方式吸收环境中的重金属,并在体内积累[2],通过食物链进入人体引起慢性中毒,进而影响人类的健康[3-6]。
双壳类属于底栖动物,具有极高的滤水速率[7],可反映水体中重金属的污染状况[8],是监测水体重金属污染物的有效指示生物[9]。动物组织的金属含量与生物标志物具有相关性[10],鳃作为呼吸器官与水环境直接接触,是毒物的主要靶器官[11],重金属通过鳃组织到达其他组织器官[12]。研究表明,镉通过Ca2+通道穿过细胞膜进入机体,诱导产生大量自由基和活性氧(ROS),ROS与体内脂质、蛋白质和核酸等生物大分子反应,导致脂质过氧化、细胞膜损伤,并影响多种酶的活力,对生物体造成威胁[13]。抗氧化酶是一类监测环境污染或环境变化的重要生物标志物,且在不同环境、不同物种、不同组织均有明显差异[14]。
本研究采用亚慢性毒性试验方法,研究镉暴露和镉清除后背角无齿蚌(Anodonta woodiana)超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT)活性的变化情况,旨在为筛选合适的生物标志物进行重金属监测提供一定的科学依据。
1 材料和方法
1.1 试验材料
背角无齿蚌(湿质量为(90.51±20.01)g;体长为(9.08±0.64)cm;壳顶高为(3.82±0.36)cm),购于山西省太原市五龙口水产品批发市场。购回后,用曝气48 h的自来水清洗,去除表面附着物以及泥沙等杂质。在实验室条件下(水温为(14.65±0.31)℃;溶解氧为(9.75±0.26)mg/L;电导率为(6.67±0.32)μS/cm;pH 值为 8.34±0.12),对背角无齿蚌驯养42 d,前21 d不喂食以使体内代谢废物排出体外,后21 d投喂小球藻(喂食数量为3.5×104个 /只)。
1.2 试验方法
1.2.1试验设计根据96 hCd2+的LC50(134.9 mg/L)设置高浓度组 1.349 mg/L(1/100 LC50)和低浓度组0.337 mg/L(1/400 LC50)共 2 个镉(Cd2+)处理组,同时设置1个对照组,每个组选取大小相近且健康的60只蚌进行染毒。
试验分为2个阶段:前28 d为镉暴露期,即将背角无齿蚌在不同浓度Cd2+溶液中染毒处理28 d;后28 d为镉清除期,将之前Cd2+染毒处理28 d的背角无齿蚌移入到清水中饲养至56 d。不同试验阶段均是2 d换水一次,每次换水后进行喂食,定时检查蚌的死亡情况,随时挑出死亡个体(死亡标准为贝壳长久张开,不闭合,斧足异常伸展,受刺激后不收缩[15])。
1.2.2 样品制备 每7 d取材一次,各试验组随机取5只蚌,解剖取鳃组织,用滤纸吸净表面水分,称质量后用液氮速冻后保存于-80℃冰箱中备用。同时以预冷的PBS缓冲液在冰上制备20%的鳃组织匀浆液,并于4℃下离心,取其上清液,暂保存于冰上。
1.2.3 测定方法 采用羟胺法测定T-SOD、可见光法测定CAT、羟胺法测定GPx、考马斯亮蓝法测定蛋白含量。酶活测定的试剂盒购于南京建成生物工程研究所,抗氧化酶活力与蛋白含量的检测用多功能酶标仪(SpectraMaxM5,美国MD公司)。
1.3 数据处理
用SPSS 20.0统计软件对试验数据进行单因素方差分析(One-Way ANOVA),并应用Tukey's test将处理组与对照组进行比较(⋆表示差异显著(P<0.05),⋆⋆ 表示差异极显著(P<0.01))。试验结果用“平均值±标准差”表示。
2 结果与分析
2.1 镉暴露与镉清除对背角无齿蚌鳃组织SOD活性的影响
与对照组相比,SOD活性在背角无齿蚌鳃组织镉暴露期的低浓度组(0.337 mg/L),21,28 d 被显著或极显著抑制(P<0.05 或 P<0.01),但是 7,14 d未被抑制;高浓度组(1.349 mg/L)镉暴露期被极显著抑制(P<0.01),且在 28 d抑制效果最明显(P<0.01)。镉清除期,低浓度组(0.337 mg/L)SOD活性在35 d被极显著抑制(P<0.01),之后随着清除时间的延长,SOD活性逐渐恢复至对照组水平;而高浓度组(1.349 mg/L)在镉清除期内,SOD活性被极显著抑制(P<0.01),且在 42 d 达最低值,其低于镉暴露期的各组水平(图1)。

2.2 镉暴露与镉清除对背角无齿蚌鳃组织GPx活性的影响

在背角无齿蚌鳃组织中,GPx活性与对照组相比,在镉暴露期,低浓度组(0.337 mg/L)除 21 d 无显著性差异外,其余各组GPx活性均显著或极显著升高(P<0.05 或 P<0.01);高浓度组(1.349 mg/L)在7 d 被极显著抑制(P<0.01),在 14,21,28 d 极显著或显著升高(P<0.05 或 P<0.01),且在 21 d 达到最大值。在镉清除期,低浓度组(0.337 mg/L)在49,56 d 被极显著诱导(P<0.01),35,42 d 无显著性差异;高浓度组(1.349 mg/L)的鳃组织GPx活性,在 35,56 d 组被极显著诱导(P<0.01),在 42,49 d无显著性变化(图2)。
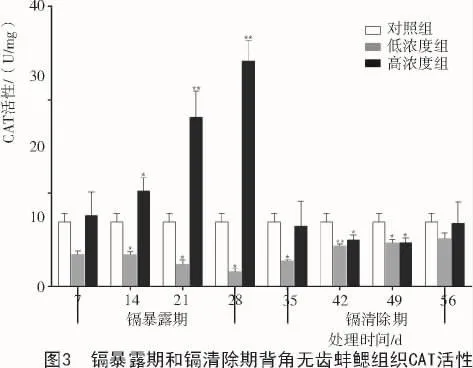
2.3 镉暴露与镉清除对背角无齿蚌鳃组织CAT活性的影响
镉暴露期低浓度组(0.337 mg/L)背角无齿蚌鳃组织除7 d CAT无显著性差异外,其他测定时间均被显著抑制(P<0.05);高浓度组(1.349 mg/L)除 7 d无显著性差异外,14,21,28 d时CAT活性显著或极显著升高(P<0.05 或 P<0.01)。镉清除期,低浓度组(0.337 mg/L)除 56 d 无显著性差异外,各测定时间均被显著或极显著抑制(P<0.05 或 P<0.01);高浓度组(1.349 mg/L)在 35,56 d 与对照组相比无显著性差异,42,49 d CAT活性均被显著或极显著抑制(P<0.05 或 P<0.01)。在镉清除期 56 d,低浓度组、高浓度组CAT活性均恢复至对照组水平(图3)。
3 讨论
鳃是软体动物的呼吸器官,是污染物作用的早期靶点[16]。在生物体内,只有SOD是一种以自由基为底物的抗氧化酶,具有清除机体内活性氧自由基的作用,从而使细胞免受损害[13,17-18]。研究表明,背角无齿蚌经 4.22~67.45 mg/L Cd2+处理 24 h 后,发现鳃组织SOD被极显著诱导[19];经5,50 mg/L Cd2+组胁迫14 d后鳃组织SOD活力显著升高[20];5 μg/L Cd2+胁迫30 d后,鳃组织由于氧化应激,SOD活性显著升高,40 μg/L Cd2+胁迫30 d后,SOD活性显著下降[12]。本试验结果发现,SOD活性在试验测定时间内表现为被抑制,可能是因为动物体长时间暴露在较高浓度Cd2+(0.337,1.349 mg/L)状态下,体内被诱导产生了较多的超氧阴离子(O2-·),而过多的O2-·影响了SOD基因的表达,进而促使酶蛋白的合成受阻、酶活性下降[21]。
GPx是生物体普遍存在的一种抗氧化物酶。Cd2+与GPx的活性部位硒代(半)胱氨酸(Se-Cys)结合,一方面降低了Cd2+对机体的毒性影响,另一方面导致其活性部位发生改变、GPx失活[22]。此外,Cd2+与GPx前体结合使GPx的合成受到抑制,从而导致H2O2,OH-的积累,使机体受到损伤[23]。文献调研发现,背角无齿蚌以5 μg/L Cd2+胁迫30 d后,鳃组织GPx活性显著升高,40 μg/L Cd2+胁迫30 d后,GPx活性与对照组相比无明显差异[12];以 4.22~67.45 mg/L Cd2+处理24 h发现,鳃组织GPx活性仅在16.82 mg/L Cd2+处理组表现为显著升高,其余浓度组与对照组无明显差异[19]。本试验在镉暴露7 d后,高浓度组(1.349 mg/L)活性相对于对照组显著上升,当处理时间延长,GPx活性略有下降,但相对于对照组仍表现为显著升高。原因是由于Cd2+进入机体后,导致ROS的大量生成[24],抑制了SOD的活性,使得机体内H2O2的含量不断增高,从而刺激机体产生大量的GPx来清除过量的H2O2[25]。
CAT是一种含血红素的酶,存在于线粒体和抗氧化物酶体中,CAT能迅速分解H2O2,生成H2O和O2[26]。背角无齿蚌用较低浓度(5~40 μg/L)[12]或较高浓度(4.22~67.45 mg/L)[19]Cd2+胁迫后,可极显著诱导鳃CAT的活性升高。本试验结果表明,Cd2+在0.337 mg/L 可显著抑制 CAT活性,1.349 mg/L 可显著诱导CAT活性升高。当大量的Cd2+进入机体并诱导其产生活性氧自由基时,SOD活性被抑制,进而促使机体内H2O2含量升高[24]。H2O2的升高也诱导了机体内CAT的基因表达及活性,提高H2O2的分解速率[27]。
在试验镉清除期56 d,鳃组织SOD活性在低浓度组(0.337 mg/L)恢复至对照组水平,而高浓度组(1.349 mg/L)仍极显著低于对照组水平(P<0.01);鳃组织GPx活性低、高浓度组仍极显著高于对照组水平(P<0.01);鳃组织 CAT活性低、高浓度组均恢复至对照组水平。本研究结果表明,在镉低浓度污染被清除后,背角无齿蚌具有一定的适应或恢复能力,而当受外界环境高浓度镉胁迫后,即使这种污染被清除后,机体适应和恢复的能力也极其有限。镉对背角无齿蚌的健康影响,在很大程度上取决于暴露剂量的高低和暴露时间的长短[28]。
综上所述,不同浓度镉暴露后,背角无齿蚌鳃组织SOD活性被抑制,GPx活性被诱导,CAT活性在低浓度组中表现为抑制,在高浓度组中表现为诱导。表明背角无齿蚌机体对镉污染具有一定的恢复能力。因此,背角无齿蚌抗氧化酶活性的变化能够反映生物体受污染物胁迫的程度,可作为生物标志物用于指示水体镉污染状况。
参考文献:
[1]朱青青,王中良.中国主要水系沉积物中重金属分布特征及来源分析[J].地球与环境,2012,40(3):305-313.
[2] BONNAIL E,SARMIENTO A M,DELVALLS T A,et al.Assessment of metal contamination,bioavailability,toxicity and bioaccumulation in extreme metallic environments(Iberian Pyrite Belt)using Corbicula fluminea[J].Science of the Total Environment,2016,544:1031-1044.
[3] CHEREMISINOFF N P.Agency for toxic substances and disease registry(ATSDR)[M].Atlanta:John Wiley&Sons,2016:83-93.
[4]任玉娟,刘蒙南,王兰,等.镉对背角无齿蚌组织中金属硫蛋白含量的影响[J].山西农业科学,2017,45(2):211-214.
[5]宇克莉,孟庆敏,邹金华.镉对玉米幼苗生长、叶绿素含量及细胞超微结构的影响[J].华北农学报,2010,25(3):118-123.
[6]庞荣丽,王瑞萍,谢汉忠,等.农业土壤中镉污染现状及污染途径分析[J].天津农业科学,2016,22(12):87-91.
[7]RAINBOWP S,PHILLIPS DJ H.Cosmopolitan biomonitors of trace metals[J].Marine Pollution Bulletin,1993,26:593-601.
[8]江天久,曾淼,牛涛.重金属Cd2+胁迫对近江牡蛎超氧化物歧化酶活性的影响[J].热带海洋学报,2006,25(6):63-67.
[9]BESADAA V,SERICANOJ L,SCHULTZE F.An assessment of two decades of trace metals monitoring in wild mussels from the Northwest Atlantic and Cantabrian coastal areas of Spain,1991-2011[J].Environment International,2014,71:1-12.
[10] CHANDURVELANR,MARSDENI D,GLOVERC N,et al.Assessment of amussel as a metal bioindicator of coastal contamination:Relationships between metal bioaccumulation and multiple biomarker responses [J].Science of the Total Environment,2015,511:663-675.
[11]REIDS D,MCDONALDDG.Metal binding activity of the gills of rainbow trout (Oncorhynchus mykiss)[J].Canadian Journal of Fisheries and Aquatic Sciences,1991,48:1061-1068.
[12]许芳芳.背角无齿蚌对低浓度镉的富集特征及生理响应[D].合肥:安徽大学,2017.
[13]AHMADI,PACHECOM,SANTOS MA.Enzymatic and nonenzymatic antioxidants as an adaptation to phagocyte-induced damage in Anguilla anguilla L.following in situ harbor water exposure[J].Ecotoxicology Environmental Safety,2004,57(3):290-302.
[14]王晓蓉,罗义,施华宏,等.分子生物标志物在污染环境早期诊断和生态风险评价中的应用 [J].环境化学,2006,25(3):320-325.
[15]王晓宇.四角蛤蜊(Mactra veneriformis)对镉和汞污染胁迫的生理响应[D].青岛:中国科学院海洋研究所,2009.
[16]潘青青,任加云,吴众望.重金属离子对中华绒螯蟹肝胰腺和鳃丝SOD,CAT活性的影响 [J].中国海洋大学学报,2004,34(2):189-194.
[17]何俊瑜,任艳芳,任明见,等.镉对小麦种子萌发、幼苗生长及抗氧化酶活性的影响[J].华北农学报,2009,24(5):135-139.
[18]段云青,王艳,雷焕贵.镉胁迫对小白菜POD、PPO和SOD活性的影响[J].河南农业科学,2006(7):88-91.
[19]邢慧芳,李涌泉,杨慧珍,等.镉对背角无齿蚌外套膜和鳃抗氧化酶活性及脂质过氧化的影响 [J].环境科学学报,2013,33(3):856-860.
[20]刘蒙南,刘娜,李涌泉,等.镉对背角无齿蚌消化腺和鳃组织SOD活力的影响[J].山西农业科学,2016,44(6):750-753.
[21] MALECKA A,DERBA-MACELUCH M,KACZOROWSKA K,et al.Reactive oxygen spexcies production and antioxidative defense systemin pea root tissues treated with lead ions:mitochondrial and peroxisomal level[J].Acta Physiologiae Plantarum,2009,31:1065-1075.
[22]ISZARDMB,LIUJ,KLAASSENCD.Effect of several metallothionein inducers on oxidative stress defense mechanisms in rats[J].Toxicology,1995,104(1/3):25-33.
[23] HULTBERG B,ANDERSSON A,ISAKSSON A.Alterations of thiol metabolism in human cell lines induced by low amounts of copper,mercury of cadmium ions[J].Toxicology,1998,126(3):203-212.
[24]PRUSKI A M,DIXONDR.Effects of cadmiumon nuclear integrity and DNA repair efficiency in the gill cells of Mytilus edulis L.[J].Aquatic Toxicology,2002,57(3):127-137.
[25]赵艳民,王新华,秦延文,等.水体对中华绒螯蟹(Eriocheir sinensis)血淋巴抗氧化酶活力和丙二醛含量的影响[J].海洋与湖沼,2011,42(3):436-442.
[26] PATERSON M,KENNEDY J F.Free radicals in biology and medicine[M].Oxford:Clarendon Pr,1985,188(1):331-332.
[27]CHENT,FURSTA,CHIENP K.The effects of cadmium and iron on catalase activities in Tubifek[J].The American College of Toxicology,1994,13:112.
[28] KIMA Y D,KIM W J,SHIN Y K,et al.Microcystin-LR bioconcentration induces antioxidant responses in the digestive gland of two marine bivalves Crassostrea gigas and Mytilus edulis[J].Aquatic Toxicology,2017,188:119-129.
