系列水性环境体系中玉米离体花粉的活力解析
2018-05-18牛鹏飞马海林田承华程庆军胡振鑫张秦莹于美珍屈雅娟岳忠孝田怀东
牛鹏飞 ,李 珍 ,马海林 ,田承华 ,程庆军 ,胡振鑫 ,赵 宁 ,张秦莹 ,于美珍 ,李 南 ,闫 枫 ,屈雅娟 ,岳忠孝 ,田怀东 ,4
(1.山西大学生命科学学院,山西太原030006;2.山西大丰种业有限公司,山西太原030031;3.山西省农业科学院高粱研究所,山西晋中030600;4.山西景康农业技术推广有限公司,山西寿阳045400)
玉米是主要的粮食作物,在养殖业、酿造业、食品科学、医药等方面有着诸多的重要作用,在经济发展中占有十分重要的地位[1]。近年来,随着作物研究由基因组学转向蛋白组学,玉米科学研究开始跨入基因功能组学与分子育种时代,为此,我们有必要通过高效的基因诱变技术开发大量的基因诱变材料[2-4]。
化学诱变主要基于烷化剂等化学诱变剂处理植株的组织器官或细胞诱发突变,因其操作简单安全、诱变效率较高成为开发作物基因突变材料的有效途径[5]。自NEUFFER[6]1963年首次将EMS用于玉米诱变后,经过不断的改进完善,通过悬浮于轻质石蜡油的EMS处理玉米离体花粉进行诱变的技术获得了成功,并应用于玉米突变体的开发[7]。玉米突变体的利用促进了一些关于玉米植株与籽粒外观形状的基因的功能解析,然而,绝大部分玉米的生物学功能仍然是未知的,造成这种情况的主要原因是基于低效率基因诱变技术突变材料的严重不足。为满足当前及以后一段时期内玉米基因功能解析和分子育种研究对基因突变材料的大量需求,迫切需要研究高效的基因化学诱变技术[8-10]。
玉米花粉EMS石蜡油诱变技术成功解决了玉米离体花粉化学诱变的难题,然而石蜡油这样的有机溶媒环境,明显不利于诱变剂EMS对花粉生殖细胞的渗透与DNA的作用。我们认为这是制约玉米花粉EMS石蜡油诱变效率的主要问题。为了开发水性环境中玉米花粉生殖细胞的化学诱变处理新技术,本研究确立了保持玉米自交系离体成熟花粉活力的最优保护液体系。
1 材料和方法
1.1 试验材料
将优异玉米自交系A378种植于山西省农业科学院高粱研究所试验研究基地,采集适量成熟玉米花粉并完成以下试验。
1.2 试验方法
1.2.1 用于离体玉米花粉处理的系列水性环境设计及其活力的显著性分析 处于水性环境下的离体玉米花粉,受渗透压作用,极易吸水胀破,降低活力。相关报告指出,蔗糖(Suc)[11]、甘油(Glycerol)[12]、乙二醇(EG)[13]、二甲基亚砜(DMSO)[14]4种成分对冷存状态下的生体细胞具有各自的保护效果;玻璃化保护液处理下可显著提高离体高粱花粉的活力[15]。据此,设计磷酸盐溶液(PBS)与含有上述物质的3种玻璃化保护液配方(PSS),构建系列的水性环境体系。将定量提取的成熟花粉浸没在4种水性环境体系中,以存活率评价浸没后的花粉活力,确定玉米离体成熟花粉的最优PSS体系。
1.2.2 最优PSS保护下处理后玉米花粉的萌发与受精的显微观察 使用软质毛笔刷将适宜置换培养后的离体成熟花粉轻轻蘸抹在花丝上[16]。采用苯胺蓝染色,荧光显微镜下观察玉米离体花粉的体外萌发状态[17-18]。取受粉后0~24 h内若干发育时期的花丝,经适宜的FAA固定、酒精置换、NaOH软化、苯胺蓝染色、制片,使用荧光显微镜,观察花粉在花丝的萌发过程。取授粉24 h后若干发育时期的胚囊,经FAA固定、酒精置换、苯胺蓝染色后,再度进行酒精置换,进行双受精及受精后细胞组织发育过程的光学显微观察。
1.3 测定项目及方法
使用光学显微镜观察被浸没花粉的存活状态,采用TTC法检测花粉活力[19]。
1.4 数据处理
使用SPSS 19.0软件分析花粉活力变化的显著性。
2 结果与分析
2.1 4种水性环境中离体玉米花粉存活率的解析
从表1可以看出,离体玉米花粉经不同水性环境处理后,TTC染色结果显示,离体玉米花粉经PBS处理后,花粉出现大量胀破现象,存活率较低,仅为35.67%。经3种水性环境PSS处理后,花粉活力呈上升趋势。各水性环境体系保持受处理玉米花粉活力的能力大小顺序为PSS1>PSS2>PSS3>PBS。结果表明,保护液处理后有助于提高离体玉米花粉存活率。
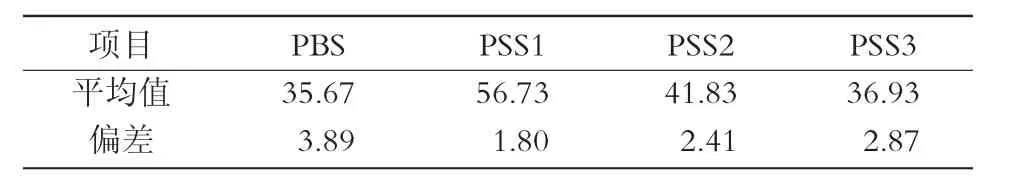
表1 不同水性环境处理后花粉活力的变化 %
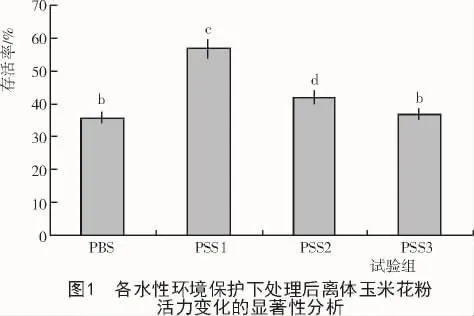
对表1进行花粉活力变化的显著性分析得出,磷酸盐缓冲液(PBS)与3种保护液体系(PSS1,PSS2,PSS3)的系列水性环境下离体玉米花粉的存活率呈现出负相关趋势;经过PSS处理后,3种保护液处理下的玉米离体花粉的存活率与PBS相比均有所上升。其中,PSS1,PSS2对离体花粉存活率影响均显著,且PSS1>PSS2,PSS3与PBS相比对离体花粉存活率的影响不显著(图1)。综合分析表明,与PBS相比,PSS3对受处理花粉存活率的提高不显著,而PSS1可显著提高受处理花粉的存活率。
2.2 最优PSS1处理后离体玉米花粉的萌发、受精及结籽能力的分析
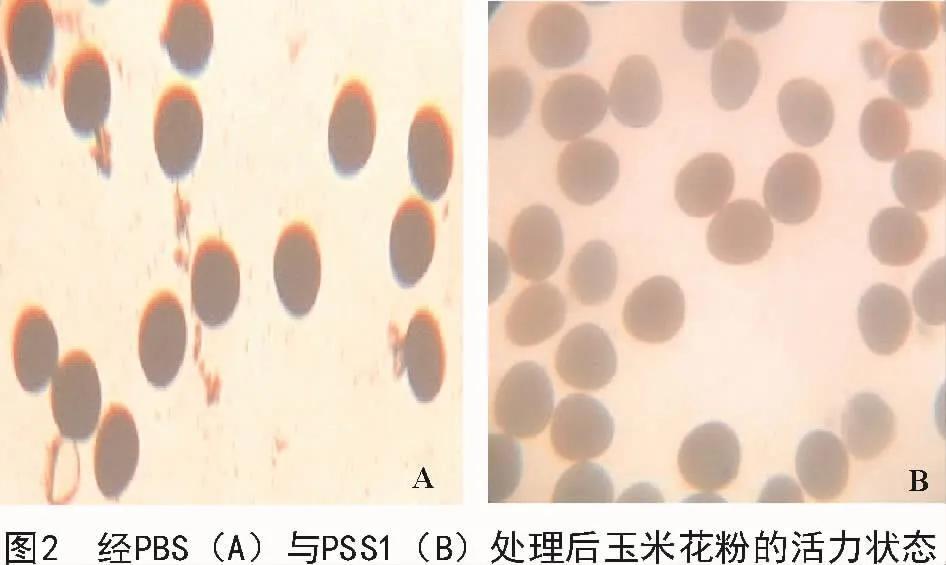
图2-A显示,离体玉米花粉经PBS处理后,花粉颗粒吸水胀破,内容物外流,导致其失活不能被染色而呈黑色,该条件下玉米花粉存活率极低。图2-B显示,经最优PSS1处理后,玉米花粉颗粒形态得到明显改观,能保持较完整的形态,且大部分染色为淡红色,大大提高了离体玉米水性环境下的存活率,从形态上表明,经PSS1保护液处理后离体玉米花粉具有正常的形态及较高的活力。
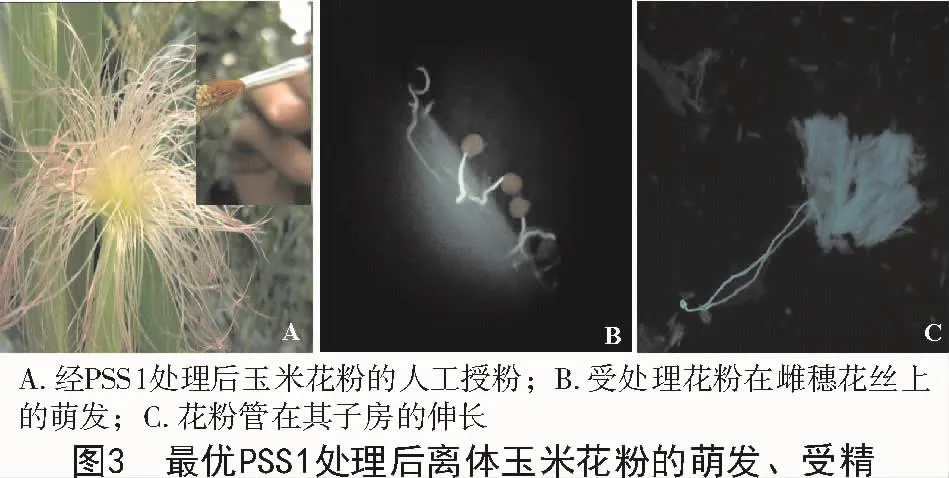
将经最优水性PSS1保护的离体玉米花粉,人工涂抹于成熟玉米花丝上,在适宜的条件下仍具备较高的萌发能力(图3-A)。图3-B显示,光学显微镜下可观察到大量离体玉米花粉的萌发,经水溶性苯胺蓝染色后,荧光显微镜下可看到清晰明亮的绿白色荧光,即为萌发的花粉管。在荧光显微镜下观察人工授粉后采集的各时期的样品(图3-C),可清晰地观察到绿白色荧光,并观察到花粉粒附着在花丝上,萌发出花粉管,花粉管沿花丝向下部伸长,花粉管从珠孔延伸进入子房内部(图3-C),预示着经最优PSS处理后的玉米离体花粉体外授粉、受精过程的顺利完成。大田试验结棒率统计结果显示,自然授粉结棒率为100%;经PBS处理的玉米离体花粉结棒率13%;经最优PSS1处理离体玉米花粉的结棒率68%。研究结果表明,最优PSS1保护的玉米离体花粉在适宜条件下具备优良的萌发受精能力且有较高的结实率。
3 结论与讨论
玉米离体花粉处于水性环境时极易吸水胀破死亡。相关报道指出,玻璃化保护液PVS1对离体高粱花粉活力具有较明显的保护作用[15]。本研究结果显示,虽然受处理花粉的活力在上述水性环境中均显著降低,但PSS中的二甲基亚砜、甘油、乙二醇、蔗糖对受处理的玉米花粉有各自的保护效果。DMSO可以减轻自由基对细胞的破坏,改变生物膜对电解质通透性,减缓水分子对细胞的作用,达到较强的渗透保护作用;Glycerol与水分子具有较强的亲和性,并在细胞外壁形成保护膜来减少水分子对细胞的侵害,降低外界对其的损伤;EG具有较高的渗透作用,通过置换出自由水达到改变胞内盐溶质浓度的作用;蔗糖的大分子量保证其不易渗透进入细胞,可以起到维持细胞内外渗透压平衡、防止细胞过度膨胀的作用。
综上所述,最优PSS1保护液可显著提高离体玉米花粉的活力,对离体玉米花粉活力的保护效果最好。基于此,我们期望在此研究结果的基础上,为水性溶液环境下玉米离体生殖细胞的诱变提供借鉴,开发出高效、安全的基因化学诱变新技术。本研究解决了水性环境体系下玉米离体花粉最优保护液配方的难题,为玉米离体花粉生殖细胞化学诱变处理技术的开发奠定了基础,对基因功能组学与分子育种研究具有重要意义。
参考文献:
[1]石明亮,薛林,胡加如,等.玉米和特用玉米的营养保健作用及加工利用途径[J].中国食物与营养,2011,17(2):66-71.
[2]TIMOFEJEVA L,SKIBBE DS,LEE S,et al.Cytological characterization and allelism testing of anther developmental mutants identified in a screen of maize male sterile lines[J].G3 Genesgenetics,2013,3(2):231.
[3]MOONJ,SKIBBE D,TIMOFEJEVA L,et al.Regulation of cell divisions and differentiation by MALE STERILITY32 is required for anther development in maize[J].Plant Journal for Cell&Molecular Biology,2013,76(4):592-602.
[4] XING A,GAO Y,YE L,et al.A rare SNP mutation in Brachytic2 moderately reduces plant height and increases yield potential in maize[J].J Exp Bot,2015,66(13):3791.
[5]赵永亮,宋同明,马惠平.利用花粉化学诱变快速创造特用玉米新种质[J].作物学报,1999,25(2):157-161.
[6]NEUFFERMG.Chemical mutagens in mineral oil very effective on corn pollen maize [J].Maize Genetics Corporative Newsletter,1968,42:124.
[7] NEUFFER M G.Paraffin oil technique for treating mature corn pollen with chemical mutagens[J].Maydica,1978,23(1):21-28.
[8]WANGG,WANGF,WANGG,et al.Opaque1 encodes a myosin XI motor protein that is required for endoplasmic reticulummotility and protein body formation in maize endosperm[J].Plant Cell,2012,24(8):3447.
[9] SATOH H,OMURA T.Induction of mutation by the treatment of fertilized egg cell with N-mthyl-N-nitrosourea in rice[J].Laboratory of Plant Breeding,Faculty of Agriculture,Kyushu University,1979,24:165-174.
[10]TIANH D,SATOH H,TAKEMOTOY.Inheritance of novel 57H mutations in rice and their effect on compartmentation of endospermstorageproteins[J].IntJ PlantSci,2004,165(4):537-544.
[11] GAYLE M,JACKIE L,KATE E.Survival of mint shoot tips after exposure to cryoprotectant solution components[J].Cryobiology,2006,52(2):305-308.
[12]冯慧云,余立祥,刘星海,等.甘油对离子注入动物细胞的保护效应[J].中国科学院研究生学报,2002,19(4):372-375.
[13] SOMMERFELD V,NIEMANN H.Cryopreservation of bovinein vitro produced embryos using EG in controlled freezing or vitrification[J].Cryobiology,1999,38(2):95-105.
[14]方志聪,戚智.二甲基亚砜对生物膜的作用机理[J].生物物理学报,2012,28(8):638-643.
[15]李珍,田承华,赵宁,等.玻璃化保护液处理下高粱离体花粉的活力解析[J].山西农业科学,2016,44(4):463-466.
[16]刘怀华,王莉雯,刘楠,等.玉米花粉与花丝早期互作的蛋白质组学分析[J].中国农业科学,2010,43(24):5000-5008.
[17] POLITOV S.Zymolyase removes callose from germinating pollen and pollen tube walls[J].Cell Biol Int,1985,9(11):1013-1016.
[18]ABDELGADIRHA,JOHNSONS D,STADENJ V.Pollen viability,pollen germination and pollen tube growth in the biofuel seed crop Jatropha curcas (Euphorbiaceae)[J].S Afr J Bot,2012,79(1):132-139.
[19]崔桂梅,孙毅.玉米花粉体外萌发方法改进及其对花粉介导转基因的作用[J].植物学报,2012,47(2):155-161.
