肺癌细胞株表面PD-L1分子表达对Treg细胞分化增殖的影响
2018-05-18李秋泽赵成光
李秋泽,赵成光
肺癌在所有恶性肿瘤发病率中占20%[1],由于其能通过种种原因逃逸免疫机制监视[2],所以也是历年来难以缓解、复发率最高的癌症。常规治疗肺癌的方法如化疗、手术虽有一定成效[3,4],但是多发患者随治疗时间增长的获得耐药性与肿瘤细胞转移病灶无法根除等情况,总有效果并不如人意,肺癌患者三年以内复发率高达80%[5],五年以内复发率为10%。调查患者生存曲线发现,肺癌患者三年生存率为 36%,五年生存率低至15%[6],中位生存期稳定在30个月[7]。为了解决这一状况,免疫治疗方法[8]逐渐进入肺癌治疗领域。T细胞为杀灭肿瘤细胞[9]主要参与者,肿瘤细胞表面 PD-L 分子[10]表达程度会影响T细胞的分化生成。所以笔者观察PD-L1在肺癌细胞株表面表达情况,以及其对T细胞的影响程度,从而为肺癌的免疫治疗方法提供有效可靠的依据。
1 材料与方法
1.1 主要试剂与材料流式细胞仪(美国BECKMAN COULTER公司),用于流式细胞术对细胞进行自动分选;T细胞分选试剂盒(美国BECKMAN COULTER公司)用于分选人体外周静脉血T淋巴细胞;24孔与96孔培养板(美国COSTAR公司)依次用于PHA与肺癌细胞株与Treg细胞共同培养;倒置显微镜(中国OLYMPUS公司)观测活化细胞、拍照,用于检测最适PHA浓度;健康人的外周静脉血SPCA-1、H1299、A549三种肺癌细胞株 (美国 ATCC公司),荧光染色法检测细胞无污染后,用于肺癌细胞株与外周血淋巴细胞共培养实验。
1.2 流式细胞术检测PD-L1在肺癌细胞上的表达
选取三种肺癌细胞株生长速率最高的时期,37℃培养箱内培养。收集外壁生长的细胞株,用PBS(磷酸盐缓冲液)离心洗涤2次后再用缓冲液将细胞重悬,通过流式细胞仪检测PD-L1的表达水平。
1.3 实验方法
1.3.1 活化因子PHA最适浓度 通过常规分离Ficooll法[11]分离人体外周静脉血单核细胞后再通过免疫磁珠法[12]分选出来的 T 淋巴细胞与 0、5、10、15、20(μg/ml)共 5个浓度梯度的 PHA 置于 24孔培养板共同培养,72 h后倒置显微镜观察,通过细胞生长状态与细胞团数量进行评定,得出最适浓度。
1.3.2 肺癌细胞株与外周血Treg细胞的共同培养
以TGF-β (转化生长因子-β)与PD-L1抑制素、TGF-β抑制素的存在与否设置实验,实验组别设置为 1、2、3。实验 1 组:肺癌细胞株 X、Treg细胞、活化因子PHA;实验2组:肺癌细胞株X、Treg细胞、活化因子PHA、TGF-β;实验3组:肺癌细胞株X、活化因子PHA、PD-L1抑制素与TGF-β抑制素。最后通过流式细胞法检测各实验组分化的Treg细胞所占的总体比例。
1.4 统计学方法确定最终统计的数据后,运用Graph Prism 5.0统计专用软件进行数据分析,计数资料采用x±s表示,比较运用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 肺癌细胞株表面PD-L1分子表达水平运用流式细胞术对对SPCA-1、H1299、A549三种肺癌细胞株表面的PD-L1分子表达水平进行检测并绘制图像,详见图1。
观察结果发现,各肺癌细胞株PD-L1分子表达程度有所差异。SPCA-1表达率最高为 (98.5±1.1)%;H1299 次之为 (91.0±3.2)%;A549 最低,为(20.1±6.4)%,三组分别相比都具有统计学差异(P<0.05)。由于SPCA-1肺癌细胞株中PD-L1分子表达水平最高,将此细胞株与Treg细胞进行共同培养。
2.2 肺癌细胞株表面PD-L1分子表达水平对诱导Treg细胞分化生成的影响
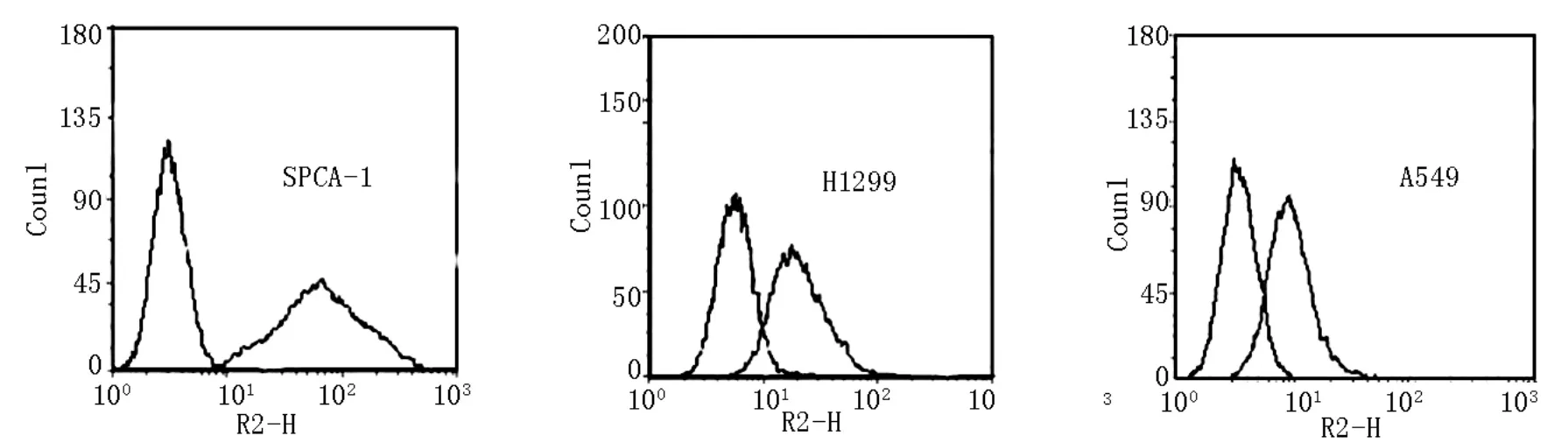
图1 流式细胞术结果图示(三种细胞株)
2.2.1 不同浓度活化因子PHA对外周血Treg细胞的活化程度 通过倒置显微镜观察得知,活化因子浓度为0 μg/ml时Treg细胞生长状态为单个离散型;随着浓度的升高,Treg细胞逐渐出现明显增值,细胞团数量增加等情况。活化因子PHA浓超过10 μg/ml时,细胞大量增殖同时出现大面积覆盖的细胞凋零聚集而成的黑色细胞团。经实验可知,活化因子PHA的最适浓度为10 g/ml。
2.2.2 共同培养Treg细胞活化实验结果 1、2组对比发现:Treg细胞分化2组 (19.70%)多于1组(12.50%),证明TGP-β能够提高Treg细胞分化生成比例,且差异有显著统计学意义(P<0.05)。
2、3组对比发现:2组 (19.70%)Treg细胞分化生成比例多于3组(6.20%),即PD-L1蛋白分子具有诱导Treg细胞分化生成的能力,与TGF-β同时存在发挥作用时表现为协同作用,应用抑制剂能够显著影响Treg细胞分化,且差异有统计学意义(P<0.05)。 详见图 2。

图2 实验1、2、3的Treg细胞活化实验结果
3 讨论
近年来,肺癌发病率在恶性肿瘤中占有比重越来越大,而且常发生在40岁以上有常年吸烟史的人群中。临床表现为咯血、胸闷胀痛等症状,患者常常因此疲于运动、难以休息,严重影响生活质量,危及生命健康。化疗、放疗、手术为常用的肺癌治疗方法,但由于治疗缓解效率低、复发率高、不良反应大等情况,治疗需要其他的可行治疗方案配合或代替常规肺癌治疗手段。肿瘤难以根除一大部分由于其能够进行免疫逃逸[13-15],肿瘤细胞通过病原体持续性的中和抗原并突变,保持连续性感染,中和免疫机制的清除作用;病原体躲避在人体正常肺部细胞内保持休眠,逃逸多重免疫机制的巡回监视;病原体通过其本身的组成分子或分子结构影响、阻止免疫机制的生成或者两者保持拮抗状态。由此能够增强患者自身免疫能力以及低不良反应的新治疗手段即免疫治疗方法,进入了肺癌治疗领域。
该研究原理为:T细胞在APC(抗原呈递细胞)表面的共刺激分子作用下大量增殖,其中一部分分化为CTL(细胞毒性T淋巴细胞),CTL与先前可识别的肿瘤细胞结合并将之杀伤裂解。T细胞增殖受T表面PD-1分子与APC细胞表面PD-L1控制,两个共抑制分子结合抑制T细胞活化,控制免疫细胞增殖。而近些年研究发现,PD-L1活跃表达于多种类实体肿瘤中:肺癌、卵巢癌、胰腺癌等。所以肿瘤细胞表面PD-L1分子的高度表达与PD-1分子的大量结合会使特异性免疫细胞凋亡,影响T细胞增殖分化,导致病情进一步恶化。T细胞为杀灭肿瘤细胞的重要参与者,肿瘤细胞表面PD-L分子表达水平会影响T细胞的分化生成。所以通过本研究实验观察PD-L1在肺癌细胞株表面表达情况,以及其对T细胞的影响程度,从而为肺癌的免疫治疗方法提供有效可靠的依据。
综上所述,PD-L1是诱导Treg细胞分化生成的重要影响因素之一,免疫治疗可能是肺癌治疗的有效可行方法。
参考文献
[1]王维琼.2016年中国恶性肿瘤发病和死亡分析[J].临床医药文献电子杂志,2017(19):3604.
[2]陈海,毛建平.肿瘤免疫逃逸与T淋巴细胞关系的研究进展[J].中国生物工程杂志,2012(10):86-92.
[3]白丽艳,祁玉娟.晚期非小细胞肺癌化疗新进展[J].中国现代医药杂志,2016(7):99-102.
[4]EMMANOUILIDES C,TRYFON S,BAKA S,et al.Operation for preservation of lung parenchyma in central lung cancer-in vivo and ex situ reimplantation techniques[J].Anticancer Research,2015,35(3):75-81.
[5]陈亮.局限性切除与肺叶切除治疗Ⅰ期非小细胞肺癌术后总生存期和复发率meta分析[D].广州:南方医科大学,2012.
[6]匡栩源,徐丽伟,林国强,等.1635例肺癌术后患者电话随访结果及预后分析[J]. 中南大学学报(医学版),2012,(09):895-900.
[7]高新.200例非小细胞肺癌术后生存率相关影响因素的分析[D].石家庄:河北医科大学,2016.
[8]钟安媛.PD-1/PD-L1信号通路在肺癌中对Treg细胞的调节作用[D]. 苏州:苏州大学,2016.
[9]徐华,王丹波.诱导调节性T细胞与肿瘤免疫研究进展[J].免疫学杂志,2015(4):353-357.
[10]陈成,穆传勇,瞿秋霞,等.PD-L1分子在肺癌细胞株上的表达及其生物学意义[J]. 中国肺癌杂志,2009(8):859-863.
[11]YING L,AHMED S,HARARI F,et al.Impact of Ficoll density gradient centrifugation on major and trace element concentrations in erythrocytes and blood plasma[J].Journal of Trace Elements in Medicine&Biology,2015,29(S6/7):249-254.
[12]JI JL,JIANG YZ,TANG QQ,et al.Detection of circulating tumor cells using a novel immunomagnetic bead method in lung cancer patients[J].Journal of Clinical Laboratory Analysis,2016,30(5):656.
[13]LAURENT C,CHARMPI K,GRAVELLE P,et al.Several immune escape patterns in non-Hodgkin's lymphomas[J].Oncoimmunology,2015,4(8):11-13.
[14]AUDET J,KOBINGER GP.Immune evasion in ebolavirus infections[J].Viral Immunology,2015,28(1):78.
[15]陶千山.IL-35诱导急性髓细胞白血病细胞免疫逃逸的作用及机制[D].合肥:安徽医科大学,2014.
