IL-35在非小细胞肺癌中的表达及与临床病理的关系
2018-05-18陈艳玲
陈艳玲
(1、南昌大学医学院,南昌 330006;2、江西省胸科医院呼吸二科,南昌 330006)
在全球范围内,肺癌的发病率和病死率均位居恶性肿瘤之首,其中,非小细胞肺癌(non-small cell lung cancer、NSCLC)的发生率约占80%以上。据统计世界各地每年因肺癌死亡的人数在150万左右[1,2]。尽管NSCLC的治疗效果较前有大幅度的提高,但其5年生存率仍未见明显提高,约在15%左右[3]。当前,肺癌的确诊主要根据组织细胞学检查,但是该检查方法的创伤较大,并且容易发生并发症。血清中肿瘤标志物的测定具有取材便捷、检测方便、易重复等诸多特点,并且在肿瘤的筛查、诊断、分型及预后等方面有重要的参考价值[4]。IL-35(interleukin-35,IL-35)是IL-12家族的最新成员,由EB13及P35亚基组成的异源性二聚体[5]。当前,研究者证实IL-35在多种肿瘤细胞中高表达,包括胃癌、甲状腺癌、胰腺癌、结直肠癌、B细胞淋巴瘤、鼻咽癌及黑色素瘤[6]。但IL-35与NSCLC相关性研究相对较少,评价IL-35在肿瘤患者体内的检测水平及其作用具有重要的临床意义。本研究运用RT-PCR检测NSCLC患者肺癌组织中IL-35的表达水平,应用酶联免疫吸附实验 (Enzyme-Linked ImmunoSorbent Assay,ELISA) 分析肺癌患者血清中IL-35的表达与NSCLC患者临床病理因素之间的联系。
1 资料与方法
1.1 临床资料 回顾分析我院2016年7月至2017年9月期间收治的78例经手术、支气管镜活检或者穿刺肺活检后病理诊断为NSCLC患者的治疗情况,其中男 42 例,女 36 例,年龄(45.6±13.7)岁,我们在取样本前详细记录并核对相关资料,如患者姓名、性别、年龄、住院号、联系方式、发病时间、病理诊断、肿瘤部位、肿瘤大小、肿瘤TNM分期、肿瘤是否有淋巴转移、手术时间与方式、原发或复发等。根据患者病理分为肺鳞癌40例及肺腺癌38例,选取手术治疗患者20例,其中肺鳞癌及肺腺癌患者各10例,取得这些患者的癌组织及癌旁组织,并收集手术7d后患者血清,同时期来我院体检健康人群20例作为对照组,本研究均在患者及健康体检者知情同意后进行,并取得了我院伦理委员会的同意。纳入标准:所纳入的患者手术前均未经抗肿瘤治疗;所有患者均经病理或细胞学诊断为非小细胞肺癌患者。排除标准:原发肿瘤的肺部转移;伴有其他并发症如肺部炎症、糖尿病等;伴有免疫性疾病患者;伴有血液系统疾病患者;未签署知情同意者或我院伦理委员会未同意者;随访资料不完善的患者。
1.2 标本采集及分组
1.2.1 RT-PCR检测标本 收集20例经手术切除肿块的NSCLC组织及其癌旁组织来自本院胸外科,癌组织标本离体后,选取肿块组织非坏死部分,癌旁组织取距肿瘤至少2.5cm的肺组织,标本均取自术后1h以内,取下后迅速液氮保存备用。
1.2.2 血清标本的收集与保存 NSCLC患者于入院后24h内和健康体检者空腹采用非抗凝真空管采取外周静脉血5ml,室温放置60min后,离心机以6000rpm/min,离心10min,然后取经离心后的患者血清放入2ml无菌的EP管中,-20℃低温保存备用。1.2.3实验分组 RT-PCR分组:NSCLC癌组织20例 (肺鳞癌、肺腺癌各10例)与癌旁组织20例;ELISA分组:肺癌组:肺鳞癌组40例、肺腺癌组38例,健康体检对照组20例;手术前肺癌组、手术后肺癌组(该20组患者均为手术治疗的肺癌患者)
1.3方法
1.3.1 检测方法 ⑴所有患者于术前清晨空腹抽取外周静脉血5ml,于6000rpm/min的离心分离机离心分离10min,置于冰箱保存待检;⑵采用ELISA法检测患者血清IL-35水平(严格按照试剂说明书进行相关操作),记录分析。
1.3.2 采用Trizol提取法提取20例NSCLC组织和相应癌旁肺组织中总RNA后,进行逆转录,再应用PCR进行扩增,所有实验操作步骤都是严格按照逆转录试剂盒及PCR mix试剂盒使用说明书进行操作
qRT-PCR分析基因表达

EBI3引物P35引物β-actin引物上游下游上游下游上游下游5’-GCTCCCTACGTGCCTCAATGT-3’5’-CCCTGACGCTTGTAACGGAT-3’5’-TCCTCCCTTGAAGAACCGGA-3’5’-TGACAACGGTTTGGAGGGAG-3’5’-CCTGGCATGGAGTCCTGTG-3’5’-AGGGGCCGGACTCGTCATAC-3’
PCR总反应体系为20.0μl,内含2xPremix Ex Taq RNA 10.0μl, 上下游引物各 0.4μl,cDNA 2.0μl,其余加双蒸水补足扩增。条件为94℃预变性2min,94℃ 20s,60℃ 34s, 温度转换率均为 20℃30s扩增40个循环,70℃延伸时采集荧光信号,所有样品均做复孔,IL-35的相对表达量用2-ΔΔCT法表示。
1.4 统计学分析 使用SPSS 18.0软件进行统计学的分析,计数资料的比较采用χ2检验,计量资料采用t检验,等级资料的比较采用秩和检验,(P<0.05)则表示两组差异具有统计学意义。
2 结果
2.1 在mRNA水平检测NSCLC组织中IL-35的表达 在mRNA水平检测20例NSCLC癌组织中IL-35表达水平,IL-35在NSCLC组织中的表达情况,肺鳞癌中 IL-35 表达量为(34.22±0.996)ng/ml,肺腺癌中 IL-35 表达量(32.00±0.906)ng/ml,比正常癌旁组织中的(12.70±0.230)ng/ml显著增高,并且两者之间的差异有统计学意义 (P<0.0001)。在NSCLC中,肺鳞癌组织中IL-35的表达量高于肺腺癌,差异有统计学意义(P<0.05)。

图1 IL-35 mRNA在NSCLC癌组织中的表达量
2.2 NSCLC患者血清中IL-35水平比较 通过EILSA对78例NSCLC患者及20健康体检者血清中IL-35的检测发现,肺鳞癌、肺腺癌、健康体检者血清中 IL-35 水平分别是 (36.68±3.19)ng/ml、(34.32±3.86)ng/ml和(16.72±4.59)ng/ml,通过对比分析发现在NSCLC患者血清中IL-35的水平明显高于健康体检者,二者之间的差异有统计学意义(P<0.05)。在肺腺癌与肺鳞癌患者血清中IL-35水平相比,我们发现鳞癌患者血清中IL-35水平比腺癌患者血清中高,但其差异无统计学意义(P=0.514)(见图2);通过对20例手术前后肺癌患者血清中IL-35的检测发现手术前患者血清中IL-35的表达量明显高于术后,差异有统计学意义(P<0.0001)(见图 3)

图2 NSCLC患者血清中IL-35的表达量
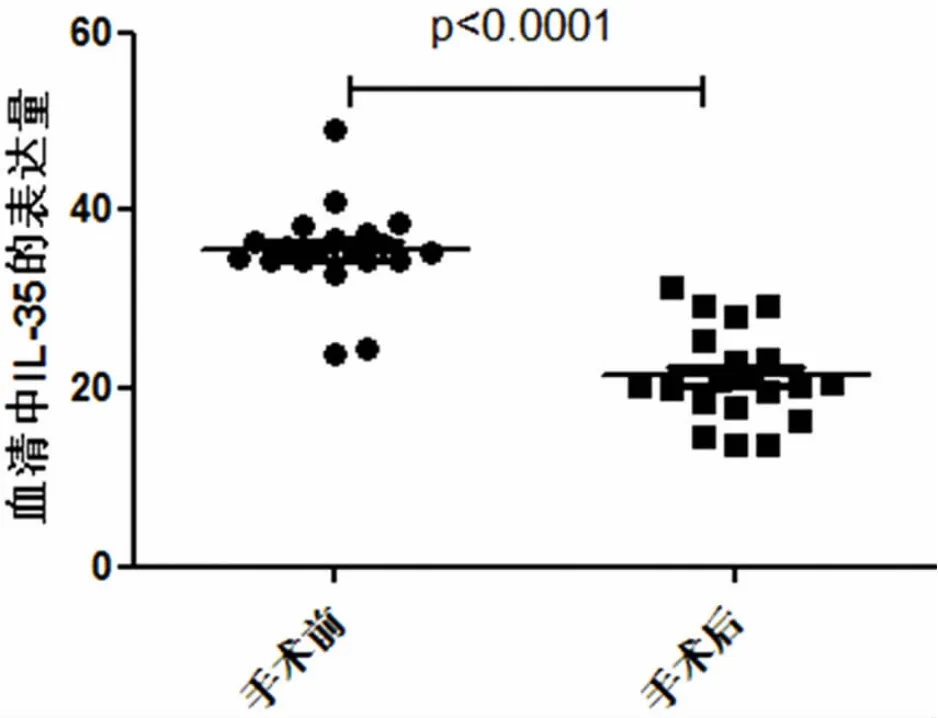
图3 手术前后肺癌患者血清中IL-35的表达量
2.3 NSCLC患者血清中IL-35水平与其病理特性的关系 通过酶联免疫吸附法检测78例NSCLC患者血清中IL-35水平变化,分析结果见表3。我们发现NSCLS患者血清中IL-35的水平的与患者的年龄、性别及原发肿瘤的大小之间没有统计学意义(P>0.05);而与肿瘤的分化程度、TNM 分期之间的有显著性差异(P<0.05)。在随后的分析发现,在肿瘤的分化程度中,IL-35与随着肿瘤的分化程度成正比;在肿瘤的TNM分期中,肿瘤分期越高,IL-35表达量越高。伴有淋巴结转移的NSCLC患者血清中IL-35水平较无淋巴结转移者高。由此,我们可认为血清中IL-35的表达量与NSCLC的分化程度、TNM分期及淋巴结转移呈正相关,而与患者的年龄、性别及原发肿瘤的大小则没有相关性。
3 讨论
据IARC统计,预计到2025年时,我国每年新增肺癌患者将达100万例[7]。当前,由于医疗技术的不断的完善,包括最新的靶向药物治疗,但NSCLC患者5年生存率仍然不容乐观,早发现、早治疗仍是提高患者生存率的主要手段之一,此外,对于肺癌患者及时有效的治疗及预后的判断显得至关重要,但目前仍无行之有效的生物学指标。
2007年,国外学者首次发现一种由CD4+CD25+调节性T细胞分泌的额新型抑炎性细胞因子,并将其命名为白介素35(interleukin-35,IL-35)[8]。IL-35通过表达于细胞上受体IL-35R发挥作用。在结直肠癌中,高表达IL-35可诱导Treg细胞进入肿瘤微环境从而促进肿瘤生长,同时还检测了肺癌、结直肠癌及肝癌等多种肿瘤细胞系中IL-35的表达,均发现IL-35的两个亚基P35及EB13共表达,当给予外源性的IFN-γ及TNF-α刺激后,肿瘤细胞表达IL-35的量增加[9]。在体外的细胞实验中发现,上调IL-35的表达后,cyclinB、cyclin D及cdk4的表达随之增加,同时下调p27的表达,促进了胰腺癌细胞的增殖,进而促进胰腺癌病程的进展[10]。通过构建稳定过表达IL-35的肿瘤细胞系,发现过表达IL-35导致肿瘤停滞在细胞G1期,抑制细胞的增殖,促进细胞凋亡,可以引起Fas基因的表达上调及Cyclin D1、Survivin及Bcl-2基因表达水平的下调[11]。但是,也有不同的研究结果,在乳腺癌的的研究中,IL-35被认为具有抑制肿瘤的特性[12]。
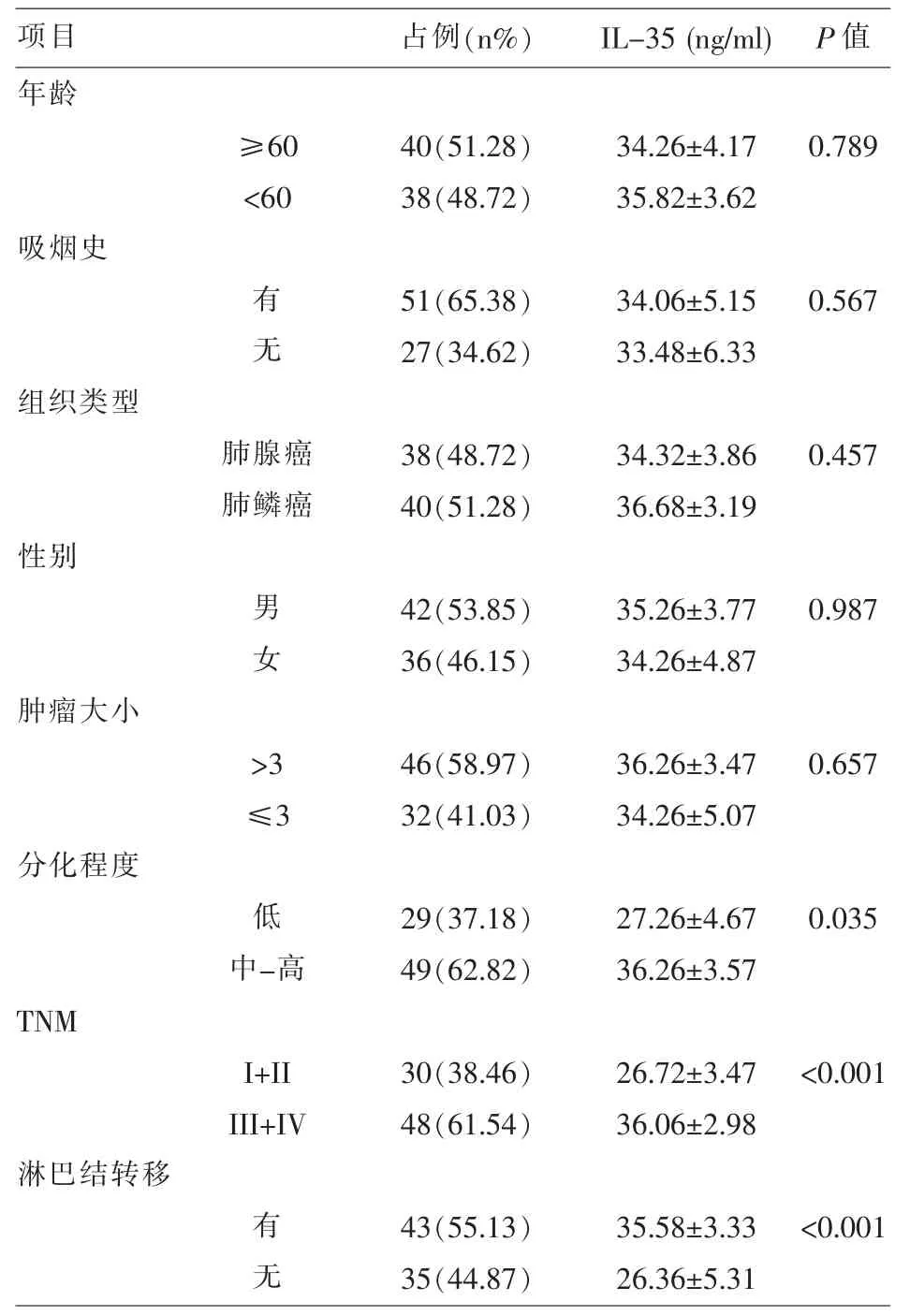
表1 外周血IL-35表达与NSCLC患者临床特征的关系
在本研究中,我们通过检测NSCLC患者中血浆及癌组织中IL-35的表达量,并分析血清中IL-35与患者临床病理特征之间的联系。结果分析发现:第一,NSCLC患者癌组织及血浆中IL-35的表达量明显高于癌旁及健康体检者,在癌组织中的IL-35的表达量与肺癌的组织类型显著相关,肺鳞癌中IL-35高于肺腺癌,且差异有统计学意义;但是在血清中的检测结果显示,他们之间无统计学意义;分析其结果,可考虑为统计样本导致,亦或是由于检测方法的不同导致;第二,IL-35的表达量与患者是否发生淋巴结转移、分化程度及TNM密切相关,肿瘤的分化程度中,IL-35与肿瘤的分化程度成正比;在肿瘤的TNM分期中,肿瘤分期越高,IL-35表达量越高。伴有淋巴结转移的NSCLC患者血清中IL-35水平较无淋巴结转移者高。该结果与Gu等[13]研究结果较为一致,他们认为IL-35与NSCLC疾病的进程及淋巴结转移密切相关。但在本研究中发现NSCLC患者的血清中IL-35的表达量与分化程度密切相关,这与Gu研究结果不符,考虑为在研究过程中由于样本量的差异导致,故如需获得更加严谨及准确的结果,仍需更大样本、从多方位来验证本结果。
参考文献
[1]龚蕊,莫晓能,邵娟,等.PAX9在非小细胞肺癌中的表达及其临床意义[J].江西医药,2017,52(3):210-213.
[2]叶肖燕.非小细胞肺癌患者表皮生长因子受体基因突变特征及意义[J].中华实用诊断与治疗杂志,2016,30(1):49-51.
[3]张曼,陶秀娟.非小细胞肺癌的生物治疗研究进展[J].中国肿瘤,2013,22(5):379-383.
[4]李丽华,傅颖梅,金钊,等.吉西他滨联合血管内皮抑制素治疗晚期非小细胞肺癌的探讨[J].江西医药,2016,51(12):1412-1414.
[5]Egwuagu CE,Yu CR,Sun L,et al.Interleukin 35:Critical regulator of immunity and lymphocyte-mediated diseases[J].Cytokine&Growth Factor Reviews,2015,26(5):587-593.
[6]Fan YG,Zhai JM,Wang W,et al.IL-35 over-expression is associated with genesis of gastric cancer[J].Asian Pacific Journal of Cancer Prevention Apjcp,2015,16(7):2845.
[7]陈爽,鞠晓红,郑文彧,等.IL-35与人类疾病关系的研究进展[J].免疫学杂志,2014,30(7):645-649.
[8]刘志东,许绍发,肖宁,等.IL-8和MMP-9在非小细胞肺癌患者组织及血清中表达水平的研究 [J].中国肺癌杂志,2010,13(8):795-802.
[9]Kayser G.Non-small cell lung cancer.New biomarkers for diagnostics and therapy[J].Der Pathologe,2015,36(Suppl 2):189.
[10]Collison LW,Vignali DA.Interleukin-35:odd one out or part of the family?Immunol Rev,2008,226(1):248-262.
[11]Nicholl MB,Ledgewood CL,Chen X,et al.IL-35 promotes pancreas cancer growth through enhancement of proliferation and inhibition of apoptosis:Evidence for a role as an autocrine growth factor[J].Cytokine,2014,70(2):126-133.
[12]Turnis M,Sawant D,Szymczak-Workman A,et al.Interleukin-35 Limits Anti-Tumor Immunity[J].Immunity,2016,44(2):316.
[13]Long J,Zhang X,Wen M,et al.IL-35 over-expression increases apoptosis sensitivity and suppresses cell growth in human cancer cells[J].Biochemical&Biophysical Research Communications,2013,430(1):364-369.
