白细胞介素25在哮喘小鼠肺组织中的表达及其对气道重塑的影响*
2018-05-17胡建平韩俊垒汤兵祥
胡建平,韩俊垒,汤兵祥
(河南省胸科医院呼吸一病区,郑州 450008)
支气管哮喘是全球重点关注的异质性疾病之一,严重危害公众健康,主要表现为气道慢性炎症。哮喘发病机制及防治方法是目前临床医学急需解决的难题[1-2]。气道重塑作为一种重要的哮喘性气道改变,上皮肥厚及化生、肌层纤维细胞增殖,杯状细胞增生,新生血管形成,基底膜下细胞外基质沉积,气道平滑肌的细胞增生等是其主要特点;若发生气道重塑,可导致哮喘转变为哮喘-慢阻肺重叠综合征[3-4]。气道上皮细胞在受到病原微生物、过敏原刺激后能分泌出多种细胞因子,此细胞因子在哮喘免疫应答、调控方面具有重要意义,其中白细胞介素(IL)-25是近年来医学研究热点[5]。IL-25是IL-17细胞因子的家族成员之一,能启动、调节Th2细胞,促进Th2型免疫应答[6]。研究显示,哮喘患者、小鼠哮喘模型的血清及痰液、肺组织内均存在高表达IL-25,基因过表达、外源性给予IL-25可导致小鼠产生气道高反应性等类似人类哮喘样改变[7]。平滑肌肌动蛋白(α-SMA)是一种重要的平滑肌标志物,胶原合成能力较强,具有一定收缩潜能,能对平滑肌收缩功能改变、数量进行反映,能引起官腔收缩狭窄和哮喘发作,故α-SMA表达增加可能和哮喘气道重塑、发作等具有密切关联[8-9]。本研究为准确识别哮喘内表型差异,增强哮喘治疗效果,对哮喘小鼠肺组织内IL-25表达及IL-25对气道重塑的影响进行分析,现报道如下。
1 材料与方法
1.1材料 选取郑州大学基础医学院饲养的90只雌性BALB/C小鼠作为实验对象,约8周龄,体质量19~28 g。所有小鼠均饲养在具有空气过滤的21~22 ℃恒温房间,每间隔12 h实施1次光暗循环。实验开展前小鼠自由饮水与摄食,鼠粮均接受辐照消毒,饮用水为高温消毒的纯净水。本研究通过单位动物伦理委员会批准[201609-005]。
1.2方法
1.2.1构建小鼠哮喘模型 (1)90只小鼠分为对照组、实验组各45只,并随机编号。(2)造模期间饮用水、鼠粮间隔2~3 d更换1次,鼠笼及垫料每周更换1次。(3)配制鸡卵清蛋白(OVA)混悬液、雾化液:分别称取适量的OVA、氢氧化铝,在0.25 mL无菌生理盐水内溶入OVA 100 mg,氢氧化铝1 mg,制备为OVA混悬液,于60 min内用完;再于1 mL生理盐水内溶入25 mg的OVA,搅拌均匀,配制成OVA(2.5%)生理盐水溶液,雾化为气溶胶后,可供小鼠吸入。(4)小鼠造模:①小鼠致敏,依据现配现用原则配制OVA混悬液,将100 mg的OVA、氢氧化铝1 mg溶于0.25 mL无菌生理盐水内配制为致敏液体。②小鼠饲养第1天行致敏处理,将0.2 mL致敏溶液从腹腔注入小鼠体内;对照组每只小鼠均经腹腔注入生理盐水0.2 mL。③饲养第8天再行致敏处理,将0.2 mL致敏溶液从腹腔注入小鼠体内;对照组每只小鼠由腹腔注入生理盐水0.2 mL。④饲养1~8 d,两组小鼠均不接受任何处理,第8天致敏结束后至第15天期间不行任何处理,定期更换饮用水、鼠粮、垫粮及鼠笼。⑤饲养小鼠2周后,取出小鼠放进雾化盒内,实施小鼠雾化,每次抽取雾化液20 mL放进雾化装置内,启动980超声雾化器,实验组雾化吸入2.5%的OVA,30分钟/次,持续雾化7 d;对照组雾化吸入0.9%生理盐水,30分钟/次,持续雾化7 d。⑥雾化完成后,于24 h内处死小鼠。
1.2.2提取小鼠肺、支气管组织 (1)根据每只小鼠体质量给予注射水合氯醛麻醉,每10 g注射0.25 mL。(2)所有实验器材均经高压消毒无菌处理,取出小鼠1只眼睛,由内眦静脉取血,放入EP管(1.5 mL)内,标记编号;取完血后,用针头将小鼠头部、四肢固定,将细线套在小鼠牙齿上固定头部。(3)后用镊子、组织剪将小鼠颈部皮肤剪开,将胸部、腹部皮肤剥离,使胸部、腹部组织与肌肉暴露;逐层剪开颈部组织至颈部主支气管、支气管周围筋膜组织分离、暴露。用组织剪将小鼠胸骨、周围组织去除,将小鼠胸腔剪开,暴露肺脏。(4)由主支气管进留置针,经留置针将0.9%生理盐水注入小鼠肺组织内至两肺膨胀;静置一段时间,回收肺内液体,放进EP管(1.5 mL)内;取出肺泡灌洗液,将小鼠的肺组织与主支气管分离并取出,用锡箔纸做好包装。(5)小鼠腹腔用组织剪打开并分离腹部脏器,镊子取出脾脏,放进甲醛冷冻管内,标记编号,放进-80 ℃冰箱内保存;解剖小鼠后对小鼠尸体进行适当处理。(6)小鼠血清、肺泡灌洗液放进-80 ℃冰箱内保存,肺气管组织、脾脏组织放进液氮罐内保存。采用酶联免疫吸附法(ELISA)检测两组小鼠血清、肺泡灌洗液内IL-25、α-SMA,所有操作严格根据说明书执行。
1.2.3蛋白质印迹法 将制冰机开启,在10 mL离心管上分别标记对照组、实验组。由液氮罐内取出两组小鼠的肺脏组织并放进冰块内,量取每只小鼠组织各200 g,分别置入10 mL的离心管内,并将离心管置入冰块内,参照10∶1比例配制放射免疫沉淀法(RIPA)、苯甲基磺酰氟(PMSF)组织裂解液。在每组EP管内各加入组织裂解液100 mL,间断振荡。启动匀浆机,蒸馏水冲洗匀浆机匀浆头、匀浆组织,每个样品匀浆完均用蒸馏水冲洗匀浆头,匀浆后放进冰块内。在4 ℃离心机内行12 000 r/min离心5 min。分别留取上清液放进新EP管内,放入-80 ℃冰箱内保存待用。用二喹啉甲酸(BCA)试剂盒检测提取的肺脏蛋白质浓度,操作步骤严格按照试剂盒说明执行。配制5%脱脂奶,步骤为选取玻璃板,清洗、调整玻璃板,配胶,配制电泳液,加入提取蛋白质、预染蛋白Marker,电泳,转膜,洗膜,封闭,TBST清洗,加入IL-25抗体与内参,TBST清洗,二抗孵育,显影。
1.2.4免疫组织化学法 (1)制作切片:剪取肺组织块约0.5 cm3,常规漂洗、固定、乙醇梯度洗脱,用二甲苯相关溶液浸洗肺及支气管组织,包装、切片、展片,充分展平后放在涂抹蛋白甘油的载玻片上,于38 ℃恒温箱内烘干,再染色。(2)免疫组织化学检测:①将两组小鼠肺组织放进60 ℃恒温箱内烘烤,1 h后从烤箱内取出载玻片于室温下冷却。②将肺组织切片放进二甲苯1、二甲苯2、二甲苯3内各脱蜡10 min;取出载玻片依次放进100%、95%、90%、80%、70%乙醇内脱洗,各5 min,用蒸馏水漂洗5 min。③修复抗原:将组织切片放进500 mL的0.01 mmol/L柠檬酸盐溶液内,微波高温加热至沸腾,12 min后停止加热,自然冷却至室温;用磷酸盐缓冲液(PBS)清洗3次,5分钟/次。在组织切片上各滴加1滴3%的H2O2后放进湿盒内浸泡10 min,将内源性过氧化物酶消除。取出载玻片,用PBS漂洗3次,3分钟/次。④封闭:在组织切片上滴加非免疫性动物血清50 mL,放进湿盒内封闭10 min,后取出载玻片用PBS缓冲液浸洗3次,3分钟/次。⑤一抗孵育:根据1∶200比例将IL-25稀释,在组织切片上滴加一抗,4 ℃冰箱内过夜。⑥复温:第2天从冰箱内取出载玻片,自然复温到室温,用PBS浸洗3次,5分钟/次。⑦二抗孵育:在各个组织切片上滴加1滴约50 mL二抗,放进37 ℃恒温箱内孵育30 min,后放进湿盒内浸泡10 min;用PBS缓冲液浸洗3次,3分钟/次。⑧显色:在1 mL的DAB染色液底物缓冲液内加入1滴DAB浓缩液进行稀释,配制成DAB工作液,避光下使用;在组织切片上滴加50 mL稀释后的DAB溶液,对染色时间进行严格控制,后用自来水漂洗;DAB染色后的组织切片用苏木精-伊红(HE)染色1 min,染色后用自来水清洗1 min。⑨脱水:切片洗净后实施乙醇梯度脱水及二甲苯脱水,具体操作说明脱蜡步骤相反,脱水后盖盖玻片,对盖玻片方向进行校正,切片封好后放进恒温箱内干燥。干燥后擦净切片上残余浮色,将标签贴在玻片左端,注明组织切片的名称、染色方法与日期、固定方法。于显微镜下对HE染色后的两组小鼠组织切片进行观察。
1.2.5RT-PCR检测 采用TaKaRa公司生产的Trizol试剂提取肺组织总RNA,定量后依照反转录试剂盒说明书严格操作制备cDNA。利用上海生物工程公司合成引物,采用SYBR Green法定量检测IL-25 mRNA表达水平。其中,引物序列,上游5′-TGGACAGGACTTGAATCGG-3′,下游5′-CAGGAGTATGGCTTCCAGGGT-3′;GAPDH引物序列,上游5′-GGGTGATGCTGGTGCTGAGTATGT-3′,下游5′-AAGAATGGGAGTTGCTGTTGAAGZTC-3′。将cDNA、引物和SYBR Green混合,分别在95 ℃、5 min,95℃、20 s,55 ℃、20 s,75 ℃、30 s,进行40 个循环。IL-25 mRNA表达水平采用相对定量法计算,用管家基因校正样品初始量。
1.2.6观察指标 结果判定:细胞质呈红色,细胞核呈蓝色,背景呈粉红色,提示染色合格[10]。于400倍显微镜下观察,采用Image-Pro Plus图像分析软件对肺组织切片上α-SMA气道平滑肌厚度进行直接测量与分析,分析IL-25、α-SMA对气道重塑的影响。
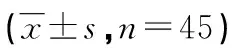
表1 两组IL-25、IL-25 mRNA、α-SMA水平比较
2 结 果
2.1ELISA结果 对照组小鼠血清、肺泡灌洗液内IL-25、α-SMA水平均低于实验组,肺组织内IL-25 mRNA也低于实验组,差异有统计学意义(P<0.05),见表1。
2.2小鼠哮喘模型鉴定结果 实验组小鼠在受到激发10 min后呼吸变快、加深,躯干、头部、鼻子及面部皮肤均产生不同程度的瘙痒;早期发生躁动症状,后期出现弓背、点头呼吸、呼吸急促、口唇发紫、前肢缩抬及少动等症状;严重小鼠发生大小便失禁、腹肌/肢体抽搐、呼吸减慢及反应迟缓等情况;小鼠在受到多次连续激发后,进食量缩减,体质量相对减轻,提示成功制备哮喘模型。对照组小鼠未产生上述症状。

图1 对照组肺组织IL-25表达(×200) 图2 实验组肺组织IL-25表达(×200)
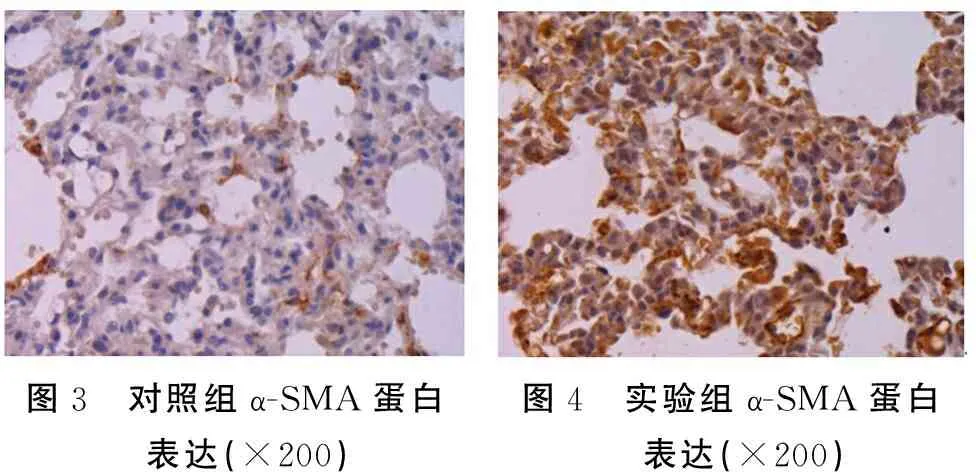
图3 对照组α-SMA蛋白表达(×200) 图4 实验组α-SMA蛋白表达(×200)
2.3免疫组织化学法检测结果 对照组小鼠的肺组织病理切片表明小鼠具有完整的支气管黏膜上皮与肌层,管腔规则,支气管组织与结构清晰、完整,组织周围未出现明显的炎性细胞浸润,黏液分泌表现正常(图1);实验组小鼠支气管的管壁增厚,黏膜上皮破损,管腔变狭窄,产生炎性细胞浸润(图2)。α-SMA蛋白的阳性表达主要在支气管壁,支气管壁上沉积棕褐色颗粒;实验组小鼠支气管壁上的α-SMA蛋白表达明显高于对照组,见图3~4。
2.4蛋白质印迹法结果 与对照组相比,实验组小鼠支气管肺组织内IL-25、α-SMA水平相对较高(P<0.05),见图5。
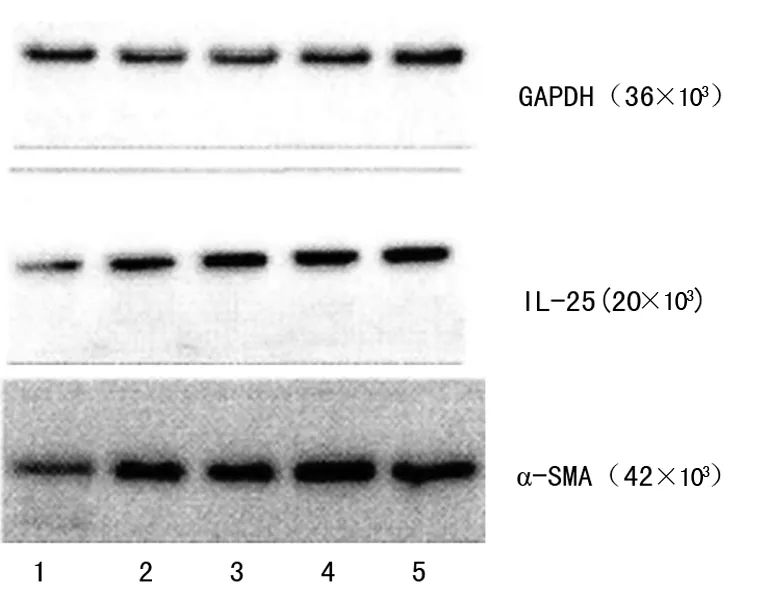
1:对照组,2~5:实验组
图5两组小鼠蛋白质印迹法检测结果
2.5相关性 实验组小鼠肺组织内IL-25、α-SMA相关性表达呈正相关(r=0.751,P<0.05)。
3 讨 论
相关研究指出支气管哮喘的重要机制为Th1、Th2细胞比例失衡造成的免疫学改变,细胞因子分泌增多、Th2细胞数目增多、免疫反应功能亢进是其主要特点[11-13]。IL-25主要是由炎性细胞产生,是诱导支气管哮喘气道产生炎症的重要中心介质[14]。根据嗜酸性粒细胞引起的哮喘发现,嗜酸性粒细胞能诱导炎性细胞(肥大细胞)释放组胺,释放的组胺能导致支气管平滑肌细胞肥大、支气管基底膜的网状组织增厚[15]。而Th2细胞在受到IL-25诱导后能释放多种作用于不同细胞的趋化因子与细胞因子,并产生不同的生物学效应,引发哮喘气道炎症,故预测IL-25在哮喘气道重塑中可能发挥重要作用[16-17]。另有相关研究表明,α-SMA及胶原蛋白-1、E-钙粘蛋白大量沉积在支气管哮喘气道黏膜下,与气道重塑发生存在一定相关性;α-SMA表达增加使痉挛、狭窄加重,增加黏液分泌物,进而引起抗透明质等酸酶反应,可能和哮喘症状发作、气道重塑有关[17-19]。因此对哮喘患者肺组织内IL-25、IL-25 mRNA、α-SMA表达进行早期检测,能为临床防治哮喘提供新的参考依据。
李鸿佳等[20]研究发现,IL-25在哮喘患者气道内表达增加,能使上皮细胞、成纤维细胞上相应表达增加,提示IL-25与哮喘气道重塑存在密切关联。本研究结果说明IL-25在哮喘小鼠肺组织内表达水平较高,在哮喘病发过程中能经一定相关机制引起气道重塑,IL-25表达增加与哮喘气道重塑存在一定相关性,故在哮喘气道重塑发生、发展过程中IL-25可能起到重要作用。本研究与李鸿佳等[20]研究结果相对一致。
综上所述,哮喘小鼠肺组织、血清及肺泡灌洗液内IL-25、α-SMA均呈相对高表达,根据IL-25、α-SMA正相关性,预测干预IL-25、下游因子表达,将相关通路、机制阻断,能延缓或抑制气道重塑,从而减轻哮喘临床症状。
参考文献
[1]扶红根,雷后兴.白介素-35与支气管哮喘的相关性研究进展[J].中国免疫学杂志,2016,32(1):123-126.
[2]张梦莹,徐芸芸,吴静,等.哮喘小鼠肺组织Nuocytes增多与GITR-GITRL表达的关系[J].江苏大学学报(医学版),2015,26(4):277-281.
[3]张元元,边翠霞,吴金香,等.IL-33通过ERK1/2信号通路促进哮喘模型小鼠气道重塑[J].细胞与分子免疫学杂志,2016,32(5):590-594.
[4]郭东霖,赵生涛,王熠杰,等.哮喘气道重塑小鼠模型的构建及病理学特征变化的探讨[J].第三军医大学学报,2016,38(10):1102-1106.
[5]NADER M A.Inhibition of airway inflammation and remodeling by sitagliptin in murine chronic asthma[J].Int Immunopharmacol,2015,29(2):761-769.
[6]刘清发,王超,孙启晶,等.IL-25通过nuocyte细胞诱导哮喘小鼠气道重塑[J].山东大学学报(医学版),2016,54(8):28-33.
[7]郭红,成焕吉,鲁继荣,等.白细胞介素-25与支气管哮喘小鼠发病的关系[J].中国实验诊断学,2013,17(8):1387-1391.
[8]黄晓奇.HMGB1和α-SMA在BPD新生儿血清、肺泡灌洗液中的表达及临床价值研究[J].中国妇幼保健,2016,31(12):2499-2500.
[9]XIN Y,LV J Q,WANG Y Z,et al.Effect of all-trans retinoic acids (ATRA) on the expression of α-smooth muscle actin (α-SMA) in the lung tissues of rats with pulmonary arterial hypertension (PAH)[J].Genet Mol Res,2015,14(4):14308-14313.
[10]姚丽,宋丽敏.IL-25和TSLP在支气管哮喘患儿外周血中的变化及其临床意义[J].临床肺科杂志,2016,21(6):1134-1136.
[11]阎昱升,汤渝玲.支气管哮喘患者血清IL-37、IL-25、IgE的变化及意义[J].医学临床研究,2015,32(5):1014-1016.
[12]汪沛,徐蓓,任丽芬,等.IL-25对气道平滑肌细胞增殖活性的影响及其机制[J].国际呼吸杂志,2015,35(13):1000-1003.
[13]IINUMA T,OKAMOTO Y,YAMAMOTO H,et al.Interleukin-25 and mucosal T cells in noneosinophilic and eosinophilic chronic rhinosinusitis[J].Ann Allergy Asthma Immunol,2015,114(4):289-298.
[14]陆韦,刘清亮,冉丰丰,等.动态研究地塞米松对哮喘小鼠肺IL-25 mRNA和IL-25表达的影响[J].医学研究生学报,2013,26(10):1032-1036.
[15]CHENG D,XUE Z,YI L L,et al.Epithelial interleukin-25 is a key mediator in Th2-high,corticosteroid-responsive asthma[J].Am J Respir Crit Care Med,2014,190(6):639-648.
[16]KOUZAKI H,TOJIMA I,KITA H,et al.Transcription of interleukin-25 and extracellular release of the protein is regulated by allergen proteases in airway epithelial cells[J].Am J Respir Cell Mol Biol,2013,49(5):741-750.
[17]WANG W B,YEN M L,LIU K J,et al.Interleukin-25 mediates transcriptional control of PD-L1 via STAT3 in multipotent human mesenchymal stromal cells (hMSCs) to suppress Th17 responses[J].Stem Cell Reports,2015,5(3):392-404.
[18]LUO C T,LIU Q H,et al.Impaired bronchoprotection is not induced by increased smooth muscle mass in chronic treatment in vivo with formoterol in asthmatic mouse model[J].West In Med J,2014,63(6):641-646.
[19]HUANG K,YAN Z Q,ZHAO D,et al.SIRT1 and FOXO mediate contractile differentiation of vascular smooth muscle cells under cyclic stretch[J].Cell Physiol Biochem,2015,37(5):1817-1829.
[20]李鸿佳,刘粉,鲁德玕,等.IL-25在支气管哮喘患者气道炎症中的表达及临床意义[J].中华全科医师杂志,2013,12(11):913-915.
