缺氧诱导因子-1α基因1772C/T多态性与冠心病患者侧枝循环形成关系的Meta分析
2018-05-17汪贵清陈运清
高 洁,王 琳,汪贵清,陈运清
(重庆医科大学附属第二医院心血管内科,重庆 400010)
冠状动脉侧枝循环(coronary collateral circulation,CCC)是冠心病(coronary heart disease,CHD)患者缺血心肌血供的重要替代性来源。发育良好的侧枝循环能减轻心肌缺血性损伤,缓解心绞痛症状,改善心功能和提高患者生存率[1]。提前预测出有无侧支循环形成,有助于筛查出发生心脏不良事件风险相对较高的部分人群,同时有助于制订个性化的治疗方案。缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)是目前发现的一种具备高度特异性、专一调节氧稳态的核转录因子。HIF-1由α亚基和β亚基构成,其生理活性主要取决于α亚基[2]。HIF-1α基因存在多个单核苷酸多态性(SNP)位点,位于12号外显子处的1772C/T(rs11549465)是目前研究最多、最重要的位点之一。由于C等位基因突变为T等位基因,引起氨基酸序列第582位的脯氨酸(proline,Pro)变为丝氨酸(Serine,Ser)(Pro582Ser,P582S),从而影响蛋白质的活性和生物学效应。目前关于HIF-1α基因多态性研究主要集中于其与肿瘤易感性关系方面,也有报道其与前列腺癌、肺癌等疾病相关[3-4]。当前也有较多的学者致力于研究HIF-1α基因1772C/T多态性是否会减弱冠心病患者侧枝循环的形成,但研究结果存在争议。本文采用Meta分析的方法,探讨HIF-1α基因1772C/T多态性和冠心病患者侧枝循环形成的关系。
1 资料与方法
1.1纳入与排除标准 纳入标准:文献类型为病例-对照研究;一般资料完整;文种不限。研究对象为冠心病患者,包括急性冠状动脉综合征、陈旧性心肌梗死、稳定性心绞痛,慢性完全性闭塞。所有的冠心病患者均经过冠状动脉造影证实,至少存在1个分支狭窄大于50%。暴露因素如下,病例组HIF-1α基因发生变异(1772C→T),对照组未发生变异。结局指标为侧枝循环形成与否。
排除标准:综述、会议汇编等;重复发表的研究;数据不完整或与作者联系后仍无法无法获得完整数据的文献。
1.2检索策略 计算机检索PubMed、EMbase、The Cochrane Library、中国生物医学文献数据库(CBM)、中国知网(CNKI)、维普网及万方数据库,收集有关HIF-1α基因多态性与冠心病侧枝循环形成关系的病例对照研究。时间跨度为建库至2017 年1 月。同时采取手工检索和文献追踪的方法以获取更多合格的文献。中文检索词包括缺氧诱导因子-1α、HIF-1α、冠心病、心肌梗死、急性冠状动脉综合征、慢性完全性闭塞。英文检索词包括hypoxia-inducible factor-1α、HIF-1α、polymorphism、single nucleotide polymorphisms、SNP、GWAS、mutation、ischemic heart diseases、coronary heart disease、coronary artery disease、myocardial infarction、acute coronary syndrome、chronic total occlusion。
1.3文献筛选、资料提取与质量评价 分别按照纳入、排除标准独立筛选文献、提取信息和质量评价。提取资料的内容主要包括:第一作者,发表时间,国家,质量评价的关键要素及病例组和对照组基因型频率。纳入研究的方法学质量采用Newcastle-Ottawa Scale(NOS)工具进行评价[5]。
1.4统计学处理 采用STATA12.0软件进行统计学分析。采用Q检验分析统计学异质性,选择OR及95%CI为效应指标。经Q检验若异质性较小(P>0.10且I2<50%)时,选用固定效应模型;反之则采用随机效应模型。计算对照组及总人群的哈温平衡(Hardy-Weinberg equilibrium,HWE)。并通过逐一排除研究的方法行敏感性分析,判断结果的稳定性。
2 结 果
2.1检索结果 共检索出相关文献53篇。通过阅读题目和摘要,排除综述及与本研究不相关的文献42篇。进一步阅读全文,排除6篇不符合纳入标准的文献,最后共5篇文献[6-10]纳入Meta分析。所有研究的NOS评分均大于7 分,认为质量可靠。5个研究共包含1 355例研究对象(病例组726例和对照组629例)。纳入研究的基本特征见表1。文献纳入筛选流程见图1。每篇文献对照组基因型分布均符合HWE,其中1篇文献总人群基因型分布不符合HWE,剩余4篇均符合HWE。
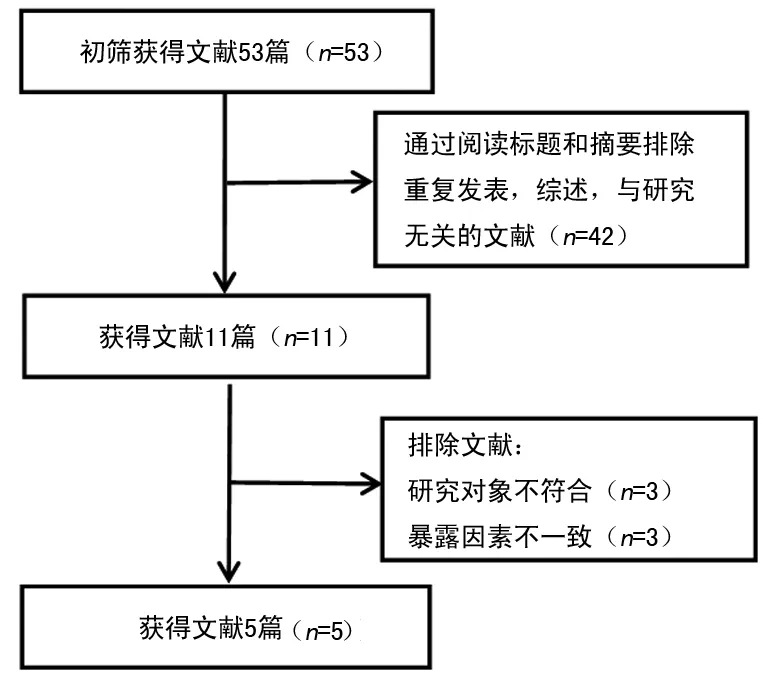
图1 文献纳入筛选流程
2.2Meta分析结果
2.2.1等位基因模型(Tvs. C) 以基因T为暴露因素,基因C为非暴露因素,在随机效应模型下,Meta分析结果显示:两组等位基因频率比值差异无统计学意义(OR=1.70,95%CI:0.85~3.39,P=0.134;I2=69.7%),见图2。

表1 纳入文献的基本特点(n)
侧枝循环评价方法:采用Rentrop分级
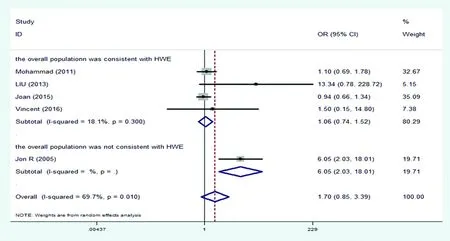
图2 HIF-1α基因C1772T多态性(T vs.C)与冠心病患者侧枝循环相关性的Meta分析表2 HIF-1α基因1772C/T多态性和冠心病患者侧枝循环形成的关系的Meta分析结果
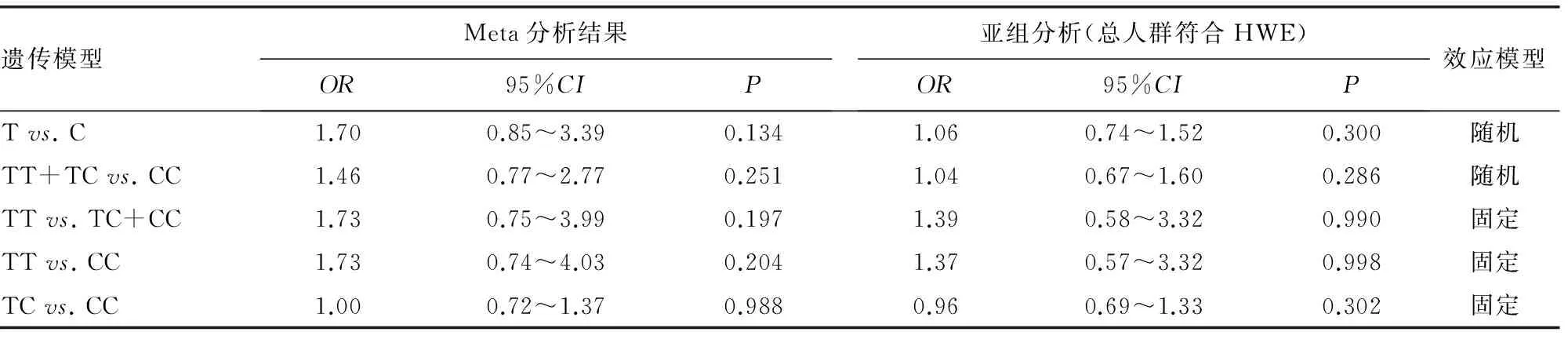
遗传模型Meta分析结果OR95%CIP亚组分析(总人群符合HWE)OR95%CIP效应模型Tvs.C1.700.85~3.390.1341.060.74~1.520.300随机TT+TCvs.CC1.460.77~2.770.2511.040.67~1.600.286随机TTvs.TC+CC1.730.75~3.990.1971.390.58~3.320.990固定TTvs.CC1.730.74~4.030.2041.370.57~3.320.998固定TCvs.CC1.000.72~1.370.9880.960.69~1.330.302固定
2.2.2显性基因模型(TT+TCvs. CC) 以TT+TC为暴露因素,CC为非暴露因素,随机效应模型下Meta分析结果显示:两组基因型分布差异无统计学意义(OR=1.46,95%CI:0.77~2.77,P=0.251;I2=54.9%),见表2。
2.2.3隐性基因模型(TTvs. CC+TC) 以TT为暴露因素,TC+CC为非暴露因素,由于其中两篇文献病例组和对照组TT基因型频率均为0,故剔除[11]。固定效应模型下Meta分析结果显示,两组基因型分布差异无统计学意义(OR=1.73,95%CI:0.75~3.99,P=0.197;I2=34.4%),见表2。
2.2.4纯合子基因模型(TTvs. CC) 以TT为暴露因素,CC为非暴露因素,由于其中两篇文献病例组和对照组TT基因型频率均为0,故剔除[11],固定效应模型下Meta分析结果显示:两组基因型分布差异无统计学意义(OR=1.73,95%CI:0.74~4.03,P=0.204;I2=38.2%),见表2。
2.2.5杂合子基因模型(TCvs. CC) 以TC为暴露因素,CC为非暴露因素,固定效应模型下Meta分析结果显示:两组基因型分布差异无统计学意义(OR=1.00,95%CI:0.72~1.37,P=0.988;I2=16.6%),见表2。
2.2.6亚组分析 进一步根据总人群是否符合HWE进行亚组分析。其中总人群符合HWE的亚组纳入4篇文献[7-10],不符合HWE的仅1篇文献[6]。对符合HWE的亚组分析发现,各种等位基因模型下,HIF-1α基因1772C/T多态性和冠心病患者侧枝循环形成差异均无统计学意义(P>0.05),见表2。
2.3异质性敏感性分析 分等位基因模型(I2=69.7%)和显性模型(I2=54.9%)异质性较大,但通过亚组分析后各个模型异质性均显著降低。
3 讨 论
冠状动脉侧枝循环是冠心病患者血流储备的重要来源之一,关于侧枝循环形成影响因素的研究也许能够为冠心病的治疗提供新的思路。侧枝循环形成包括血管发生(angiogenesis)和血管新生(arteriogenesis)两个过程[12],而具体机制目前尚未十分清楚,但HIF-1α可能在其中起着重要的作用。在猪模型上发现,注射腺病毒介导的HIF-1α/VP16基因组相比对照组缺血心肌侧枝循环形成更为丰富[13]。CHEN等[14]报道有侧枝循环的冠心病组HIF-1α与无侧枝循环形成组比较,表达更为丰富。这些结果显示HIF-1α可能与冠状动脉侧枝循环的形成存在着一定的联系。
然而,本研究结果显示5种遗传模型和亚组分析下均未发现HIF-1α基因1772C/T(rs11549465)多态性与冠心病患者侧枝循环形成的关系,意味着这个多态性位点不能在统计上促进或者减弱侧枝循环的形成。本研究结果同其他研究结果[7,9]相一致。不同于研究发现:HIF-1α在缺氧有关的心肌新生血管化过程中起着关键作用[15-16]。基于本研究结果,笔者考虑得出上述阴性结果原因有:HIF-1α基因1772C/T多态性确实与冠状动脉侧枝循环无关。正如目前有学者认为:在侧枝循环的形成机制中炎症和剪切力的影响相比缺氧更为重要[17];根据基因多态性相关的分子流行病学研究理论,应在分子水平探讨环境-基因交互作用在疾病发生、发展中的影响[18],因此,HIF-1α基因1772C/T多态性可能同其他环境因素共同影响侧枝循环形成。从遗传学角度来看,可能是基因-基因的交互作用影响了侧枝循环的形成,本课题就HIF-1α基因进行了分析。
同时,本研究仍存在较多局限性:(1)由于T等位基因频率在人群中较低,研究需要大样本量,以避免假阴性或假阳性结果,而本研究纳入的单个研究样本量相对较小。(2)本课题就HIF-1α基因单个SNP位点进行分析,未考虑基因-环境交互作用,连锁不平衡(linkage disequilibrium)等因素影响,因此,可能会导致研究异质性增高,以及掩盖基因位点对侧枝循环形成的影响。
综上所述,根据本研究结果,笔者认为HIF-1α基因1772C/T多态性与冠心病患者侧枝循环形成相关性的证据暂不足,仍需要更多设计良好的大规模、多中心的临床研究来证实两者间的关系,以进一步明确遗传易感性在冠状动脉侧枝循环形成中的作用,帮助临床医生筛查出高危人群,制订出个体化的医疗策略,降低冠心病病死率、致残率。
参考文献
[1]MEIER P,HEMINGWAY H,LANSKY A J,et al.The impact of the coronary collateral circulation on mortality:a meta-analysis[J].Eur Heart J,2012,33(5):614-621.
[2]SEMENZA G L.Hypoxia-inducible factor 1 and cardiovascular disease[J].Annu Rev Physiol,2014(76):39-56.
[3]FRAGA A,RIBEIRO R,COELHO A,et al.Genetic polymorphisms in key hypoxia-regulated downstream molecules and phenotypic correlation in prostate cancer[J].BMC Urol,2017,17(1):12.
[4]LI Y,LI C,SHI H,et al.The association between the rs11549465 polymorphism in the hif-1α gene and cancer risk:a meta-analysis[J].Int J Clin Exp Med,2015,8(2):1561-1574.
[5]STANG A.Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J].Eur J Epidemiol,2010,25(9):603-605.
[6]RESAR J R,ROGUIN A,VONER J,et al.Hypoxia-inducible factor 1alpha polymorphism and coronary collaterals in patients with ischemic heart disease[J].Chest,2005,128(2):787-791.
[7]ALIDOOSTI M,GHAEDI M,SOLEIMANI A,et al.Study on the role of environmental parameters and HIF-1A gene polymorphism in coronary collateral formation among patients with ischemic heart disease[J].Clin Biochem,2011,44(17/18):1421-1424.
[8]LIU Q,LIANG Y,ZOU P,et al.Hypoxia-inducible factor-1α polymorphisms Link to coronary artery collateral development and clinical presentation of coronary artery disease[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2013,157(4):340-345.
[9]DURAN J,OLAVARRA P S,MOLA M,et al.Genetic association study of coronary collateral circulation in patients with coronary artery disease using 22 single nucleotide polymorphisms corresponding to 10 genes involved in postischemic neovascularization[J].BMC Cardiovasc Disord,2015(15):37.
[10]AMOAH V,WRIGLEY B,HOLROYD E,et al.Vascular endothelial growth factor and hypoxia-inducible factor-1α gene polymorphisms and coronary collateral formation in patients with coronary chronic total occlusions[J].Sage Open Med,2016(4):2050312116654403.
[11]Egger M,Smith G D,Altman D.Systematic reviews in health care.Meta-analysis in context[M].Britain:BMJ Books,2001:347.
[12]SEILER C.The human coronary collateral circulation[J].Heart,2003,89(11):1352-1357.
[13]HINKEL R,LEBHERZ C,FYDANAKI M,et al.Angiogenetic potential of Ad2/Hif-1α/VP16 after regional application in a preclinical pig model of chronic ischemia[J].Curr Vasc Pharmacol,2013,11(1):29-37.
[14]CHEN S M,LI Y G,ZHANG H X,et al.Hypoxia-inducible factor-1alpha induces the coronary collaterals for coronary artery disease[J].Coron Artery Dis,2008,19(3):173-179.
[15]CHENG C,LI P,WANG Y G,et al.Study on the expression of VEGF and HIF-1α in infarct area of rats with AMI[J].Eur Rev Med Pharmacol Sci,2016,20(1):115-119.
[16]JIANQIANG P,PING Z,XINMIN F,et al.Expression of hypoxia-inducible factor1α ameliorate my ocardial ischemia in rat[J].Biochem Biophys Res Commun,2015,465(4):691-695.
[17]RESNICK N,EINAV S,CHEN-KONAK L,et al.Hemodynamic forces as a stimulus for arteriogenesis[J].Endothelium,2003,10(4/5):197-206.
[18]沈洪兵.基因多态性与疾病易感性的分子流行病学研究:问题与对策[J].中华流行病学杂志,2004,25(9):766-768.
