中药化学数据库中HIV RT(NNRTI)/IN双靶点抑制剂的虚拟筛选*
2018-05-17肖泽云李爱秀
肖泽云 ,李 凯 ,2,李爱秀 ,3
艾滋病(AIDS)是由人类免疫缺陷病毒(HIV)引起的一种复杂疾病,其治疗一直是医学难题。HIV属于逆转录病毒,变异性强,在使用单靶点药物治疗AIDS的过程中,病毒容易产生耐药[1]。运用网络药理学对复杂疾病进行网络分析,发现AIDS等复杂疾病由多因素共同作用,其病理过程涉及多个细胞信号分子,仅针对单一细胞信号分子难以起到良好的治疗效果。多靶点药物能够多途径调节疾病的信号通路,同时作用于复杂疾病的多种细胞信号分子,提高治疗效果[2-3]。目前,临床上采用多药多靶点药物即“鸡尾酒”疗法(HAART)治疗AIDS。但多药联用毒副作用更大,容易引起不良反应,患者的依从性较差[1]。加之病毒交叉耐药的产生,影响了HAART的治疗效果,新型抗HIV药物的研发依然紧迫。与多药多靶点药物相比,单药多靶点药物为单一化学实体,药代动力学性质更好掌握,并且能够减少交叉耐药的发生。目前,虽然尚未有HIV单药多靶点抑制剂进入临床研究阶段,但单药多靶点药物已成为抗HIV创新药物的重要思路。
天然产物数量巨大,种类繁多,是研发新药和寻找先导化合物的重要来源。目前,在针对AIDS的天然产物研究中,发现了其中不乏对HIV病毒具有抑制作用的化合物。前期,总结了来源于天然产物的HIV单药多靶点抑制剂,这些抑制剂按照结构可以分为黄酮类、三萜及其苷类、苯丙素类、蛋白和肽类等,其中数量较多是黄酮类化合物,包括:蛇葡萄素(Ampelop sin)、灯盏花乙素(S cutellarin)、黄芩素(B aicalein)等[4]。这些抑制剂大多是针对HIV整合酶(IN)、逆转录酶(RT)和核糖核酸酶 H(RNase H),以作用于IN链转移抑制剂 (INSTI)作用位点和RT非核苷类逆转录酶抑制剂(NNRTI)结合部位的双靶点抑制剂[RT(N NRTI)/IN]居多。因此,天然产物对于HIV RT(NNRTI)/IN双靶点抑制剂的开发具有重要意义。
虚拟筛选[5]是指在计算机上,运用分子模拟技术和CADD方法,寻找与受体具有一定亲和力的小分子化合物,以提升筛选效率,缩短研发周期。选择3-OHHEPT类HIV R T(N NRTI)/IN双靶点抑制剂[6-7]展开研究,构建针对HIV RT(NNRTI)/IN双靶点抑制剂的分子相似性搜索模型,建立NNRTI和RT以及INSTI和IN对接模型[8-10],并基于两种筛选策略分别对TCMD[11]进行虚拟筛选:策略一,先后利用相似性搜索、利平斯基五规则和分子对接对TCMD逐步筛选,根据分子对接的打分高低排序;策略二,前期研究中基于所建的HIV R T(NNRTI)/IN双靶点抑制剂六点药效团模型和利平斯基五规则对TCMD进行筛选,得到数据库TCMD-SearchMD[10],再基于分子对接对TCMD-SearchMD进行筛选,根据打分高低排序。然后,将这两种策略筛选出的小分子化合物进行整理分析,以期从中发现潜在的HIV RT(NNRTI)/IN双靶点抑制剂。
1 材料
1.1 软件 分子模拟与分子设计软件包MOE2009.10[12]和 SYBYL8.1[13]。
1.2 数据库 TCMD2003.1[11],包括9 127个化合物结构及其相关信息;本研究前期对TCMD筛选得到数据库TCMD-SearchMD[10],包括229个化合物结构及其相关信息。
1.3 受体结构 从蛋白数据库(PDB)下载1JLA[14],为RT与HEPT类NNRTITNK-651的复合物晶体结构,实验室基于IN与5ClTEP复合物晶体结构1QS4 构建的理论模型 1QS4(2Mg2+)[15]。
2 方法
2.1 分子相似性搜索模型的构建 本研究分别选择 TNK-651[16]和已知 3-OH HEPT类 HIV RT(NNRTI)/IN双靶点抑制剂[6-7]中活性较高的化合物1、2(见表1)为模板分子,在MOE相似性搜索模块分别设定相似性系数(Tani moto coefficient)为45%、50%和60%,对TCMD进行筛选,比较不同相似性系数命中的化合物,进而确定模板分子和对应的相似性系数。Molecular fingerprinting计算方法设定为MACCS,Force field 为 MMFF94x。
2.2 构建分子对接模型
2.2.1 配体准备 分别将配体分子TNK-651和5ClTEP从1JLA和1Q S4(2Mg2+)中抽提出来,在SYBYL配体结构准备模块(li gand structure preparatio n)对配体分子进行加氢和能量优化。参数Force field选择 Tripos,Method 为 Powell,Termination 为 Gardient 0.001 kcal/(mol·Å),Max Iterations为10 000。
2.2.2 受体准备 受体准备在SYBYL Surflex-Dock蛋白结构准备模块(prepare protein structure)完成,首先将1JLA和1QS4(2Mg2+)配体分子TNK-651和5ClTEP抽提出来,保留A链,删除结晶水,对氨基酸残基进行加氢。然后,分别以1JLA和1QS4(2Mg2+)中配体的坐标为中心生成Protomol即结合口袋,保存结果用于后续研究。
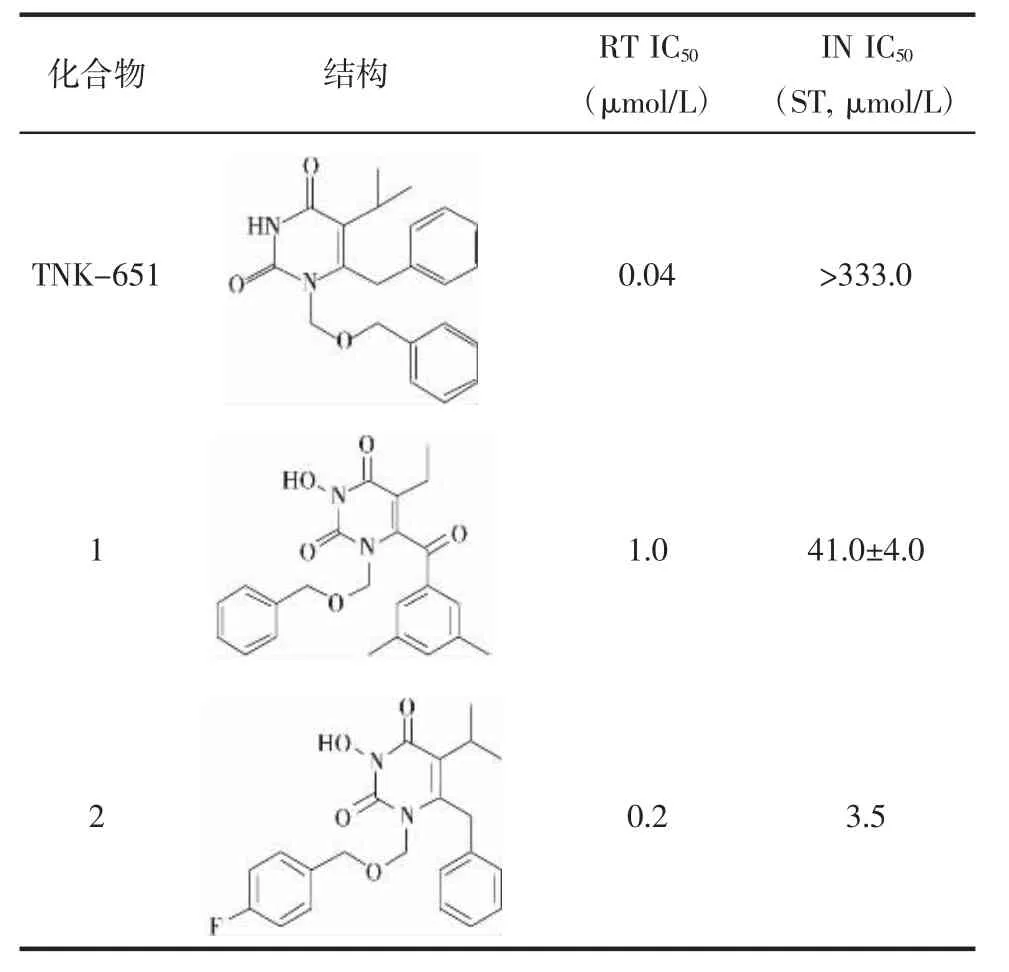
表1 模板化合物的结构及活性数据Tab.1 Structureand activity data of templatecompounds
2.2.3 分子对接 为确定RT和NNRTI以及IN和INSTI最佳对接参数,在SYBYLSurflex-Dock模块,将配体分子TNK-651和5ClTEP分别对接回RT和IN活性位点。选择标准模式对接,设定TNK-651的结晶构象和5ClTEP结合构象为参比分子。调整对接参数设置,使配体分子对接构象最大程度重现复合物结构中配体分子原构象。一般以配体分子对接构象与复合物中结晶构象之间的均方根偏差(RMSD)值作为判断标准,当 RMSD≤2.0Å 时,对接能够较好地重现出原配体分子的空间位置及构象。
2.3 数据库搜索 TCMD库中包含9 127个化合物,为加快筛选速度,提高阳性率,制定两种筛选策略[17]。策略一:(1)运用构建的分子相似性搜索模型对TCMD进行筛选,设定化合物2为模板化合物,相似性系数为50%。(2)利用利平斯基五规则进行类药性分析。(3)将(2)筛选得到的化合物分别与RT和IN活性口袋对接。策略二:将TCMDSearchMD中化合物分别与RT和IN活性口袋对接,对接采用筛选模式,参数设置与上文2.2一致。
3 结果
3.1 分子相似性搜索模板分子和相似性系数 在构建分子相似性搜索模型的过程中,分别以TNK-651和化合物1、2为模板分子,选择相似性系数为60%、50%、45%对TCMD进行搜索,结果显示,比较发现当相似性系数为50%时,命中化合物的数量适中,用于下一步分子对接筛选。而化合物2活性较高,且对RT和IN抑制活性更为均衡。综合考虑,本研究选择以化合物2为模板分子,相似性系数为50%的分子相似性搜索结果用于后续研究。见表2。
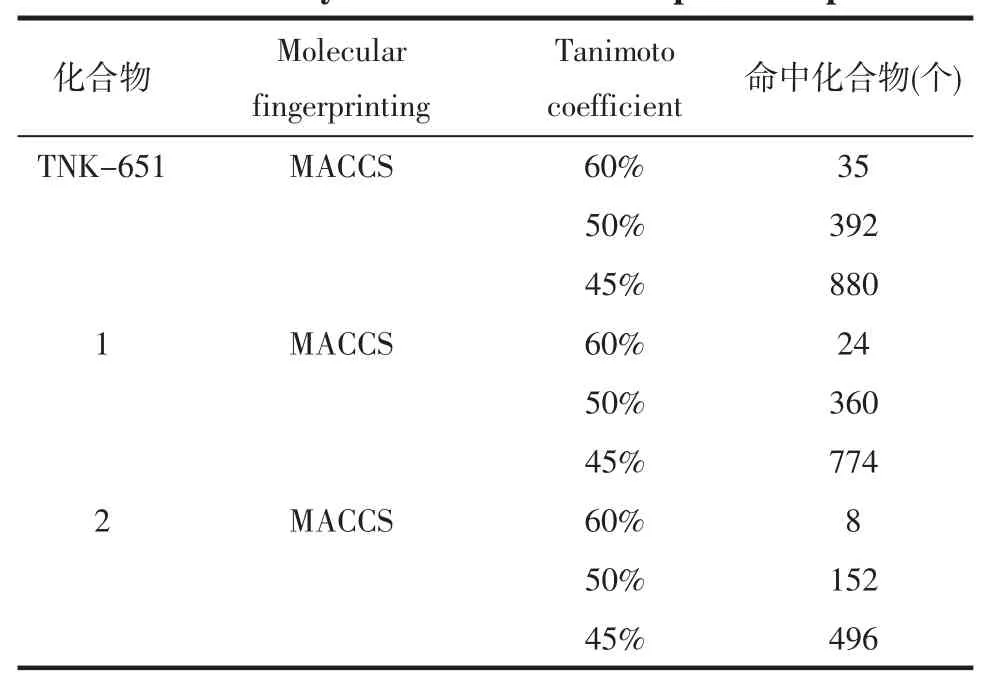
表2 模板分子相似性搜索结果Tab.2 Similarity search results of template compounds
3.2 分子对接模型和参数 本研究分别构建NNRTI和RT活性位点以及INSTI和IN活性位点对接模型,通过调整对接参数,使配体和酶达到最合理的相互作用。结果显示,TNK-651与RT对接得分为10.60,对接构象与1JLA中结晶构象空间距离的RMSD值为0.977Å。5ClTEP与IN对接得分为3.98,对接构象与1QS4(2Mg2+)中原构象空间距离的RMSD值为1.187Å。可以看出,空间距离的RMSD值均在2Å以下,提示对接构象比较完整地重现了配体分子原构象的空间位置,程序适用,参数设置合理。对接参数设置如下:Maxconformationsper Fragment为 20,Minimum RMSD Between Final Poses 为0.05Å,Maximum Number of Poses per Ligand 为 20。
3.3 筛选结果
3.3.1 基于策略一的筛选结果 本研究将相似性搜索命中的152个化合物利用利平斯基五规则筛选,命中100个小分子。100个小分子中51个与IN对接打分大于4,有43个与RT对接打分大于4,与IN和RT对接打分均大于4的有28个。其中,与IN对接打分大于6的有8个,与RT对接打分大于6的有14个,与IN和RT对接打分均在6以上的有7个。见表3。
3.3.2 基于策略二的筛选结果 将TCMDSearchMD中小分子分别与IN和RT进行对接,与IN对接打分在4以上的有158个,与RT对接打分在4以上的有195个,与IN和RT对接打分均大于4的有143个;其中,与IN对接打分在6以上的有47个,与RT对接打分在6以上的有121个,与IN和RT对接打分均大于6的小分子有29个。见表4。

表3 基于策略一筛选命中的HIV RT(NNRTI)/IN双靶点抑制剂Tab.3 Thedoubletarget inhibitor of RT(NNRTI)/IN against HIV based on strategy onescreening hit
3.3.3 综合筛选结果和理论验证 综合筛选结果,除去1个相同的生物碱类化合物M7351,得到35个潜在 HIV R T(N NRTI)/IN双靶点抑制剂,与 RT和IN对接得分均大于6,对抑制剂的结构类型进行总结,包括黄酮类(15个)、生物碱类(8个)、多酚类(3个)、苯丙素类(3个)、苷类(3个)、有机酸类(2个)和醌类(1个),黄酮类化合物占到了42.86%,包括蛇葡萄素、麝香草素、车前子苷等,而策略一对TCMD筛选命中的7个化合物全部为生物碱类。与RT和IN对接结合较好的化合物蛇葡萄素结构如图 1(a)所示,图 1(b,c)为其与 RT 活性位点相互作用2D、3D示意图,可以看出除疏水相互作用外,蛇葡萄素糖环3-OH与Lys101、Lys103之间形成氢键相互作用,糖环1-位苯环与Tyr188之间形成π-π相互作用。观察蛇葡萄素与IN活性位点相互作用[见图 1(d、e)],可以看出其与 IN 之间除存在疏水相互作用和氢键相互作用外,还通过氨基酸残基Asp64和Asp116共同与双Mg2+发生金属离子螯合作用。
4 讨论
不同的筛选方法具有各自的针对性和优缺点,每种方法均有可能漏筛。本研究通过两种策略对TCMD进行筛选,每种策略既可以筛选到相同的化合物,也可以筛选到不同的化合物。采用两种策略,能够相互补充,避免漏筛。TCMD库包含9 127个化合物,本研究首先采用相似性搜索和药效团筛选,接着运用利平斯基五规则分析,得到的小分子分别与RT和IN进行对接,最终保留潜在的HIV RT(NNRTI)/IN双靶点抑制剂。已有研究表明,利用Surflex-Dock程序进行分子对接,打分>4时配体与受体之间存在较强的相互作用,打分>6则可以预测配体对受体的抑制活性达微摩尔级。为加快新药发现的速度和减少不必要的浪费,本研究优先选择与RT和IN对接打分均大于6的化合物进行分析,以确定率先展开实验研究的化合物。从数量上看,命中的黄酮类化合物占到了42.86%,是开发潜在HIV RT(NNRTI)/IN双靶点抑制剂的主要来源,与文献报道天然产物中HIV RT(NNRTI)/IN双靶点抑制剂中黄酮类化合物居多一致。
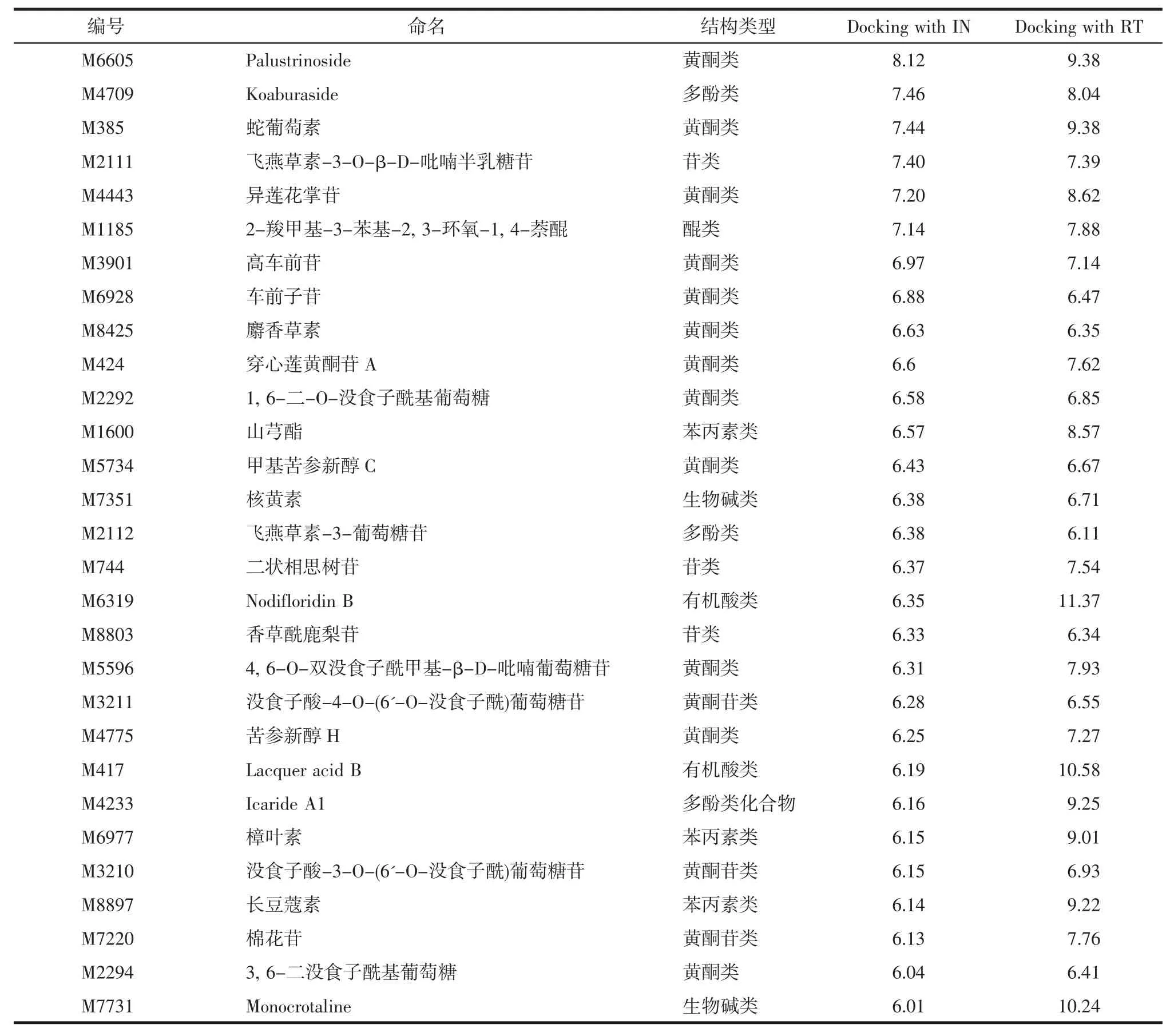
表4 基于策略二筛选命中的HIV RT(NNRTI)/IN双靶点抑制剂Tab.4 Doubletarget inhibitor of RT(NNRTI)/IN against HIV based on strategy two screening hit
本研究的筛选结果与其他研究者实验研究也有契合点,如实验表明杜仲提取物能够抑制HIVgp41六螺旋结构的形成,是潜在的HIV抑制剂[18],本研究筛选得到来源于杜仲的酚类化合物Koaburaside,Koaburaside具有潜在的HIV RT和IN抑制活性,可能是杜仲提取物抗HIV的物质基础。苦参中的黄酮类化合物苦参新醇H(K ushenol H)具有弱抗单纯性疱疹病毒HSV-1和HSV-2活性[19],本研究筛选结果显示其与HIV RT和IN对接打分均大于6,预测对RT和IN抑制活性在微摩尔级。此外,化合物蛇葡萄素能抑制HIV的感染,还能干扰HIV对CD4+细胞的黏附[20],本研究对接结果表明蛇葡萄素与RT和IN结合较好,并与活性位点之间形成了关键相互作用,表明其可能是通过作用于HIV RT和IN,发挥抗HIV活性。
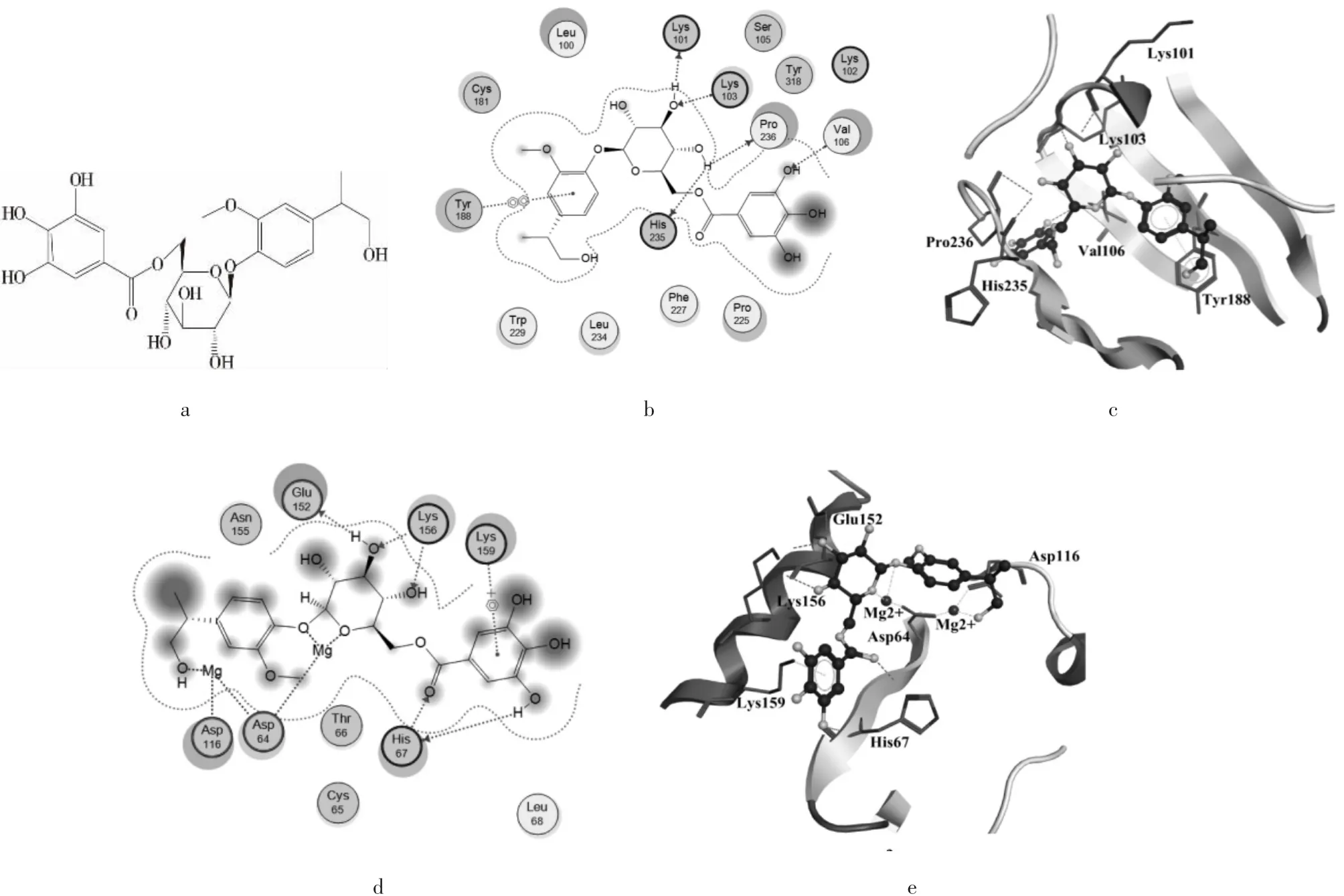
图1 蛇葡萄素结构式(a);与RT相互作用2D图(b);与RT相互作用3D图(c);与IN相互作用2D图(d);与IN相互作用3D图(e)Fig.1 Structure of Ampelopsin(a);2D diagram of the interaction of Ampelopsin with RT(b);3D diagram of the interaction of Ampelopsin with RT(c);2D diagram of the interaction of Ampelopsin with IN(d);3D diagram of the interaction of Ampelopsin with IN(e)
综上,本研究运用分子模拟技术和CADD方法构建了针对TCMD的虚拟筛选模型和策略,检出35个潜在的HIV R T(NNRTI)/IN双靶点抑制剂,为天然产物来源的HIV双靶点药物研发提供了理论基础和发展方向。
参考文献:
[1]Obermeier M,Ehret R,Wienbreyer A,et al.Resistance remains a problem in treatment failure[J].Journal of the International AIDS Society,2014,17(4):161-162.
[2] 李爱秀.多靶点药物的研究及筛选策略的提出[J].武警后勤学院学报:医学版,2013,22(11):1030-1034.
[3] 展 鹏,刘新泳,李 潇,等.抗艾滋病药物设计新策略:多靶点及多价态结合配体[J].中国药物化学杂志,2013,23(5):406-416.
[4] 李 凯,李爱秀,靳玉瑞,等.天然产物来源的抗HIV-1多靶点抑制剂研究进展[J].中草药,2015,46(12):1840-1848.
[5] 叶德泳.药物设计学[M].北京:高等教育出版社,2015:8.
[6]Tang J,Maddali K,Dreis CD,et al.6-Benzoyl-3-hydroxypyrimidine-2,4-diones as Dual Inhibitors of HIV Reverse Transcriptase and Integrase[J].Bioorganic&Medicinal Chemistry Letters,2011,21(8):2400-2402.
[7]Tang J,Maddali K,Dreis CD,et al.N-3 nydroxylation of pyrimidine-2,4-diones yields dual inhibitors of HIV reverse transcriptase and integrase[J].Acs Medicinal Chemistry Letters,2011,2(1):63-67.
[8] Islam MA,Pillay TS.Exploration of the structural requirements of HIV-proteaseinhibitorsusingpharmacophore,virtual screeningand molecular docking approaches for lead identification[J].Journal of Molecular Graphics&Modelling,2015,56(2):20-30.
[9]Wu KZ,Li AX,Liu XT,et al.Building the pharmacophore model of HIV-1 integrase strand transfer inhibitors and studying their inhibition mechanism[J].Chinese Journal of Chemistry,2010,29(4):575-581.
[10]肖泽云,李 凯,李爱秀,等.新型HIV逆转录酶和整合酶双靶点抑制剂的虚拟筛选[J].中国医药导报,2017,14(27):4-7.
[11]周家驹,谢桂荣,严新建.中药原植物化学成分手册[M].北京:化学工业出版社,2004:9.
[12]朱瑞新.计算机辅助药物设计:基本方法原理概要与实践详解[M].大连:大连理工大学出版社,2011.
[13]Belekar V,Shah A,Garg P.High-throughput virtual screening of phloroglucinol derivatives against HIV-reverse transcriptase[J].Molecular Diversity,2013,17(1):97-110.
[14]Ren J,Nichols C,Bird L,et al.Structural mechanisms of drug resistance for mutations at codons 181 and 188 in HIV-1 reverse transcriptaseand theimproved resilience of second generation nonnucleosideinhibitors[J].Journal of Molecular Biology,2001,312(4):795-805.
[15]吴可柱,李爱秀,缪有盼,等.HIV-1整合酶四聚体结构模拟及其活性位点分析[J].中国生物化学与分子生物学报,2009,25(6):549-555.
[16]孟 歌,陈芬儿.HEPT类HIV-1逆转录酶抑制剂的研究进展[J].中国药物化学杂志,2004,14(1):56-64.
[17]Distinto S,Esposito F,Kirchmair J,et al.Identification of HIV-1 reverse transcriptase dual inhibitors by a combined shape-,2D-fingerprint-and pharmacophore-based virtualscreeningapproach[J].European Journal of Medicinal Chemistry,2012,50(50):216-229.
[18]吕 琳,孙燕荣,徐 伟,等.杜仲提取物抗HIV活性成分的分离鉴定[J].中药材,2008,31(6):847-850.
[19]Woo ER,Hwak JH,Kim HJ,et al.A new prenylated flavonol from therootsof Sophoraflavescens[J].Journal of Natural Products,1998,61(12):1552-1554.
[20]Liu DY,Ye JT,Yang WH,et al.Ampelopsin,a small molecule inhibitor of HIV-1 infection targeting HIV entry[J].Biomedical and Environmental Sciences,2004,17(2):153-164.
