重组体pshRNA-dnmt1对肝癌细胞dnmt1基因表达的抑制作用
2018-05-17徐晓容
傅 敏 徐晓容*
(重庆市中医院,重庆 400011)
目前认为DNA甲基化与肿瘤的发生、发展密切相关,而在基因组DNA甲基化过程中DNA 甲基转移酶(dnmt)发挥的作用十分重要。研究表明,dnmt1对成人细胞基因组 DNA 甲基化的维护起关键作用[1]。dnmt1在正常人细胞中的表达很低,而在肝癌、胃癌等多种肿瘤中却表达过度,这提示dnmt1可能成为肿瘤治疗的一个新靶点。为此,本文拟将靶向dnmt1的shRNA干扰重组体转染到肝癌细胞株SMMC-7721,观察其对细胞中dnmt1基因表达的抑制作用,以为肝癌的发生机制及基因治疗提供参考。
1 材料与方法
1.1 材料与试剂:人肝癌细胞株SMCC-7721及大肠杆菌Jm109为重庆医科大学病毒性肝炎研究所保存。质粒pTZU6+1来自美国。限制性内切酶包括HindⅢ、EcoRI、SalI、XbalI等,均购自罗氏;使用TaKaRa生产的T4 DNA连接酶;质粒提取使用Promega生产的质粒提取试剂盒;DNA纯化使用上海生工生物生产的DNA纯化试剂盒;去内毒素质粒提取试剂盒来自QIAGEN0;转染试剂Lipofectamine 2000(Invitrogen);DNA片段(北方同正生物);Total RNA Kits、OneStep RT-PCR Kit试剂盒(QIAGEN);HRP标记的羊抗兔IgG(二抗)(北京中山生物);胎牛血清、新生小牛血清(Hyclone);兔抗人DNMT1多抗(Santa Crutz);化学显色试剂(PIERCE);其余生化试剂均系国内公司产品。
1.2 方法:根据shRNA的设计原则、载体pTZU6+1的酶切位点及GenBank中dnmt1的编码序列(No NM001379),合成针对dnmt1编码区126~144 bp为靶向的DNA片段。 shRNA的核苷酸序列如下:正义链 :5-TCGAGCAGGCGGCT CAAAGAT TTGTTCGCAAATC TTTGAGCCGCCTGCTTTTT-3',带有XhoI的酶切位点。反义链:5-CTAGAAAAAGCAGGCGGCTCAAAGATTTGCG AACA AATCT TT GAGCCGCCTGC-3',带有 XbaⅠ的酶切位点。将合成的DNA片段退火形成双链DNA,构建重组体pshRNA-dnmt1,按试剂盒说明书应用QIAGEBN EndoFreeTM Plasmid Maxi Kit提取重组质粒pshRNA-dnmt1。转染过程按Invitrogen转染试剂盒说明书操作。按以下分组进行转染实验:空白对照组(予脂质体)、空白载体对照组(予pTZU6+1)和实验组(予pshRNA-dnmt1)。
1.3 RT-PCR法:将转染前、转染后24 h、48 h、72 h的各组细胞用胰酶消化,PBS洗3次后离心收集细胞,按Total RNA Kits试剂盒说明提取总RNA。按照OneStep RT-PCR Kit 试剂盒说明进行RT-PCR,RT-PCR反应体系中加入两对引物:dnmt1基因引物:正义链5'-TGCAGAAGG ATGGAACGGAG-3',反义链5'-GCTTTTCCTTGTAATCCTGG-3'(640 bp)。β-actin基因引物:正义链5'-TGGCACCACACCTTCTACAA-3',反义链5'-GCAGCTCGTAGCTCTTC TCC-3'(472 bp)。反应条件:94 ℃ 30 s;60 ℃ 30 s;72 ℃ 50 s;72 ℃ 10 min,共30个循环。反应结束后行琼脂糖凝胶电泳,使用ImageMaster TotalLab仪器分析β-actin和dnmt1基因扩增条带的灰度值。根据β-actin基因片段条带的强弱判断模板的量,进而判断肝癌SMMC-7721细胞株内dnmt1 mRNA被沉寂的程度。
1.4 Western blot法:同上文将转染前和转染后24 h、48 h和72 h的各组细胞消化、处理后,每管沉淀加60 μL蛋白上样Buffer煮沸5 min,混匀,-20 ℃保存备用。根据《分子克隆》实验操作指南进行Western Blot杂交。然后加入化学发光试剂显影显影、曝光,使用Syngene Bio Imaging检测dnmt1蛋白的表达。抑制率 = (未转染组-转染组) /未转染组 ×100%。
2 结 果
2.1 重组质粒pshRNA-dnmt1的构建和鉴定:重组质粒pshRNA-dnmt1的构建和鉴定部分结果已发表于《重庆医科大学学报》[2]。
2.2 肝癌SMMC-7721细胞株中dnmt1基因mRNA水平:5组泳道中细胞内源β-actin基因扩增片段条带的亮度相近,说明RT-PCR中加入模板的量无差异,而dnmt1 PCR扩增带亮度有明显差异,与空白对照组和空白载体对照组相比,实验组亮度明显减弱(图1)。以空白对照组中dnmt1 PCR扩增条带为标准(亮度100),空白载体对照组的亮度是空白对照组的98.8%,实验组转染后24 h、48 h、72 h的亮度分别是空白对照组的58.4%、37.0%和15.9%,重组体pshRNA-dnmt1对肝癌细胞dnmt1基因的抑制率分别为41.6%、63.0%、84.1%。
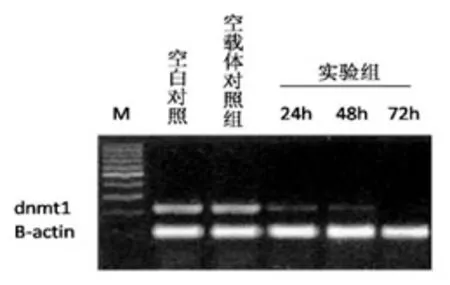
图1 琼脂糖凝胶电泳结果
2.3 肝癌SMMC-7721细胞株中dnmt1蛋白的表达:5组参照 β-actin蛋白的表达相近,而与空白对照组和空白载体对照组相比,实验组dnmt1蛋白杂交带明显减弱(图2)。空白载体对照组的亮度是空白对照组的99.1%,实验组转染后24 h、48 h、72 h的亮度分别是空白对照组的51.8%、31.5%和18.5%,重组体pshRNA-dnmt1对肝癌细胞dnmt1蛋白的抑制率分别为48.2%、68.5%、81.5%。
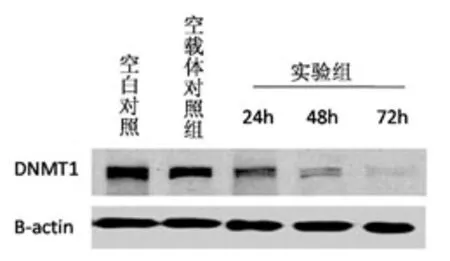
图2 Western blot检测结果
3 讨 论
正常情况下,基因启动子区的CpG岛是处于非甲基化状态,而在甲基化后则会造成基因转录沉默,从而导致DNA 修复基因、抑癌基因等基因失去正常功能,使细胞生长分化及 DNA 损伤修复出现异常。Dnmt直接参与了基因组DNA甲基化的过程,并能通过抑制抑癌蛋白表达、促进癌蛋白表达来参与肿瘤的发生发展。Dnmt1与肝癌的关系密切,肝癌组织中的dnmt1 蛋白显著表达,并与患者的恶性病理特征及预后密切有关。
目前dnmt1 基因已成为人们十分关注的一个肿瘤基因治疗的靶点,也许可以通过抑制其表达而使一些因启动子区域高甲基化而沉寂的抑癌基因重新活化和表达,从而达到肿瘤治疗的目的。本研究结果显示重组体pshRNA-dnmt1转染到人肝癌细胞株SMMC-7721细胞后,细胞内dnmt1基因的mRNA水平明显下降,转染后24 h、48 h、72 h分别为41.6%、63.0%、84.1%;同时细胞内dnmt1蛋白表达明显下降,抑制率分别为48.2%、68.5%、81.5%,提示重组体pshRNA-dnmt1能有效地、特异地抑制肝癌细胞内dnmt1基因的表达,有望成为肝癌治疗的靶点。
本次体外研究初步证实了重组体pshRNA-dnmt1能明显抑制肝癌SMMC-7721细胞株内dnmt1基因的表达,但研究dnmt1基因功能及肝癌的基因治疗是一项浩大的工程,仍有很多问题尚待解决,如:dnmt1基因对肝癌细胞增殖、凋亡的影响以及是通过何种信号传导通路实现的;重组体pshRNA-dnmt1对正常细胞是否也有影响;体内试验及体内毒理学等。
参考文献
[1] 王勇,狄镇海.肝癌DNA甲基化的研究进展[J].医学综述,2011,17(22):3404-3406.
[2] 陈道荣,王丕龙,黄爱龙.DNMT1靶向RNA干扰重组体的构建及序列分析[J].重庆医科大学学报,2004,29(3):269-272.
