云南松种内杂交组合的球果和种子表型性状变异分析
2018-05-16谷丽萍李思广郑畹郑科常恩福李娅车凤仙邓彭荣
谷丽萍,李思广,郑畹,郑科,常恩福,李娅,车凤仙,邓彭荣
(1.云南省林业科学院,云南 昆明650201;2.弥渡县林业局,云南 弥渡 675600)
云南松(Pinusyunnanensis)是西南地区重要的用材和采脂树种[1],同时也是国家储备林基地建设树种之一,其在区域生态建设和经济发展中发挥重要的作用。云南松具有生长适应性强、耐瘠薄等优点[2],是云南省分布最广的优良乡土树种。2014-2016年开展的“云南省第四次森林资源调查”(简称二类资源调查)数据显示,云南省现有云南松面积548.83×104hm2、蓄积3.96×108m3。
截至目前,对云南松自然地理分布、育苗、生理反应、种子园建设、地理种源试验、群落结构、非木材资源开发利用[3-7]等方面都有很多研究报道,但对其表型遗传变异方面的研究较少,尤其关于云南松种内杂交组合的球果和种子表型性状变异研究尚未见到相关报道。本研究通过对云南松种内38个杂交组合的球果和种子表型性状指标变异进行测定分析,探究球果和种子表型性状变异的一般规律,以期为云南松优良种质资源开发利用及良种选育提供科学依据。
1 材料与方法
1.1 研究地自然概况
研究地位于云南省大理州弥渡县国家云南松良种基地(24°47′-25°32′N,100°19′-100°47′E),海拔1 900-2 000m,地貌为中山山地,自然坡度5°-25°。母岩为玄武岩,土壤为山地红壤,土层厚度50-100cm,黑土层厚度15-30cm,土壤为轻、中壤类型,土壤结构良好,较为疏松,pH值6.0。该地属暖温带气候类型,年均气温16.2℃,极端最高气温34.5℃,极端最低气温-6.8℃,≥10℃活动积温5 973.1℃,年降雨量752mm,且多集中于6-10月,年平均相对湿度70%,年无霜期244d,适宜云南松生长。
1.2 试验材料
试验材料来源于弥渡县国家云南松种子园,于2014年3月按照“套袋-授粉-去袋”程序,进行严格的人工控制杂交授粉,选择生长量高、结种能力强、不同母本的云南松与生长量高、无病虫害、通直度高、花粉生产多的不同父本进行种内杂交,1个父本与母本杂交即为1个组合,共计38个组合,每个组合选择5株树进行重复杂交试验,于2016年1月按照杂交组合分别采集其球果,测定球果性状后进行晾干,加工出种子,备用。
1.3 球果与种子表型性状测定
对采集的云南松不同杂交组合的球果及其加工好的种子各表型性状进行测定。从每个杂交组合选取5个发育良好的杂交球果,分别测定其单果重、球果纵径、球果横径、种翅长和种翅宽,并随机选取100粒种子称重量,重复3次,换算成千粒重。果形指数=球果纵径/横径。
1.4 数据分析与处理
利用 Excel 2003按照不同杂交组合和杂交组合类别分别计算球果和种子表型性状的平均值、标准差和变异系数,采用SPSS 17.0分析软件对杂交球果和种子表型性状调查测定数据进行方差分析、多重比较和相关分析。
2 结果与分析
2.1 不同杂交组合的球果和种子表型性状变异比较
云南松38个杂交组合的球果和种子表型性状的测量数据统计、分析结果见表1。由表1可知,不同杂交组合在球果和种子性状及变异系数方面存在差异。其中球果表型性状:单果重、纵径、横径和果形指数平均值分别为48.36±16.01(g)、71.14±9.82(cm)、38.18±4.16(cm)、1.87±0.19,变幅分别为16.60-100.10g、51.80-105.90cm、29.10-52.00cm、1.11-2.29;其对应的变异系数由大到小依次为单果重(33.10%)>纵径(13.81%)>横径(10.89%)>果形指数(9.98%)。表明不同杂交组合间球果单果重存在较大变异,球果质量性状变异大于球果形态性状变异,同时球果纵径变异略大于横径变异。
在种子表型性状方面,千粒重、种翅长、种翅宽平均值依次为18.03±3.80(g)、19.60±2.40(mm)、6.56±0.88(mm),变幅为6.00-27.95g、12.10-26.70mm、4.20-9.00mm;相应的变异系数表现为千粒重(21.06%)>种翅宽(13.48%)>种翅长(12.40%)。表明云南松不同杂交组合的千粒重存在较大变异;相比较千粒重变异,种翅变异则相对稳定。
将杂交组合的球果表型性状和种子表型性状综合来看,发现除果形指数外,球果的单果重、纵径和横径的均值变幅均大于种子各表型性状均值变幅,由此说明种子表型性状更趋于稳定,而球果性状相对存在着更加广泛的遗传变异,对裸子植物而言,球果是种子生产非常重要的器官[8],这就为云南松的选择育种提供了有利条件。
云南松种内杂交组合间球果和种子表型性状方差分析见表2。从表2可知,杂交组合间的球果和种子表型性状差异达极显著水平。

表1 云南松38个杂交组合间球果和种子性状变异状况Tab.1 Variation of cone and seed traits among 38 hybrid combinations in Pinus yunnanensis
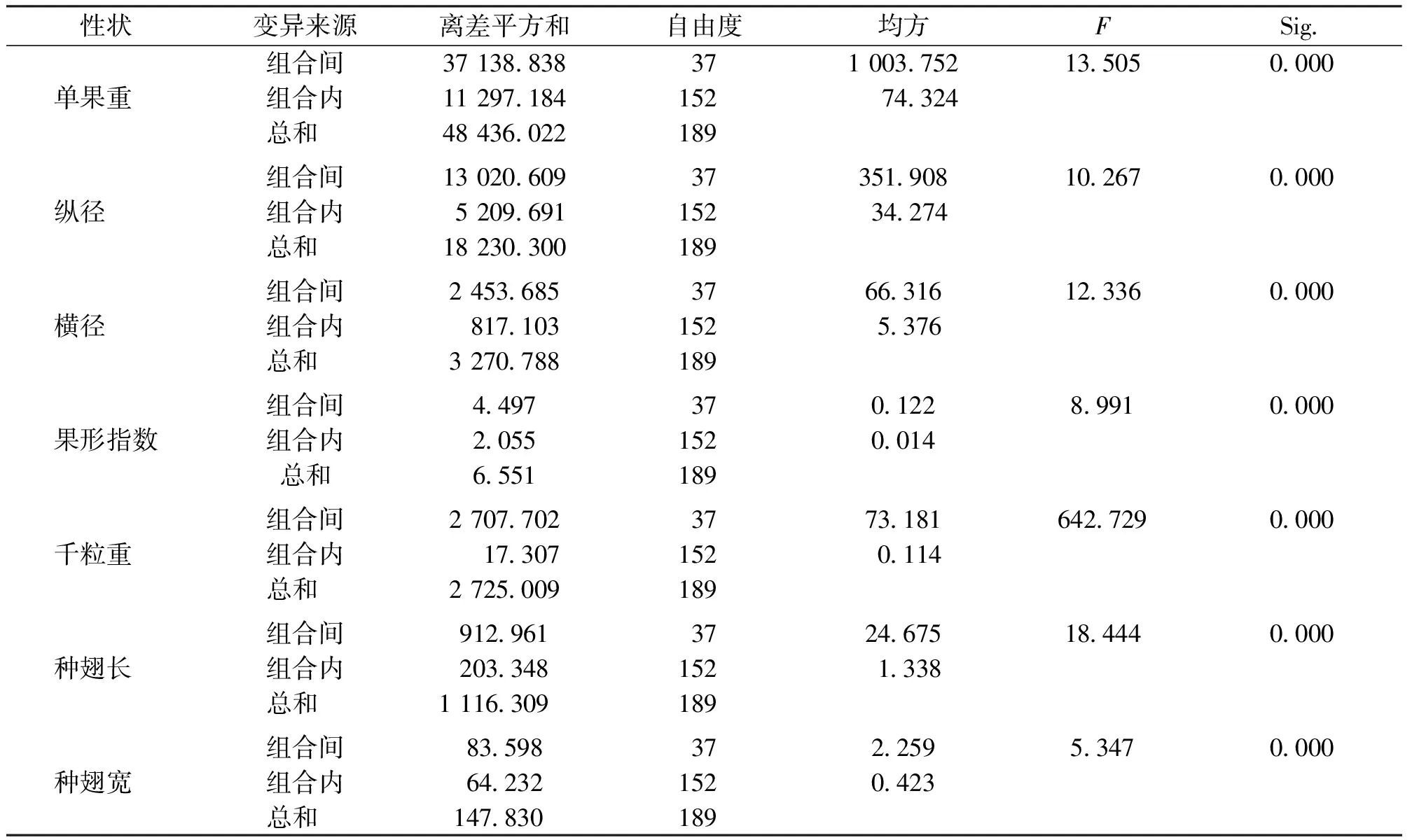
表2 杂交组合间球果和种子表型性状方差分析表Tab.2 Variation analysis of cone and seed traits between hybrid combinations in Pinus yunnanensis
2.2 38个杂交组合不同类别的球果和种子表型性状变异比较
将云南松38个杂交组合按照相同母本进行归类,分为14个杂交组合类别,各类别球果和种子表型性状的数据统计分析结果见表3和表4。由表3可知,云南松38个杂交组合的不同类别在球果性状及变异系数方面均存在差异。单果重、纵径、横径和果形指数平均值分别为52.91±15.91(g)、72.16±7.62(cm)、39.05±3.77(cm)、1.85±0.13,变幅分别为30.02-90.86g、60.39-84.60cm、34.12-47.64cm、1.67-2.13;其相应的变异系数由大到小依次为单果重(30.07%)>纵径(10.56%)>横径(9.65%)>果形指数(7.07%)。表明云南松球果质量性状在不同母本杂交组合的类别间存在较大变异;相对于球果质量性状,球果形态性状更趋于稳定。

表3 云南松14个不同杂交组合类别的球果性状LSD多重比较Tab.3 Multi-comparison of cone traits LSD in 14 different hybridized combinations of Pinus yunnanensis

表4 云南松14个不同杂交组合类别的种子性状LSD多重比较Tab.4 Multiple comparison of seed traits LSD in 14 different hybrid combinations of Pinus yunnanensis
将球果各表型性状均值进行方差分析,结果表明各类别间不同性状差异达极显著水平;进一步进行多重比较,得出,单果重表现在第1类别、3类别、5类别均与第9类别、10类别、12类别、13类别、14类别间存在显著差异;第2类别与第6类别、8类别、9类别、11类别、12类别间存在显著差异;第4类别、7类别均与第8类别、9类别、10类别、12类别、13类别间存在显著差异;第6类别、8类别、11类别均与第9类别、10类别、13类别、14类别间存在显著差异;第9类别与第10类别、11类别、12类别、13类别、14类别间存在显著差异;第10类别、13类别均与第11类别、12类别存在显著差异;第12类别与第14类别存在显著差异。
球果纵径表现在第1类别、9类别均与第3类别、4类别、5类别、8类别、11类别、12类别间存在显著差异;第2类别、6类别、10类别均与第4类别、8类别、11类别、12类别间存在显著差异;第3类别、4类别、5类别均与第13类别存在显著差异;第7类别与第8类别、11类别、12类别、13类别存在显著差异;第8类别与12类别均与第9类别、10类别、13类别、14类别存在显著差异;第11类别与第13类别、14类别存在显著差异;第13类别与14类别间存在显著差异。
球果横径表现在第1类别与第9类别、12类别、13类别间存在显著差异;第2类别与第6类别、9类别、11类别、12类别间存在显著差异;第3类别、4类别、5类别、7类别、8类别均与第9类别、13类别存在显著差异;第6类别、11类别均与第9类别、10类别、13类别、14类别存在显著差异;第9类别与第10类别、12类别、13类别、14类别均存在显著差异;第10类别与第12类别存在显著差异;第12类别与第13类别、14类别存在显著差异。
果形指数则表现为第1类别与第6类别差异不显著,与其他类别均存在显著差异;第2类别、5类别、7类别、13类别与第8类别、9类别存在差异显著;第3类别、4类别、11类别、12类别、14类别只与第1类别、6类别存在显著差异;第9类别与10类别间存在显著差异。
种子性状方面,由表4可知,千粒重、种翅长、种翅宽平均值依次为17.56±2.47(g)、19.83±2.07(mm)、6.59±0.70(mm),变幅为13.03-20.65(g)、16.26-23.47(mm)、5.44-7.96(mm);相应的变异系数表现为千粒重(14.06%)>种翅宽(10.57%)>种翅长(10.44%),说明不同母本杂交种的千粒重存在较大变异,而种翅变异相对稳定。将种子各表型性状均值进行多重比较,得出,千粒重表现在第1类别、2类别、3类别、7类别、9类别、13类别均与第11类别、12类别间存在显著差异;第5类别、10类别与第12类别存在显著差异。种翅长表现在第1类别、3类别、6类别、8类别、9类别、11类别、12类别均与第4类别、5类别、7类别、10类别、14类别间存在显著差异;第2类别与第5类别、7类别、10类别、13类别存在显著差异;第4类别、5类别、14类别均与第7类别、10类别、13类别存在显著差异。种翅宽表现在第1类别、5类别均与第9类别、12类别间存在显著差异;第2类别与第6类别、9类别、12类别存在显著差异;第3类别、4类别均与第9类别、12类别存在显著差异;第6类别与第8类别、9类别、10类别、11类别、12类别存在显著差异;第7类别与第8类别、9类别、10类别、13类别存在显著差异;第8类别、13类别均与第12类别存在显著差异;第9类别、10类别均与第12类别、14类别存在显著差异;第11类别与12类别存在显著差异。
同时,相比较单个杂交组合,不同母本的杂交组合类别无论球果性状,还是种子性状,其遗传变异均小于单个杂交组合的变异,由此说明,在单个杂交组合中球果和种子性状均存在较为丰富的变异,不同杂交组合间父母本的异质性增强了表型变异的差异,这为云南松进行定向育种提供了很大空间。
2.3 不同杂交组合云南松球果与种子表型性状相关性分析
将云南松38个不同杂交组合的球果与种子表型性状进行双变量相关分析(表5)。

表5 云南松球果与种子性状相关性分析Tab.5 Correlation analysis of cone and seed traits in Pinus yunnanensis
由表5可知,球果单果重与纵径、横径、千粒重呈极显著正相关(Pearson相关系数依次为0.70**、0.78**、0.43**),单果重与种翅宽呈显著正相关(r=0.17*),球果纵径与横径、果形指数、千粒重呈极显著正相关(相关系数分别为0.68**、0.63**、0.42**),横径与千粒重、种翅宽呈极显著正相关(相关系数分别为0.42**和0.28**),果形指数与种翅宽呈极显著负相关(r=-0.37**),千粒重与种翅宽呈显著正相关(r=0.16*)。
3 结论与讨论
云南松在西南地区分布广泛[2]。本研究显示云南松球果和种子表型性状在杂交组合间差异较大,且球果的表型性状变异大于种子的表型性状变异,球果和种子的质量性状变异均大于二者的形态性状变异;其中,尤以球果单果重变异系数达到33.10%。对裸子植物而言,球果是繁育种子重要的器官,同时也是胚分化形成、进行生长发育的营养供体[8]。其丰富的表型变异是云南松作为优良乡土树种适应环境的一种表现,利用这些变异进行优良种质资源选择可行、有效;而且,云南松不同杂交组合间父本、母本的异质性增强了表型变异的差异,这为云南松进行定向育种提供了有利条件。
云南松杂交组合的球果和种子大部分表型性状之间存在显著或极显著相关,研究表明:云南松更大的球果能产生更大的种子,尤其是其种翅变得更大。云南松作为风媒传粉植物,种翅大,种子随风传播的距离就变得更远,即更大的种子将产生更强壮的幼苗和更大的种翅具有更强的扩散能力[9],致使群体间的基因交流就会更频繁,更有利于维持物种生存。云南松如何通过调整球果性状来适应环境、促进种子繁殖更新和生产,是其今后良种繁育深入研究的内容之一。
表型变异是由遗传型和环境因子共同作用的结果,其往往具有适应和进化上的意义[10-11],群体间的多样性变异是种内多样性的重要组成部分[12]。云南松经过长期的自然选择、适应生境以及人工选择,产生广泛的表型变异。其表型变异越大,所蕴藏的遗传变异就越加丰富[13]。本研究从云南松种内杂交组合的球果和种子表型性状上分析其变异规律,这对于云南松优良种质资源的收集、保存和遗传改良具有重要的意义,今后在遗传改良中,应兼顾不同杂交组合类别选择和优良杂交组合选择。
参考文献:
[1]邓喜庆,皇宝林,温庆忠,等.云南松林在云南的分布研究[J].云南大学学报(自然科学版),2013,35(6):843-848.
[2]谷丽萍,郑畹,李思广,等.云南松不同组合杂交种苗期生长分析[J].西部林业科学,2016,45(3):96-103.
[3]云南松编写委员会,金振洲,彭鉴.云南松[M].昆明:云南科技出版社,2004:4-13.
[4]段旭,赵洋毅.云南松扦插繁殖技术试验[J].种子,2015,34(1):114-116.
[5]郭樑,李莲芳,孙昂,等.水分对云南松苗木生长的影响[J].种子,2014,33(6):64-68.
[6]蔡年辉,李根前,朱存福,等.云南松人工林与天然林群落结构的比较研究[J].西北林学院学报,2007,22(2):1-4.
[7]邱坚.云南松松花粉饮料的研制[J].西南林学院学报,2002,22(3):57-59.
[8]王庆华,刘永刚,沈立新,等.秃杉球果形态的变异研究[J].西部林业科学,2013,42(5): 47-52.
[9]Gil L,Climent J,Nanos N,etal.Cone morphology variation inPinuscanariensisSm[J].Plant Systematics and Evolution,2002,235:35-51.
[10]Chavez A S,Saltzberg C J,Kenagy G J.Genetic and phenotypic variation across a hybrid zone between ecologically divergent tree squirrels(Tamiasciurus)[J].Molecular Ecology,2001,20(6):3350-3366.
[11]曾杰,郑海水,甘四明,等.广西西南桦天然居群的表型变异[J].林业科学,2005,41(2):59-65.
[12]Fuchs E J,Hamrick J L.Genetic diversity in the endangered tropical tree,Guaiacumsanctum(Zygophyllaceae) [J].Journal of Heredily,2010,101(3):284-291.
[13]吴开志,肖千文,贾瑞芬,等.油橄榄品种表型性状的多样性[J].经济林研究,2008,26(2):48-52.
