绿茶提取物对口腔鳞癌模型大鼠抗肿瘤组织中EphA2、EphrinA1 和E-cadherin表达的影响
2018-05-16高路
高 路
辽宁中医药大学门诊部,辽宁 沈阳 110035
绿茶提取物(green tea extract,GTE)是一种从绿茶叶片中提取的活性成分,主要含有茶多酚(儿茶素)等活性物质,临床应用具有抗氧化、清除自由基、杀菌解毒、解酒保肝等作用[1]。现代研究证实[2],绿茶提取物中的茶多酚能够抑制肿瘤细胞DNA合成,促使突变DNA断裂,阻止肿瘤细胞的合成,从而抑制肿瘤的生长及增殖。口腔癌是一种威胁人类健康的恶性肿瘤疾病,其中大部分属于口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC),患者口腔出现黏膜白斑、表面粗糙[3],随着疾病的进展,可转化为乳头状或溃疡型[4],或混合出现。其中早期的口腔鳞癌即出现癌细胞对周围组织的浸润与扩散或者远端转移[5],临床治疗相对困难且预后差,严重威胁患者的生命健康。现代研究显示,绿茶提取物能够抑制口腔鳞癌细胞株的增殖作用,并影响其细胞周期[6]。因此本文利用口腔鳞癌模型大鼠,探究绿茶提取物对口腔鳞癌模型大鼠抗肿瘤组织中EphA2、EphrinA1和E-cadherin表达影响,探讨绿茶提取物对口腔鳞癌的作用机制。
1 材料与方法
1.1 材料 4-硝基喹啉-1-氧化物(4-NQO)(规格:1 g,上海子起生物科技有限公司,批号:Z26147501)绿茶提取物(规格:5 g,上海远慕生物科技有限公司有限公司,批号:20150829)本品采用溶剂提取法获取,并将绿茶提取物溶于备好的蒸馏水内,配置为浓度10 mg/mL的溶液,常温下涡旋1分钟,置于37℃进行孵育,1小时后进行离心,5 000 r/min,离心时间为10分钟,取上清液,除去未溶解物质,采用过滤器对上清液进行过滤,培养基稀释至浓度为100 μg/mL;Phospho-EphA2(Tyr594)磷酸化酪氨酸蛋白激酶A2受体抗体(上海乔羽生物科技有限公司);Ephrina1内皮细胞受体蛋白酪氨酸激酶A抗体(肿瘤坏死因子α诱导蛋白4)(上海乔羽生物科技有限公司);E钙黏着蛋白/上皮性钙黏附蛋白(E-Cad)ELISA试剂盒(上海恪敏生物科技有限公司);LEICA CM1550S冰冻切片机(河北蓝梦生物医药科技有限公司);Butyl-S-QZT 6FF光学显微镜[江苏中科森辉微球(原国家生化中心)];CI-400计算机图像分析系统,北京盈盛恒泰科技有限责任公司。
1.2 方法
1.2.1 实验动物与分组 选择45只健康Wistar大鼠,雌雄各半,均为8周龄,平均体质量(200±20)g,由北京艾德摩生物技术有限公司提供。医动字第19-056号,动物实验许可证号:SYXK(京)2015-0026。将45只大鼠随机分为正常对照组、模型对照组以及绿茶提取物组,每组各15只。分笼饲养,大鼠使用的笼具、饲料以及垫料等均高压消毒,能够正常自由饮食饮水,大鼠应用物品每隔3日消毒一次。适应性喂养7日,实验室温度维持于23℃左右。
1.2.2 模型建立[7]所有大鼠用药前均禁食水10小时。正常对照组正常饲养,模型对照组以及绿茶提取物组给予4-NQO以建立口腔鳞癌的动物模型,2组大鼠给予4-NQO(用无菌蒸馏水配制成0.1%浓度)5 g/L涂于口腔腭黏膜上,每2日涂抹1次,连续涂抹28周,正常对照组不涂抹,给予各组大鼠正常颗粒食物以及充足自来水进行喂养。1.2.3 给药方法 绿茶提取物组于模型建立后开始给予绿茶提取物50 mg混合成10 mL溶液,每日分2次灌胃,给药8周。其余2组给予生理盐水灌胃,剂量与使用频率和绿茶提取物组相同至实验结束。每日喂养全价饲料,自由饮水,保证充足饮水,维持人工排尿3次。
1.2.4 指标观察 研究期间,观察并记录大鼠活动、饮食饮水以及毛色情况,称体质量。8周后,取大鼠上腭部分病变黏膜组织,应用10%的中性甲醛溶液对其进行固定,处理组织,石蜡包埋制备4 μm厚连续切片,梯度酒精进行脱水,柠檬酸抗原修复,以及分数10%H2O2去离子水封闭内源性过氧化物酶,采用免疫组化法检测肿瘤组织EphA2、EphrinA1以及E-cadherin蛋白水平。EphA2以及EphrinA1的阳性染色位于细胞质,呈散在或者密集的棕黄色颗粒;E-cadherin的阳性染色定位于胞质或者细胞核,主要存在于胞质染色,呈散在或者密集的棕黄色颗粒。采用CI-400计算机图像分析系统,于光学显微镜下观察整张切片,寻找染色清晰、阳性细胞分布广的区域,并于每张切片中随机选择 5个不同视野,EphA2、EphrinA1以及E-cadherin蛋白的表达水平为观察所得的在同一光强度下测量阳性信号的平均光密度。
1.3 统计学方法 采用SPSS 19.0统计软件,计量资料以(±s)表示,蛋白水平的表达采用LSD-t检验;计数资料采用率表示,组间比较方法为单因素方差法,采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠情况 实验过程中严格无菌操作,其中正常对照组无大鼠死亡,模型对照组大鼠4只死亡,死亡发生率为26.67%;绿茶提取物组1只死亡,死亡发生率为13.33%。正常对照组大鼠毛色光亮,活动正常,能够正常饮水饮食,平均体质量(203.48±21.63)g;模型对照组大鼠毛色暗哑,活动度显著降低,舌背中部出现灰白色外生性肿物,牙龈、口底、腭部以及唇部等部位均发现类似肿物或溃疡,质地较硬,活动度差,与周围组织粘连,进食困难,平均体质量(167.49±19.19)g;绿茶提取物组造模期间大鼠毛色暗哑,但应用绿茶提取物灌胃后,部分大鼠毛色恢复光亮,症状有所缓解,活动正常,舌背根部至舌尖部仅出现部分白色斑块,饮食饮水正常,平均体质量(22.40±2.29)g。
2.2 各组大鼠 EphA2、EphrinA1及 E-cadherin蛋白表达水平 治疗后,与正常对照组相比,模型对照组以及绿茶提取物组EphA2、EphrinA1平均光密度水平较高(P<0.05),E-cadherin平均光密度水平较低(P<0.05);与模型对照组相比,绿茶提取物组EphA2、EphrinA1平均光密度较低(P<0.05),E-cadherin平均光密度较高(P<0.05)。见表 1、图 1—9。
表1 各组大鼠EphA2、EphrinA1及E-cadherin蛋白表达水平比较(±s)
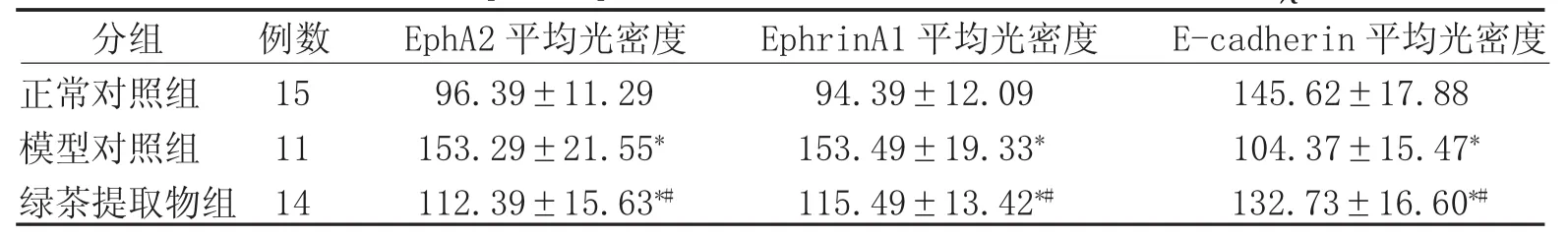
表1 各组大鼠EphA2、EphrinA1及E-cadherin蛋白表达水平比较(±s)
注:*表示与正常对照组比较,P<0.05;#表示与模型对照组比较,P<0.05
?

图1 正常对照组EphA2的表达情况

图2 模型对照组EphA2的表达情况
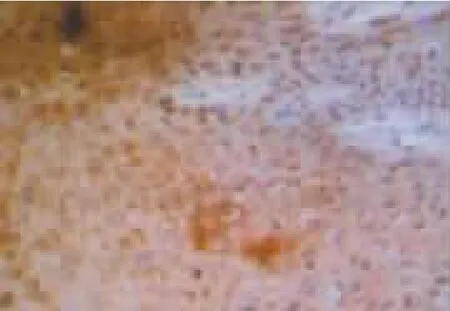
图3 绿茶提取物组EphA2的表达情况

图4 正常对照组EphrinA1的表达情况

图5 模型对照组EphrinA1的表达情况
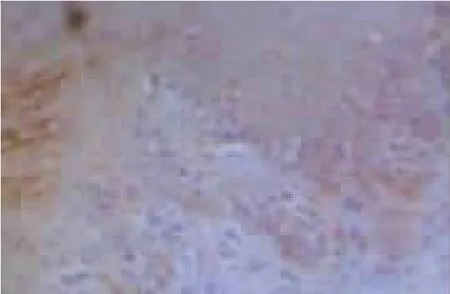
图6 绿茶提取物组EphrinA1的表达情况

图7 正常对照组E-cadherin的表达情况

图8 模型对照组E-cadherin的表达情况
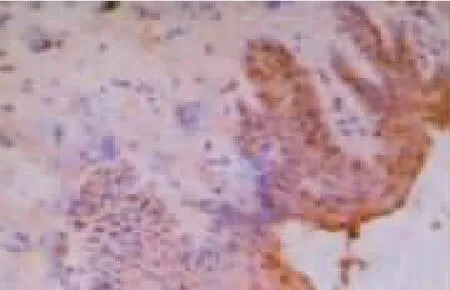
图9 绿茶提取物组E-cadherin的表达情况
3 讨论
OSCC是世界五大常见的恶性肿瘤之一[8],已超过口腔颚面部恶性肿瘤患病总数的80%[9]。患者口腔无明显原因的反复出血、麻木感,本病5年内生存率仅为50%左右[10],本病的发病与日常口腔卫生习惯、不良的口腔黏膜刺激以及吸烟喝酒等不良嗜好具有相关性,且与种族有关。随着临床研究的不断进展,OSCC的治疗水平不断提高,预后明显改善,但是其早期诊断及远期疗效并不理想。又由于OSCC发生隐匿,发展过程缓慢,致病因素较多且发病机制尚未明确,但本病的发病受抑癌及原癌基因表达的影响。GTE是近年来发现的天然抗氧化剂,不仅在抗氧化方面疗效佳,针对肿瘤的治疗也具有显著疗效。刘晓亮等[11]研究发现,绿茶提取物对不同的人口腔鳞癌细胞株通过对细胞周期S期及G2/M期阻滞从而起抗肿瘤效应,预防口腔鳞癌的发生。此外,绿茶提取物能够通过减轻氧化应激损伤[12],从而保护急性肝损伤。
酪氨酸蛋白激酶受体(RTK)是一种跨膜传导信号的主要成分,对细胞的生长、分化以及迁移具有调控作用。Eph受体是RTK中最大的I型跨膜糖蛋白家族成员,与其配体Ephrin具有相互作用,能够促进细胞间的连接以及黏附,使其正常表达。现代研究显示,于正常上皮细胞内EphA2以及EphrinA1相结合,产生自身磷酸化以及降解作用,但两者表达水平较低[13];而在肿瘤细胞内EphA2以及EphrinA1无法结合,细胞间黏附力降低,堆积于肿瘤细胞内,无法降解,表达水平较高[14]。有学者研究发现,EphA2、EphrinA1 随着口腔黏膜的发展水平升高[15]。E-cadherin是细胞间黏附分子,参与EphA2以及EphrinA1的调控,间接调控EphA2的蛋白表达水平。有研究显示,E-cadherin在正常组织中表达水平较高,而随着口腔黏膜组织的恶行性转化其表达水平随之降低[16]。本研究结果表明,治疗后,与正常对照组相比,模型对照组以及绿茶提取物组EphA2、EphrinA1平均光密度水平较高,E-cadherin平均光密度水平较低;与模型对照组相比,绿茶提取物组EphA2、EphrinA1平均光密度较低,E-cadherin平均光密度较高。证实绿茶提取物能够下调癌症组织EphA2、EphrinA1表达水平,上调E-cadherin表达水平,抑制口腔鳞癌的发展。
综上所述,绿茶提取物能够改善口腔鳞癌模型大鼠症状,阻止癌细胞生长,可能与下调癌症组织EphA2、EphrinA1表达水平,上调E-cadherin表达水平有关。
参考文献
[1]谢亮群,乔岩岩,史小林.绿茶提取物对人卵巢癌SKOV3细胞生长抑制作用及作用途径的探讨[J].生殖医学杂志,2010,19(4):342-346.
[2]高彤彤,晏志勇.绿茶提取物茶多酚在化妆品中的抗氧化效果研究[J].中国美容医学,2015,24(24):26-29.
[3]闻梅娟,冯一中.MDM2和p53在口腔黏膜鳞状细胞癌和口腔白斑中的表达[J].河北医学,2014,20(2):213-216.
[4]赵民,刘莹,付秀兰,等.COX-2在口腔扁平苔藓、口腔乳头状瘤及口腔鳞状细胞癌中的表达[J].口腔医学研究,2013,29(2):142-144.
[5]李慧文,黄鹏,李长义.MMP-2和VEGF-CmRNA和蛋白表达改变与口腔癌淋巴转移关系的Meta分析[J].现代口腔医学杂志,2007,21(1):92-94.
[6]刘晓亮,袁长吉,庄平,等.EGCG对口腔鳞癌细胞增殖及信号传导通路的影响[J].华中科技大学学报:医学版,2013,42(5):530-534.
[7]李晶,于大海,卿海云,等.4-NQO饮水法构建Balb/c大鼠口腔癌及淋巴道转移模型[J].广西医科大学学报,2012,29(4):515-518.
[8]王晴萱,刘俊超.具核梭杆菌通过Toll样受体促进口腔鳞状细胞癌发生发展的研究进展[J].中国微生态学杂志,2015,27(12):1471-1473.
[9]叶满军,柳宏志,石晶.葡萄糖转运蛋白1在口腔鳞状细胞癌中的表达及意义[J].中国实验诊断学,2013,17(6):1107-1110.
[10]张世周,郑家伟.台湾地区口腔鳞状细胞癌手术治疗的结果:影响生存率的因素[J].口腔颌面外科杂志,2004,36(2):191-193.
[11]刘晓亮,刘环秋,李季,等.绿茶提取物对口腔鳞癌抗肿瘤效应及作用机制的研究[J].中国中西医结合杂志,2014,34(11):1369-1373.
[12]区锦莹,温嘉莉,刁建新,等.绿茶提取物对四氯化碳致小鼠急性肝损伤的保护作用[J].中药药理与临床,2015,7(5):88-92.
[13]方艳伟,邱文娜,刘力强,等.EphA2/EphrinA1在脑胶质瘤中的表达及临床意义[J].中华实验外科杂志,2014,31(2):318.
[14]徐金升,白亚玲,张俊霞,等.EphrinA1-Fc对人肾透明细胞癌786-O细胞EphA2和ERK表达影响的研究[J].中国肿瘤临床,2013,40(16):956-959.
[15]刘进忠,张沛.大鼠口腔鳞状细胞癌组织中EphA2、EphrinA1和 E-cadherin 的表达[J].郑州大学学报:医学版,2012,47(4):485-487.
[16]徐文华,许春姣,周美璐,等.上皮间质转化相关蛋白在口腔黏膜下纤维化及其癌变组织中的表达[J].临床口腔医学杂志,2016,8(4):109-110.
