SakA对马尔尼菲篮状菌药物应激及致病力的影响
2018-05-16宁心强魏金瑛郑艳青梁浩曹存巍
宁心强 魏金瑛 郑艳青 梁浩 曹存巍
(1.广西医科大学第一附属医院皮肤性病科,南宁 530021;2.广西艾滋病防治研究重点实验室,南宁 530021;3.柳州市中医院,柳州 545001;4.广西医科大学公共卫生学院&生命科学研究院,南宁 530021)
马尔尼菲篮状菌 (Talaromycesmarneffei, TM),原名马尔尼菲青霉菌 (Penicilliummarnef-fei)是温度依赖性双相真菌,在我国广西、广东以及东南亚呈区域性流行[1-2],主要感染免疫低下人群,特别是HIV患者,若得不到有效治疗,病死率极高[3-4]。TM首先侵犯单核吞噬系统。在巨噬细胞内,TM面对温度、渗透压的急剧变化及活性氧的杀伤,如何适应并有效定植对研究其致病性极为关键。研究发现,高渗透性甘油促丝裂原活化蛋白激酶通路 (Hog1-MAPK),参与多种真菌的渗透压、氧化应激以及形态转换等,是影响真菌致病力的因素之一[5-7]。HOG1基因在丝状真菌构巢曲霉等称为SakA(stress-activated kinase)。在对TM的研究发现,SakA(Hog1)在抵御热应激、渗透压及氧化应激中发挥着重要作用[8-10],但目前对该基因在小鼠致病和药物压力的作用研究尚未见报道。因此,我们通过巨噬细胞共培养及感染小鼠模型,探讨SakA在TM侵袭性感染中的作用,比较SakA敲除株和野生株在药物压力下的生长情况,探讨SakA在酵母相对棘白霉素不敏感的机制,为阐明TM的致病性提供生物学依据。
1 实验材料
1.1 实验菌株
T.marneffei2株,1株是由墨尔本大学Alex Andronopolous教授惠赠的野生株FRR2161;另1株是SakA敲除株 (ΔsakA),由原生质体基因转化技术敲除SakA基因获得,具体方法见文献[11]。菌株均经过TM双相性及形态学或分子生物学鉴定,敲除株经Southern blot验证。药敏实验选近平滑念珠菌ATCC22019作为质控株,由北京大学真菌研究中心惠赠。
1.2 实验细胞
小鼠巨噬细胞株RAW264.7由广西医科大学药理学院惠赠。
1.3 抗真菌药物
卡泊芬净 (CPFG),米卡芬净 (MCFG),伊曲康唑 (ITC),伏立康唑 (VOC),氟康唑 (FLC)和两性霉素B (AmB)。以上药物全为原粉,均购于美国sigma公司,其纯度≥99%。
2 实验方法
2.1 菌株活化及菌悬液制备
将FRR和ΔsakA分别接种于SDA培养基25℃培养7 d。各实验菌株在ANM (A.nidulans minimal)培养基上连续转种3次,每次镜下观察菌丝形态。挑取适量菌落置于预装有3 mL灭菌用水的50 mL离心管中,震荡后静置10 min,吸取上清,过滤去除菌丝,用细胞计数板计算孢子悬液浓度,根据实验方案用灭菌用水调整孢子浓度。
2.2 巨噬细胞共培养
准备6孔细胞培养板,每孔接种细胞104cell,每孔加入105孢子 (FRR/ΔsakA),孢子加入前预先予钙荧光白染色10 min,37℃,5%CO2培养箱共培养24 h,荧光显微镜下观察巨噬细胞内孢子形态。另准备6孔细胞培养板,每孔接种细胞105cell,每孔加入106孢子 (FRR/ΔsakA),37℃,5%CO2培养箱共培养2 h,PBS洗去未被吞噬的孢子,继续共培养24 h。弃培养液,冷PBS裂解细胞,裂解物按1∶100稀释后取100 μL于YPD培养皿涂板,25℃培养72 h后计算菌落数。空白对照组不加孢子。
2.3 FKS1和CHS基因的表达
挑取适量菌体分别在25℃和37℃恒温培养摇床震荡培养72 h后,过滤培养液,收集菌丝。采用Trizol法提取真菌RNA,逆转录合成cDNA。采用实时荧光定量PCR (real-time quantitative PCR)测定1,3-β-D葡聚糖和几丁质的编码基因 (FKS1和CHS)表达,benA(beta-tubulin gene)为内参基因。引物序列、反应体系和条件参照Suwunnakorn S所做的研究[12]。利用扩增循环数 (Threshold Cycle, Ct )计算FKS1和CHS基因相对表达量。计算公式:△Ct= Ct目的基因-Ct内参,△△Ct=△Ct实验组-△Ct对照组,相对表达量=2^(-△△Ct)。两组间基因表达差异运用独立样本t检验分析。
2.4 药物敏感实验
制备菌液及药物储存液 菌悬液调整至 (1~5)×106CFU/mL,用RPMI 1640稀释成 (1~5)×104CFU/mL的两倍终浓度的菌悬液。用灭菌水将氟康唑、卡泊芬净、米卡芬配制成1 280 mg/L;用DMSO将两性霉素B、伊曲康唑、伏立康唑配成1 600 mg/L,储存备用,实验前根据需要用RPMI 1640稀释。
药敏板配制 在96孔细胞培养板上,从第1列到第10列每孔加入药物稀释液100 μL,各药物浓度范围:CPFG及MCFG为0.25~32 μg/mL,FLC 0.125~64 μg/mL,ITC 0.03~16 μg/mL,AmB 0.125~16 μg/mL,VOC 0.03~16 μg/mL。取100 μL RPMI 1640 (不含药液)加入第11列作为生长对照,取200 μL RPMI 1640 (不含药液)加入第12列作为阴性对照。配制好的药敏板存-20℃备用。
液体培养基接种 除第12列阴性对照,余各孔均加入100 μL菌液,25℃及37℃下培养72 h后观察结果。每次使用质控菌株进行质控。
结果判定 MIC值参照美国临床实验室标准化委员会推荐的M38-A2方案[13-14],卡泊芬净、米卡芬净、氟康唑与生长对照孔相比,≥80%生长抑制所对应的最低药物浓度;伊曲康唑、伏立康唑和两性霉素B为100%生长抑制所对应的最低药物浓度。重复3次实验。
2.5 感染动物模型
实验材料 Balb/c小鼠,雌雄不限,体重 (20±2) g,购于广西医科大学动物中心;将孢子悬液调整至107/mL和109/mL,分别用于菌载量组和死亡率组的注射。
实验分组 小鼠随机分3组:菌载量组 (每只接种孢子量106)9只;死亡率组 (每只接种孢子量108/只)9只 ;对照组9只。每只小鼠实验前4 d,前1天和实验当天按200 mg/kg腹腔注射环磷酰胺 (浓度20 mg/mL),实验当天按40 mg/kg腹腔注射曲安奈德 (8 mg/mL)。实验当天:载菌量组每只小鼠腹腔注射孢子量106,死亡率组每只小鼠腹腔注射孢子量108。对照组注射0.1 mL生理盐水。
观察指标 一般情况:进食、活动、反应、体重、被毛。菌载量组,感染第3、6、9天分别无菌解剖3只,收集肝脾肺,称重,加1 mL灭菌水研磨,收集研磨液倍比稀释10倍、100倍、1 000倍,取100 μL于YPD平皿涂板,25℃培养72 h计算菌落数。所得菌落数取平均值乘以稀释倍数,再除以组织重量,得出每只小鼠的组织菌载量。重复实验3次。死亡率组,每天记录小鼠死亡的天数及只数,观察周期为14 d,使用Kaplan-Meier法绘制生存曲线。
3 结 果
3.1 菌株特征
FRR和ΔsakA在ANM培养基25℃培养7 d后,显微镜下观察 (见图1~2),FRR细树枝状,以帚状枝方式产孢,分生孢子梗见丰富孢子;ΔsakA菌丝弯曲不规则,多数细胞异常肿胀,甚至溶解破裂,分生孢子形态畸变。钙荧光白染色后 (见图3),FRR细胞壁几丁质分布均匀,而ΔsakA细胞壁染色不均,几丁质异常沉积。
3.2 巨噬细胞共培养
FRR在巨噬细胞内可见大量腊肠状酵母细胞;ΔsakA在巨噬细胞内以孢子形态存在,不能转化成酵母细胞 (见图4)。共培养裂解物在YPD培养皿上25℃,72 h生长情况:空白对照组无真菌生长,FRR组及ΔsakA组可见菌落形成 (见图5),且FRR组>ΔsakA组 (P<0.05)。与FRR相比,ΔsakA更易被巨噬细胞杀死 (见表1)。

图125℃下,FRR与ΔsakA在ANM培养基下生长7 d的产孢情况 (×40)图225℃下,FRR与ΔsakA在ANM培养基下生长7 d的菌丝形态 (×40)图325℃下,FRR与ΔsakA在ANM培养基下生长7 d,钙荧光白染色后细胞壁几丁质的分布情况 (×400,红色箭头指示几丁质沉积位置)图4FRR和ΔsakA分别与小鼠巨噬细胞共培养24 h荧光显微镜下形态 (×400)图525℃ 72 h,TM不同菌株在YPD上菌落形态
Fig.1Conidial germination ofFRRandΔsakAstrains on A.nidulans minimal medium at 25℃ for 7 daysFig.2Hyphal morphogenesis ofΔsakAcompared withFRRstrains on A.nidulans minimal medium at 25℃ for 7 daysFig.3FRRandΔsakAstrains were grown for 7 days at 25℃ on ANM and stained with calcofluor white (CAL) to visualize cell walls and septaFig.4FRRandΔsakAwere co-cultured with mouse macrophages for 24 h under fluorescence microscope, respectivelyFig.5Colony morphology of different strains of TM on YPD at 25℃ for 72 h
表1CFU检测SakA对小鼠巨噬细胞吞噬TM分生孢子的影响 (X±Sn=3)
Tab.1Effect ofSakAon phagocytic conidia of macrophages detected by CFU (X±Sn=3)
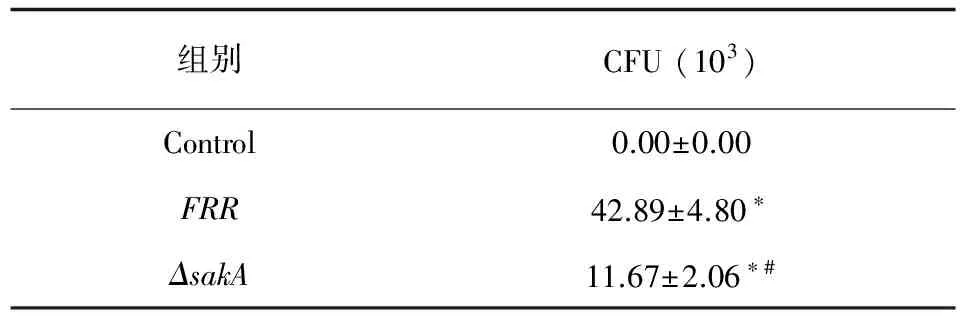
组别CFU(103)Control0.00±0.00FRR42.89±4.80∗ΔsakA11.67±2.06∗#
注:*.P<0.01 vs control;#.P<0.05 vsΔsakA
3.3 细胞壁合成基因的表达
野生株FKS1、CHS基因mRNA表达量在37℃酵母相较25℃菌丝相明显升高 (P<0.05)(见图6),提示TM转化为酵母相后细胞壁成分发生变化,1,3-β-D葡聚糖和几丁质含量增加,这可能是TM酵母相对棘白霉素敏感性较菌丝相下降的原因。ΔsakA和FRR的基因表达显示 (见图7):25℃菌丝相下,二者FKS1、CHS基因表达水平无差异 (P>0.05),而37℃酵母相时ΔsakA的FKS1、CHS基因表达水与FRR相比均明显下降 (P<0.05)。
3.4 药物敏感试验
敲除株和野生株一样,两相形态对氟康唑、伊曲康唑、伏立康唑的敏感性都无差异。与野生株酵母相相比,敲除株酵母相对两性霉素B、卡泊芬净及米卡芬净MIC减小1~2个浓度梯度 (见表2)。
表2六种抗真菌药对野生株和敲除株体外药敏结果
Tab.2Invitrosusceptibility of six antifungal drugs to wild strains and knockout strains
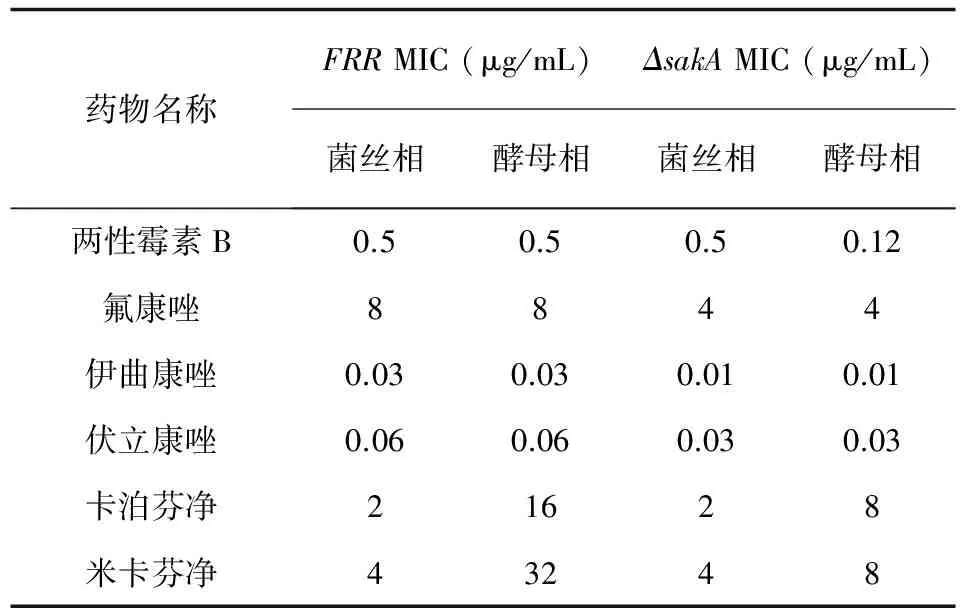
药物名称FRRMIC(μg/mL)ΔsakAMIC(μg/mL)菌丝相酵母相菌丝相酵母相两性霉素B0.50.50.50.12氟康唑8844伊曲康唑0.030.030.010.01伏立康唑0.060.060.030.03卡泊芬净21628米卡芬净43248
3.5 感染小鼠模型
野生株感染小鼠14 d内死亡率为100%,且感染短期内多出现逆毛、体重下降、进食减少、活动力下降且反应迟钝,而敲除株感染小鼠少有上述症状,14 d内死亡率仅33.3% (见图8)。菌载量实验中,涂板后ΔsakA组绝大部分未见菌落生长,与FRR组相比有明显差异 (见图9)。
4 讨 论
SakA(Hog1)-MAPK信号通路参与多种真菌的渗透压应激、氧化应激反应,以及形态转换、呼吸代谢等。烟曲霉SakA-MAPK信号通路在感受氧化压力的刺激以及外源性渗透压变化并产生适应性应答发挥关键作用[15]。白念珠菌Hog1-MAPK通路至少涉及三种过程:对外界压力的反应和适应、形态转换、胞壁合成,且该通路涉及多种组氨酸激酶的调控[16-17]。在马尔尼菲篮状菌中HOG1的同源基因为SakA[9],研究表明,SakA在马尔尼菲篮状菌环境应激包括高热、渗透压以及氧化应激中发挥着重要作用[8-10]。我们的前期工作也发现,与野生株相比,ΔsakA在37℃及39℃下生长速度明显减慢;发芽率较野生株低,产孢困难;在高渗、氧化应激下生长受抑制,进一步证实了SakA在TM抵御环境应激的重要意义。在此基础上,本研究探索SakA在TM药物应激以及对小鼠致病力的影响。
在本课题组前期的体外药敏研究中发现,TM的双相形态对棘白霉素类抗真菌药的敏感性存在较大差异。菌丝相TM对米卡芬净敏感,而在37℃转化为致病的酵母样形态后对米卡芬净敏感性明显降低[18]。棘白霉素类药物作用于真菌细胞壁,通过抑制β-1,3-葡聚糖合成酶复合体活性,从而减少真菌细胞壁主要成分β-1,3-葡聚糖的合成而发挥抗真菌的作用[19]。以往认为真菌对棘白霉素药敏感性降低的主要原因是获得性或固有性的FKS基因突变[20-22]。但在TM的研究中发现,TM的菌丝及酵母相的FKS基因序列无改变,但存在该基因mRNA及蛋白质表达水平的明显差异;同时TM转化为酵母相后细胞壁几丁质合成酶编码基因CHS表达明显升高[23-24]。因此,我们推测,TM从菌丝相转化为酵母相后,FKS1基因无突变,但该基因及几丁质合成的编码基因CHS表达量发生了变化以及由此引起的细胞壁成分变化,可能参与了TM酵母相对棘白霉素类药物不敏感的发生。在本研究中我们发现,SakA可调控细胞壁FKS、CHS基因的表达,ΔsakA敲除株FKS1、CHS表达量低于野生株FRR。在体外药敏试验中,ΔsakA敲除株的酵母相对卡泊芬净、米卡芬净的敏感性较野生株明显升高。由此提示,SakA信号通路在TM酵母相应对棘白霉素的杀伤时,通过调控TM细胞壁合成编码基因,引起细胞壁成分改变,从而导致TM酵母相对棘白霉素类药物敏感性降低。
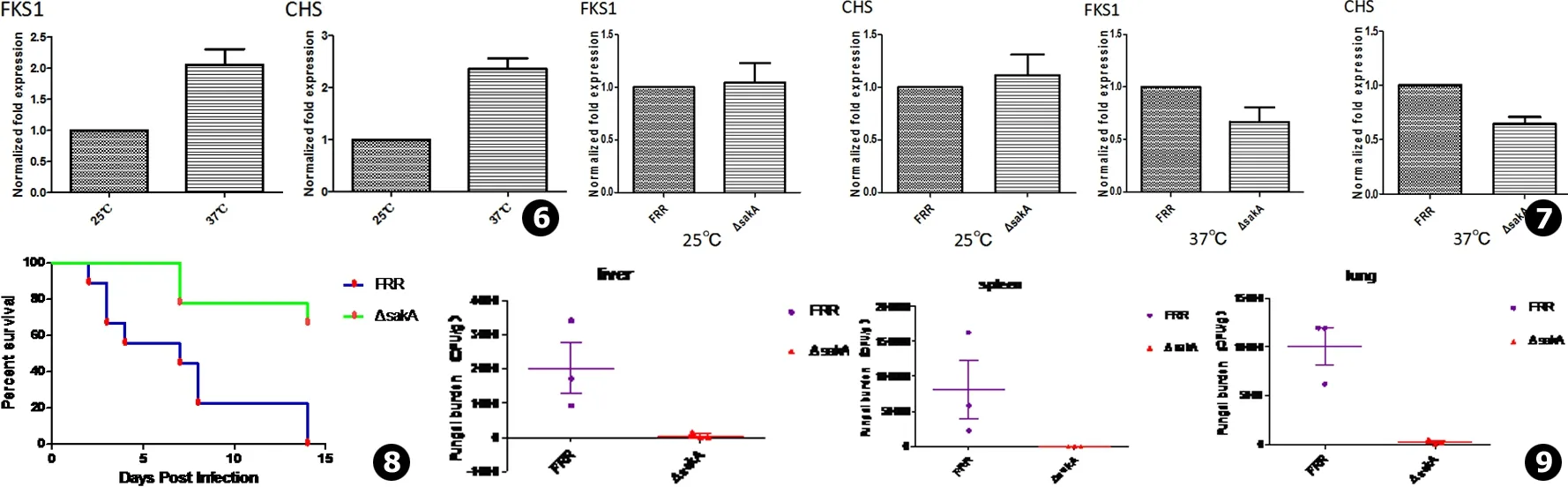
图6在25℃及37℃下,野生株FKS1和CHS基因的表达水平 (P<0.05)图725℃、37℃下,FRR和ΔsakA的FKS1和CHS基因表达水平 (25℃下,两者基因表达差异P>0.05;37℃,两者基因表达差异P<0.05)图8FRR和ΔsakA分别感染小鼠14 d后的生存曲线 (P<0.05)图9FRR和ΔsakA分别感染小鼠6 d后的内脏 (肝、脾、肺)菌载量
Fig.6Expression levels ofCHSandFKS1 at both 25℃ and 37℃ inFRRFig.7Expression levels ofCHSandFKS1 at both 25℃ and 37℃ in each strainsFig.8Survival curves of mice infected withFRRandΔsakAfor 14 days respectively (P<0.05)Fig.9The visceral (liver, spleen, lung) fungal load of mice infected withFRRandΔsakArespectively after 6 days
对多种真菌病原体的研究中发现,SakA(Hog1)是真菌重要的毒力因子[25-30]。在我们建立的TM与小鼠巨噬细胞共培养实验以及TM感染动物模型中,与野生株相比,SakA基因敲除后在小鼠巨噬细胞内不能转变为酵母相,抵御巨噬细胞杀伤的能力明显减弱;同时在感染小鼠的各个脏器中SakA敲除株繁殖能力明显减弱,致病力显著下降。提示SakA在TM抵御宿主免疫细胞杀伤,侵袭感染中发挥重要作用,是TM重要的毒力因子。
综上所述,马尔尼菲篮状菌SakA-MAPK信号通路关键基因SakA在马尔尼菲篮状菌抵御环境应激反应中发挥重要的调控作用,并参与调控细胞壁成分变化,与其酵母相对棘白霉素类药物不敏感相关。此外,SakA是TM重要的毒力因子,在对小鼠致病过程中发挥重要的作用。SakA-MAPK信号通路上其他基因是否与SakA基因协同参与马尔尼菲篮状菌抵抗外界应激反应,有待进一步的研究开展。
[1] Hu Y, Zhang J, Li X, et al.Penicilliummarneffeiinfection: an emerging disease in mainland China[J]. Mycopathologia, 2013, 175(1-2): 57-67.
[2] Vanittanakom N, Cooper R, Fisher C, et al.Penicilliummarneffeiinfection and recent advances in the epidemiology and molecular biology aspects[J]. Clin Microbiol Rev, 2006, 19(1):95-110.
[3] Kawila R, Chaiwarith R, Supparatpinyo K. Clinical and laboratory characteristics of penicilliosis marneffei among patients with and without HIV infection in Northern Thailand: a retrospective study[J]. Bmc Infectious Diseases, 2013, 13(1):464.
[4] Vanittanakom N, Sirisanthana T.Penicilliummarneffeiinfection in patients infected with human immunodeficiency virus[J]. Curr Top Med Mycol, 1997, 8(1-2):35-42.
[5] 黄悦, 张子平, 程波,等. 白念珠菌高渗透性甘油信号通路研究进展[J]. 国际皮肤性病学杂志, 2010, 36(1):17-19.
[6] 张小华,刘向勇,于典科,等. 酿酒酵母促分裂原蛋白激酶Hog1p介导的渗透胁迫反应调控机制[J]. 中国生物化学与分子生物学报,2007, 23(1):27-32.
[7] 皇幼明, 朱红梅, 温海. MAPK信号通路在新生隐球菌致病机制中的作用[J]. 中国真菌学杂志, 2012, 7(5):304-308.
[8] Boyce KJ, Cao C, Andrianopoulos A. Two-component signaling regulates osmotic stress adaptation via SskA and the high-osmolarity glycerol MAPK pathway in the human pathogen Talaromyces marneffei[J]. Msphere, 2016, 1(1):e00086-15.
[9] Nimmanee P, Tam EWT, Woo PCY, et al. Role of the Talaromyces marneffei (Penicilliummarneffei) sakA gene in nitrosative stress response, conidiation and red pigment production[J]. FEMS Microbiol Lett,2017, 364(8). doi: 10.1093/femsle/fnw292.
[10] Nimmanee P, Woo PC, Kummasook A, et al. Characterization ofSakAgene from pathogenic dimorphic fungusPenicilliummarneffei[J]. Int J Med Microbiol, 2015, 305(1):65-74.
[11] Steinbach WJ, Cramer RA Jr, Perfect BZ, et al. Calcineurin controls growth, morphology, and pathogenicity in Aspergillus fumigatus[J]. Eukaryot Cell, 2006, 5(7):1091-1103.
[12] Suwunnakorn S, Cooper CR Jr, Kummasook A, et al. Role of the yakA gene in morphogenesis and stress response inPenicilliummarneffei[J]. Microbiology, 2014, 160(Pt 9):1929-1939.
[13] Clinical and Laboratory Standards Institute.Reference method for broth dilution antifungal susceptibility testing of filamentous fungisecond edition:Approved standard M38- A2[S]. CLSI,Wayne,PA,2008.
[14] 李强国, 李昕, 曹存巍. 两种钙调磷酸酶抑制剂联合常用抗真菌药物对马尔尼菲青霉酵母相体外药敏的研究[J]. 广西医科大学学报, 2015, 32(2):169-172.
[15] Kawasaki L, Sánchez O, Shiozaki K, et al. SakA MAP kinase is involved in stress signal transduction, sexual development and spore viability inAspergillusnidulans[J]. Mol Microbiol, 2002, 45(4):1153-1163.
[16] Boisnard S, Ruprichrobert G, Florent M, et al. Role of Sho1p adaptor in the pseudohyphal development, drugs sensitivity, osmotolerance and oxidant stress adaptation in the opportunistic yeast Candida lusitaniae[J]. Yeast, 2008, 25(11):849-859.
[17] Alonsomonge R, Navarrogarcía F, Román E, et al. The Hog1 mitogen-activated protein kinase is essential in the oxidative stress response and chlamydospore formation inCandidaalbicans[J]. Eukaryotic Cell, 2003, 2(2):351-361.
[18] 曹存巍,万喆,刘伟,等. 米卡芬净联合两性霉素B/伊曲康唑作用于马尔尼菲青霉致病性酵母相的体外药敏实验研究[J]. 中国真菌学杂志,2009,4(4):229-231.
[19] Eschenauer G, Depestel DD, Carver PL. Comparison of echinocandin antifungals[J]. Ther Clin Risk Manag, 2007, 3(1):71- 97.
[20] Walker LA, Gow NA, Munro CA. Fungal echinocandin resistance[J]. Fungal Genet Biol, 2010, 2(1):66.
[21] Perlin DS. Resistance to echinocandin-class antifungal drugs[J]. Drug Resistance Updates, 2007, 10(3):121-130.
[22] Beyda ND, Lewis RE, Garey KW. Echinocandin resistance inCandidaspecies: mechanisms of reduced susceptibility and therapeutic approaches[J]. Ann Pharmacother, 2012, 46(7-8):1086-1096.
[23] Chandler JM, Treece ER, Trenary HR, et al. Protein profiling of the dimorphic, pathogenic fungus,Penicilliummarneffei[J]. Proteome Sci, 2008, 6(1):17.
[24] Xi L, Xu X, Liu W, et al. Differentially expressed proteins of pathogenicPenicilliummarneffeiin yeast and mycelial phases[J]. J Med Microbiol, 2007, 56(3):298-304.
[25] Bruder Nascimento AC, Dos Reis TF, de Castro PA, et al. Mitogen activated protein kinasesSakA(Hog1) and MpkC collaborate forAspergillusfumigatusvirulence[J]. Mol Microbiol, 2016, 100(5):841-859.
[26] Alonso-Monge R, Navarro-García F, Molero G, et al. Role of the Mitogen-Activated Protein Kinase Hog1p in Morphogenesis and Virulence ofCandidaalbicans[J]. J Bacteriol, 1999, 181(10):3058.
[27] Park SM, Choi ES, Kim MJ, et al. Characterization of HOG1 homologue, CpMK1, fromCryphonectriaparasiticaand evidence for hypovirus-mediated perturbation of its phosphorylation in response to hypertonic stress[J]. Mol Microbiol, 2004, 51(5):1267-1277.
[28] Bahn YS. Master and commander in fungal pathogens: the two-component system and the HOG signaling pathway[J]. Eukaryotic Cell, 2008, 7(12):2017-2036.
[29] Igbaria A, Lev S, Rose M S, et al. Distinct and combined roles of the MAP kinases ofCochliobolusheterostrophusin virulence and stress responses[J]. Mol Plant Microbe Interact, 2008, 21(6):769.
[30] Lin CH, Chung KR. Specialized and shared functions of the histidine kinase and HOG1 MAP kinase-mediated signaling pathways inAlternariaalternata, a filamentous fungal pathogen of citrus[J]. Fungal Genet Biol, 2010, 47(10):818-827.
