生物质炭对磺胺类抗生素在坡耕地紫色土中吸附-解吸及淋溶过程的影响①
2018-05-15周志强杨红薇鲜青松唐翔宇
周志强,刘 琛,杨红薇,鲜青松,唐翔宇
生物质炭对磺胺类抗生素在坡耕地紫色土中吸附-解吸及淋溶过程的影响①
周志强1,2,刘 琛2,杨红薇1*,鲜青松2,唐翔宇2
(1 西南交通大学地球科学与环境工程学院,成都 611756;2 中国科学院水利部成都山地灾害与环境研究所,成都 610041)
吸附–解吸是影响抗生素类污染物在土壤中迁移转化及生物有效性的重要过程,本文以川中丘陵区坡耕地紫色土为研究对象,通过批量平衡实验和柱实验研究生物质炭施用(投加量0 (B0)、39.75 t/hm2(B1)和198.75 t/hm2(B2))及田间老化作用(夏季干湿交替)对3种典型磺胺类抗生素(磺胺嘧啶(SD)、磺胺二甲基嘧啶(SM2)及磺胺甲恶唑(SMZ))在紫色土中的吸附–解吸和淋溶行为的影响。结果表明:在几种处理中,3种磺胺类抗生素吸附强弱的顺序都表现为SD>SMZ>SM2;与B0处理相比,添加生物质炭能增加土壤对3种抗生素的吸附能力,其中SM2的吸附显著增加(<0.05),但这种促进作用在经过老化过程后有所减弱。在解吸过程中,3种抗生素的Freundlich常数K大小顺序为SD>SMZ>SM2,表明SD在土壤中吸附容量最大且不易解吸,其次是SMZ和SM2;相应的迟滞系数大小顺序为SD 紫色土;生物质炭;磺胺类抗生素;吸附-解吸;干湿交替。 磺胺类抗生素是一种使用十分广泛的抗生素,常用于农业作物虫害的预防和畜牧业的牲畜疾病治疗[1]。我国是畜牧业大国,抗生素使用量居世界第一。据统计,2013年我国抗生素使用量为16.2万t,其中养殖业占52%;西南地区的抗生素使用量为1.83万t,占全国总量的11.3%,其中磺胺类抗生素的使用量为1 390 t,占全国该类抗生素使用总量的17.6%[2]。抗生素进入动物体内后大部分会以原药或代谢产物的形式经粪尿排出体外,进入土壤和地下水环境[3]。此外,畜禽粪便的农田施用及养殖业废水的随意排放或灌溉利用也是抗生素进入土壤环境的重要途径[4-5]。目前,我国多地已有天然环境中检出磺胺类抗生素的报道。李彦文等[6]调查了广州、深圳等地菜地和污水厂进水几种磺胺抗生素污染情况,结果表明,磺胺类单个化合物检出率为 25.81% ~ 93.50% , 总含量在33.3 ~ 321.4mg/kg之间,污水厂进水磺胺浓度为2.26 ~ 12.12 ng/L。洪蕾洁等[7]对上海市黄浦江部分河段江水、崇明岛地表水及地下水进行测定,磺胺抗生素检出浓度范围为13.3 ~ 241.5 ng/L。 吸附-解吸是污染物在土壤中重要的固-液界面过程,该过程将决定抗生素在环境中的迁移转化行为及其在生物体中的残留特征,其中涉及的影响因素主要包括土壤理化性质、抗生素的性质及使用剂量[8]。例如,土壤的酸碱性能决定磺胺类抗生素是以阳离子、中性分子还是阴离子的形态存在,进而影响抗生素在土壤中的吸附机理和吸附容量。Parket 等[9]研究发现,当土壤pH在4 ~ 8之间时,磺胺通过静电作用附着在土壤表层的吸附点位上,其吸附潜力与土壤pH呈反比。土壤有机质是影响污染物在土壤中迁移的另一个重要因素,表现为土壤从水相中吸持疏水性有机物,因此污染物会首先吸附到土壤有机质中[10]。许多研究发现,土壤对抗生素的吸附量与土壤有机质含量呈正比,但另一方面,腐殖酸等物质能通过改变土壤表面性能而与污染物竞争吸附点位,从而减少土壤对抗生素的吸附。此外,土壤有机质中的可溶性成分(溶解有机物)是污染物在土壤中迁移的重要载体,可促使抗生素从土壤颗粒中解吸而进入水环境[11]。 生物质炭是生物质(主要是秸秆、果壳等)在无氧或低氧高温热解条件下得到的多孔性炭质材料,目前被作为土壤改良剂而广泛使用,同时又具有一定的污染修复功能。有关生物质炭对包括抗生素在内的有机污染物的土壤环境行为研究受到越来越多的关注,Mahtabet 等[12]认为生物质炭能通过含氧官能团、静电引力等去除无机和极性有机污染物。Verheijen 等[13]综合许多研究发现,生物质炭对疏水性有机污染物的亲和力是有机质的10 ~ 1 000倍,生物质炭能去除土壤和沉积物中 80% ~ 90% 的痕量疏水性有机污染物。Anushkaet 等[14]利用蒸汽活化植物的方式制备生物质炭,并发现该生物质炭的加入能明显提高水中磺胺二甲基嘧啶的去除率。但对生物质炭老化作用对有机污染物的土壤环境行为的影响评估及机理分析仍比较缺乏。 紫色土是长江上游最重要的耕地资源之一,以四川盆地最为集中。紫色土由紫色泥页岩发育而成,具有土层浅薄、大孔隙丰富、入渗率高等特点[15]。这些特征导致污染物容易在紫色土中通过优先流发生淋失迁移,而有关抗生素在紫色土中的吸附-解吸过程及生物质炭的施用效应研究相当缺乏。综上,本文以坡耕地紫色土为对象,通过室内批量平衡实验和土柱淋溶实验,研究生物质炭添加及田间老化作用对3种典型磺胺类抗生素(磺胺嘧啶(SD)、磺胺二甲基嘧啶(SM2)及磺胺甲恶唑(SMZ))在紫色土中的吸附-解吸和迁移行为的影响,为该类污染物在紫色土中的迁移行为及生物质炭应用研究提供科学依据。 实验所用仪器包括HPLC-UV高效液相色谱仪(Agilent1200,Eclipse plus C18色谱柱(4.6 mm × 150 mm))、恒温震荡床(上海智城分析仪器制造有限公司)、VISIPRERTMDL固相萃取仪(SUPELCO公司)、RE-5299旋转蒸发器(巩义市英峪高科仪器厂)、pH计(上海梅特勒-托利多仪器有限公司)、蠕动泵(LongerPump公司)、全自动收集器(上海沪西分析仪器厂有限公司)、超纯水系统(美国Millipore公司)等。 3种目标污染物包括磺胺嘧啶(Sulfadiazine,SD)、磺胺二甲基嘧啶(Sulfamethazine, SM2)、磺胺甲恶唑 (Sulfamethoxazole, SMZ) (纯度≥99.5%,Sigma公司),其主要性质参数见表1。所用试剂中甲醇、乙腈为色谱纯,NaOH、甲酸为分析纯。实验用水为MiliQ超纯水。 生物质炭购于河南商丘三利新能源有限公司,是由农作物混合秸秆在500 ℃无氧条件下烧制而成,生物质炭的pH为9.5,含碳量为471.9 g/kg,含氮量为11.6 g/kg,比表面积为56.29 m2/g,孔隙平均直径为6.21 nm。 表1 三种磺胺类抗生素的基本性质 土壤采自四川省绵阳市盐亭县中国科学院紫色土农业生态试验站的坡耕地小区,采样为0 ~ 15 cm耕作层土壤的3点混合样。对照土壤pH为8.6,有机碳含量为3.9 g/kg,CEC为21.21 cmol/kg,砂粒、粉粒和黏粒含量分别为36%、40% 和24%。田间试验小区面积为100 m2,施炭量分别为0 (B0)、39.75 t/hm2(B1) 和198.75 t/hm2(B2)(含炭量为0、10和50 g/kg)。将生物质炭按样方法均匀撒在土壤表面,经犁耕均匀混入耕层土壤,再经过半年(2015年5—11月)田间自然干湿交替过程。土样经自然风干后研磨过60目筛(粒径0.25 μm)。同时,在室内制备添加新鲜生物质炭的土壤混合样(投加量分别为10 g/kg (C1) 和50 g/kg (C2),粒径0.25 μm),与田间施炭土作对比,以考察老化作用的影响。实验前土样在122 ℃、0.115 MPa压力下连续湿热灭菌2 h。 本文采用批量平衡实验方法[16]:准确称取1.0 g土壤样品于离心管中,分别加入10 ml浓度分别为1.0、5.0、10、15、20、25 mg/L的抗生素溶液(含10 mmol/L CaCl2及0.1 g/L NaN3灭菌;每个浓度设3个平行),并称量带盖离心管(含土)重量(0),于25 ℃、180 r/min恒温震荡24 h(预实验确定平衡时间为16 h)。待反应结束后,在4 000 r/min转速下离心10 min,取上清液后称量离心管重量(1),经过滤、净化等预处理后测定抗生素浓度。 吸附过程完成后,为避免提取上清液时带来的容积误差,在上清液提取后向离心管中加入(1-0)ml、不含抗生素的10 mmol/L CaCl2溶液,再次恒温振荡,进行解吸实验,操作步骤同吸附过程。 原状土柱采用不锈钢环刀(厚度2 mm,内径15 cm,高20 cm)在施炭量分别为 0 (B0) 和39.75 t/hm2(B1)的田间试验小区的耕层土壤中取出,土柱实际高度为15 cm。惰性离子Br-由于不与土壤反应,可作为水流示踪剂,用于考察土壤中的水分运动特征。实验前,将土柱置于盆中,使蒸馏水(含0.1 g/L NaN3)的水面不高于土柱底部3 cm,通过毛细管上升作用自下向上饱和土柱。用4 ~ 6倍孔隙体积(即4.8 ~ 7.2 L)蒸馏水(含0.1 g/L NaN3)淋溶土柱,当流速在7.36 ml/min左右(相当于降水量25 mm/h)时,出水流量与进水流量基本一致,视为土柱达到物理化学状态平衡。土柱平衡后,立刻开始淋溶实验(入流溶液含50 mg/L Br-、1.0 mg/L抗生素和0.1 g/L NaN3抗菌剂),出流流速稳定在7.36 ml/min,直到污染物发生穿透。然后,在3个孔隙体积(入流溶液3.6 L)开始降雨(含0.1 g/L NaN3的蒸馏水,模拟降雨量约25 mm/h,直到6个孔隙体积(入流溶液7.2 L)后停止实验。土柱出流管与自动收集器连接,设置参数使其每隔5 min收集出流液50 ml。将样品进行预处理并分析检测,以出流液体积为横坐标,抗生素浓度为纵坐标,绘制土柱的吸附-解吸淋溶曲线。 样品首先通过0.45 μm有机系滤膜过滤,并取5 ml滤液进行固相萃取(SPE小柱型号:Agilent Bond Elut Plexa)。固相萃取过程为:6 ml甲醇活化,流速3 ml/min;进样5 ml,流速1 ml/min;6 ml乙腈洗脱,流速3 ml/min。洗脱液经氮吹干后用甲醇-水流动相定容,移至进样瓶中待测。 抗生素采用高效液相色谱检测,仪器参数为:流动相为甲醇-水(体积比= 25/75,甲酸含量为1 ml/L),流速0.8 ml/min;色谱柱:柱温30 ℃,UV检测波长270 nm;进样量20 μl、针清洗后进样(甲醇洗针)。 3种抗生素的检测限为0.05 mg/L,标准曲线的线性范围为0.1 ~ 30 mg/L(2≥0.999);SD、SM2和SMZ的加标浓度为0.2 ~ 25 mg/L(2≥0.99),加标回收率分别为72% ~ 83%、75% ~ 88%和74% ~ 86%。 本文采用Freundlich非线性等温吸附模型对数据进行拟合,该模型经验性地描述了固体表面的目标物吸附量(Q, mg/kg)与平衡溶液中目标物浓度(C, mg/L)之间的关系,公式如下: 式中:K为吸附容量常数;为吸附亲和力值。 另外,迟滞系数是Freundlich解吸等温线(1/des)与吸附等温线(1/ads)的比值,用于描述解吸迟滞,公式如下: 图1和图2分别为不同初始浓度下,对照(B0处理)、两个不同投加量下添加新鲜生物炭(10 g/kg (C1) 和50 g/kg (C2))及田间施炭老化后(39.75 t/hm2(B1) 和198.75 t/hm2(B2))的紫色土对3种目标抗生素的吸附和解吸规律。在所有处理中,即不论施炭或老化与否,3种抗生素在紫色土中吸附量的大小关系均为:SD > SMZ > SM2。磺胺抗生素的形态及吸附机理与pH密切相关:当pH < pKa1时,磺胺以阳离子为主,与土壤颗粒表面所带负电荷存在静电引力,吸附机理以阳离子交换为主,在土壤中的吸附容量较高;当pKa1< pH < pKa2时,磺胺以中性分子形态为主,能够通过疏水性分配原理与土壤有机质作用;当pH > pKa2时,磺胺则以阴离子形态为主[17]。所测平衡溶液pH在7.2 ~ 7.5之间,新鲜加炭土的pH稍高于老化炭土和对照处理,在此pH范围内,SD、SMZ主要以阴离子形态存在于溶液中,且SD的离子化程度低于SMZ,因而带负电的土壤颗粒对SD的吸附量大于SMZ,且分配作用也可能同为二者的主要吸附机制。SM2尽管主要以中性分子存在,但水溶性远大于SD、SMZ,而ow值远小于SD、SMZ,因此,SM2不易通过分配作用吸附在土壤有机质中,吸附量也最低。 图1 各初始浓度下磺胺类抗生素在不同施炭处理紫色土中的吸附 图2 各初始浓度下磺胺类抗生素在不同施炭处理紫色土中的解吸 老化对生物质炭施加效应的影响较大。与B0处理相比,土壤中添加新鲜的生物质炭后3种抗生素的吸附量都有所增加,其中SM2的增量尤为明显(< 0.05),而SD和SMZ的增量未达到显著水平(>0.05)。另一方面,除B2处理中的SM2吸附量显著增加外(<0.05),其余施炭后经老化处理的土壤对3种抗生素的吸附量都总体低于B0处理,但差异未达到显著水平(>0.05)。生物质炭的性质在老化过程中发生变化,对污染物吸附的影响表现为两个相反的作用:一方面,生物质炭是多孔介质,在老化过程中可吸附大量有机、无机物质,部分吸附点位被占据,从而降低了对目标污染物的吸持;另一方面,在干湿交替作用下,生物质炭表面具有丰富的化学官能团可能进一步增强,如文献中报道的羧基结构的显著增加,可与污染物之间具有更强的亲和力,从而促进吸附[18]。这两种作用中占主导的一方将决定老化炭对污染物吸附的影响最终表现为促进还是抑制。上述机理已在一些研究中报道,如Lin 等[19]发现,生物质炭在老化过程中因氧化还原反应而生成羧基、苯酚基等官能团,促进了生物质炭颗粒在土壤矿物上的吸附;牛亚茹等[20]研究发现,生物质炭显著提高了土壤有机质含量,王光飞等[21]也发现同样现象,且生物质炭添加量与有机质含量增加成正比,这都可能促进生物质炭对有机质的吸附。本文中,可推断由于吸附点位被占据而造成的吸附减弱机制可能占主导作用,导致了老化炭土的吸附能力低于对照和新鲜炭土。然而在高投加量下,生物质炭提供了更多的官能团,由于SM2主要以中性分子存在,这种减弱机制的影响程度则会降低,甚至出现加强现象。 与吸附过程相比,不同施炭处理的紫色土对3种磺胺抗生素的解吸与吸附过程的固-液两相平衡关系随污染物初始浓度的变化规律基本相似,表明了对施炭紫色土而言,吸附量越大,解吸后土壤中的结合残留量也越高。 Freundlich模型常用来拟合非均质吸附行为,它假设吸附是在异质性表面发生的,是一个多层吸附过程。本文中添加了生物质炭的土壤属非均质体系,对比了其他模型的拟合结果,Freundlich模型对吸附过程的拟合效果最佳。如表2所示,该模型对3种磺胺类抗生素在不同施炭处理的紫色土中吸附等温线拟合的相关性较好,均达到极显著水平(2>0.81,<0.01)。Liu 等[22]在研究小麦秸秆生物质炭对SD、SM2和SMZ的吸附实验中发现,无论土壤加炭与否,3种磺胺的吸附-解吸等温线都符合Freundlich模型;加炭引起的吸附K值和值的变化可能因土壤类型不同而改变。从表2可以看出,无论生物质炭老化与否,炭添加量与K值成正比;在土壤中添加新鲜生物质炭能增加土壤对污染物的吸附容量,其中SD最明显。以上现象表明生物质炭在老化过程中吸附点位被占据,降低了对目标污染物的吸持,这导致老化炭降低了对SD的吸附容量;另一方面,生物质炭表面的化学官能团在老化过程中发生改变,可能加强了与污染物的亲和力,这导致了老化炭土整体上增加对SM2和SMZ的吸附K值。相应的吸附值的大小顺序为SD < SMZ < SM2,表明土壤对3种磺胺的亲和力为SD > SMZ > SM2[23]。此外,B0处理和B1处理的SM2吸附1/≈ 1,而C1处理、C2处理和B2处理的1/<1,表明SM2在B0处理和B1处理中的吸附作用力相对单一,而在其他几种土壤上SM2与土壤有机质及生物质炭还存在其他作用机制,如土壤有机质中的极性基团(酚羟基和羧基等)及土壤孔隙内壁表面能够与磺胺类抗生素通过氢键和范德华力作用键合[24]。模型值的大小与SM2在各处理土壤中实际吸附量的高低(图1)相一致,即SM2在B0处理和B1处理上的吸附最弱,而在C1处理、C2处理和B2处理中的吸附相对更强[25]。对于SD和SMZ两种抗生素,相应的1/>1,表明各处理下的紫色土对这两种抗生素的亲和能力都较强。 表2 磺胺类抗生素在不同施炭紫色土中吸附-解吸过程的Freundlich模型拟合参数 等温解吸过程的Freundlich拟合结果能反映抗生素发生解吸的难易程度以及在达到解吸平衡时土壤中相应的抗生素的结合残留量。首先,如表2所示,模型对3种磺胺抗生素解吸拟合的相关性较好(2>0.78)。其中,SD和SMZ的解吸K值分别在60.26 ~ 127.35和24.60 ~ 53.33范围,均远大于各自相应的吸附K值,这表明解吸后土壤中SD和SMZ的结合残留量仍较多,而SM2的解吸K值在2.59 ~ 10.94范围,略高于相应的吸附K值,表明该抗生素的解吸程度较大,可逆性相对较强,而在土壤中的残留量相对较少。 本文通过迟滞系数衡量解吸相对于吸附过程的迟滞程度。通常认为,当<1时,污染物与土壤结合作用力较强,解吸的迟滞现象明显;而当>1时,则解吸较快,迟滞性小[26]。 表3 三种磺胺抗生素在不同施炭土壤中的迟滞系数H值 从表3可以看出, SM2的值最高且均大于1,这可能是因为SM2与土壤的吸持强度弱于SD、SMZ,且SM2的水溶性也大于SD、SMZ,因而在3种抗生素中SM2的解吸程度(吸附的可逆性)最高。施炭后经老化处理土壤的值均大于空白土,这可能是由于生物质炭在老化过程中可吸附大量有机、无机物质,部分吸附点位被占据,有效吸附位点在老化过程中减少,从而使其与3种磺胺类抗生素的结合作用力低于空白土。然而,在添加新鲜生物质炭的土壤中,SM2和SMZ的值低于空白和所有老化处理,表明新鲜生物质炭表面对这两种抗生素的吸持作用力比土壤基质强。疏水性最强的SD的迟滞效应明显强于SM2和SMZ,但是,添加新鲜生物质炭的土壤中SD的值高于空白和所有老化处理,这可能是因为SD与源自新鲜生物质炭的可溶性有机质(含量比老化炭处理高,数据未在本文提供)结合而相对易于解吸脱附。 实验中,前3.3个孔隙体积为进药阶段(50 mg/L Br-、1 mg/L抗生素、0.1 g/L NaN3的蒸馏水),后3.3个孔隙体积为淋溶阶段(0.1 g/L NaN3的蒸馏水)。 图3 Br–和3种磺胺在两种土柱中的穿透曲线 从图中可以看出,Br–在B0和B1处理的两个土柱中的穿透分别发生在1.5 ~ 3.7和1.8 ~ 3.5个孔隙体积,SD在两个土柱中的穿透分别发生在1.8 ~ 3.7和1.9 ~ 3.6个孔隙体积,SM2在两个土柱中的穿透分别发生在2.5 ~ 3.6和2.8 ~ 3.5 个孔隙体积,SMZ在两个土柱中的穿透分别发生在2.0 ~ 3.7和2.2 ~ 3.6 个孔隙体积。Br–和3种磺胺抗生素在B1处理的土柱中的穿透要慢于B0处理土柱0.1 ~ 0.3 个孔隙体积,这说明了生物质炭在一定程度上降低了污染物的浸出速率。Liu 等[22]报道过类似的研究结果,发现SD、SM2和SMZ在5 g/kg和10 g/kg生物质炭土柱中的滞留时间比空白土柱多12% ~ 20%。在淋溶阶段,污染物浓度降低趋势在两个生物质炭土柱中相近,抑制效果不是很明显;通过解吸过程的迟滞性发现,在3种抗生素中SM2的解吸程度(吸附的可逆性)最高,因而SM2在降水阶段浓度降低趋势最慢。 1) 3种抗生素在紫色土中的吸附亲和力强弱都表现为:磺胺嘧啶(SD)>磺胺甲恶唑(SMZ)>磺胺二甲基嘧啶(SM2)。 2) 土壤中添加新鲜的生物质炭能促进3种抗生素的吸附,其中SM2的吸附显著增加(<0.05);加炭紫色土经过干湿交替老化后对抗生素吸附的促进作用减弱,吸附量甚至低于对照土壤,差异不显著(> 0.05)。 3) 3种抗生素的解吸过程的迟滞性大小为SD> SMZ>SM2。与添加新鲜生物质炭的土壤相比,经过田间老化处理后土壤中的SMZ 和SM2更易解吸。 4)生物质炭的添加能够降低污染物的浸出速率。 [1] García-Galán M J, Díaz-Cruz M S, Barceló D. Combining chemical analysis and ecotoxicity to determine environmental exposure and assess risk from sulfonamides[J]. Trac Trends in Analytical Chemistry, 2009, 28(6): 804–819 [2] Zhang Q Q, Ying G G, Liu Y S, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling and linkage to bacterial resistance[J]. Environmental Science & Technology, 2015, 49(11): 6772–6782 [3] Boxall A B A, Fogg L A, Blackwell P A, et al. Review of Veterinary medicines in the environment[M]. New York: Springer, 2004, 180(1): 1–91 [4] Thiele-Bruhn S. Pharmaceutical antibiotic compounds in soils-a review[J]. Journal of Plant Nutrition Soil & Science, 2003, 166(2): 145–167 [5] Martinez-Carballo E, Gonzalez-Barreiro C, Scharf S, et al. Environmental monitoring study of selected veterinary antibiotics in animal manure and soils in Austria[J]. Environmental Pollution, 2007, 148(2): 570–579 [6] 李彦文, 莫测辉, 赵娜, 等. 高效液相色谱法测定水和土壤中磺胺类抗生素[J]. 分析化学, 2008, 36(7): 954–958 [7] 洪蕾洁, 石璐, 张亚雷, 等. 固相萃取-高效液相色谱法同时测定水体中的10 种磺胺类抗生素[J]. 环境科学, 2012, 33(2): 652–657 [8] Sarmah A K, Meyer M T, Boxall A B A. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics(VAs) in the environment[J]. Chemosphere, 2006, 65(5): 725–759 [9] Park J Y, Huwe B. Effect of pH and soil structure on transport of sulfonamide antibiotics in agricultural soils[J]. Environmental Pollution, 2016, 213: 561–570 [10] Chiou C T, Porter P E, Schmedding D W. Partition equilibria of nonionic organic compounds between soil organic matter and water[J]. Environmental Science & Technology, 1983, 17: 227–231 [11] Cheng G, Karthikeyan K G. Sorption of the antibiotic tetracycline to humic-mineral complexes[J]. Journal of Environmental Quality, 2008, 37(2): 704–711 [12] Mahtab A, Anushka U R, Jung E L, et al. Biochar as a sorbent for contaminant management in soil and water: A review[J]. Chemosphere, 2014, 99(3): 19–33 [13] Verheijen F, Jeffery S, Bastos A C, et al. Biochar application to soils: A critical scientific review of effects on soil properties, processes and functions[R]. Italy: European Commission, 2010 [14] Anushka U R, Meththika V, Mahtab A, et al. Enhanced sulfamethazine removal by steam-activated invasive plant-derived biochar[J]. Journal of Hazardous Materials, 2015, 290: 43–50 [15] 朱波, 陈实, 游祥. 紫色土退化旱地的肥力恢复与重建[J]. 土壤学报, 2002, 39(5): 743–749 [16] OECD. Test No. 106: adsorption–desorption using a batch equilibrium method[S]. OECD Publishing, 2000 [17] Gao J, Pedersen J A. Adsorption of sulfonamide antimicrobial agents to clay minerals[J]. Environmental Science & Technology, 2005, 39(24): 9509–9516 [18] Balwant S, Fang Y Y, Bruce C C C, et al. NEXAFS and XPS characterisation of carbon functional groups of fresh and aged biochars[J]. Organic Geochemistry, 2014, 77(22): 1–10 [19] Lin Y, Paul M, Stephen J, et al. Nanoscale organo-mineral reactions of biochars in ferrosol: An investigation using microscopy[J]. Plant and Soil, 2012, 357(1/2): 369–380 [20] 牛亚茹, 付祥峰, 邱良祝, 等. 施用生物质炭对大棚土壤特性、黄瓜品质和根结线虫病的影响[J]. 土壤, 2017, 49(1): 57–62 [21] 王光飞, 马艳, 郭德杰, 等. 不同用量秸秆生物炭对辣椒疫病防控效果及土壤性状的影响[J]. 土壤学报, 2017, 54(1): 204–215 [22] Liu Z, Han Y, Jing M, et al. Sorption and transport of sulfonamides in soils amended with wheat straw-derived biochar:Effects of water pH, coexistence copper ion,and dissolved organic matter[J]. Journal of Soils and Sediments, 2015: 1–9 [23] Miller M M, Waslk S P, Huang G L, et al. Relationships between octanol-water partion coefficient and aqueous solubility[J]. Environmental Science & Technology, 1985, 19(6): 522–529 [24] 孔晶晶, 裴志国, 温蓓, 等. 磺胺嘧啶和磺胺噻唑在土壤中的吸附行为[J]. 环境化学, 2008, 27(6): 736–741 [25] Thiele-Bruhn S, Seibicke T, Schulten H R, et al. Sorption of sulfonamide pharmaceutical antibiotics on whole soils and particle-size fractions[J]. Journal of Environmental Quality, 2004, 33(4): 1331–1342 [26] Keity M D, Livia M P, Susanne R. Sorption and desorption of sulfadimethoxine, sulfaquinoxaline and sulfamethazine antimicrobials in Brazilian soils[J]. Science of the Total Environment, 2014, 476: 406–414 Effects of Biochar Application on Sorption-Desorption Process and Leaching Behaviour of Sulfonamide Antibiotics ZHOU Zhiqiang1,2, LIU Chen2, YANG Hongwei1*, XIAN Qinsong2, TANG Xiangyu2 (1 College of Geosciences and Environmental Engineering, Southwest Jiaotong University, Chengdu 611756, China; 2 Institute of Mountain Hazards and Environment, CAS, Chengdu 610041, China) Sorption and desorption are an important process that will influence the behavior of transport, transform and bioavailability of antibiotics in soils. In this study, batch and column experiments were carried out to study the effects of biochar application on the sorption-desorption process and leaching behaviour of three typical sulfonamide antibiotics (Sulfadiazine, SD; Sulfamethazine, SM2; and Sulfamethoxazole, SMZ) in a sloping cropland purple soil which is distributed widely and abundantly in Sichuan hilly area. Biochar was applied to the tested soil with the amounts of 0 (B0), 39.75 t/hm2(B1) and 198.75 t/hm2(B2) respectively and went through a half-year dry-wet alternate aging process (from May to November). The results showed that the adsorption capacity of three sulfonamides followed the order of SD>SMZ>SM2; Compared with B0, addition of fresh biochar enhanced the adsorption of SD, SM2 and SMZ, among which the improvement for SM2 was significant (<0.05), but such effect became less obvious after the ageing process. As for the desorption process, the value of Freundlich coefficientKof three sulfonamides followed the order of SD>SMZ>SM2, indicating that SD had the highest adsorption capacity and lowest desorption capacity with SM2 inversely. The hysteresis coefficient () of three sulfonamides followed the order of SD Purple soil; Biochar; Sulfonamides; Sorption and desorption; Alternation of drying and wetting 10.13758/j.cnki.tr.2018.02.019 国家自然科学基金青年科学基金项目(41301549)资助。 (790057478@qq.com) 周志强(1991—),男,江苏南通人,硕士研究生,主要研究方向为土壤有机污染及修复。E-mail:815465788@qq.com X53 A1 材料与方法
1.1 仪器与试剂

1.2 供试土壤
1.3 吸附–解吸实验
1.4 原状土柱淋溶实验
1.5 抗生素分析检测方法
1.6 数据分析
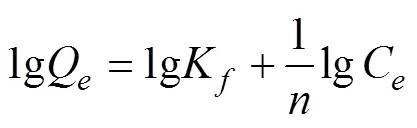

2 结果与讨论
2.1 抗生素在紫色土中的吸附–解吸特征
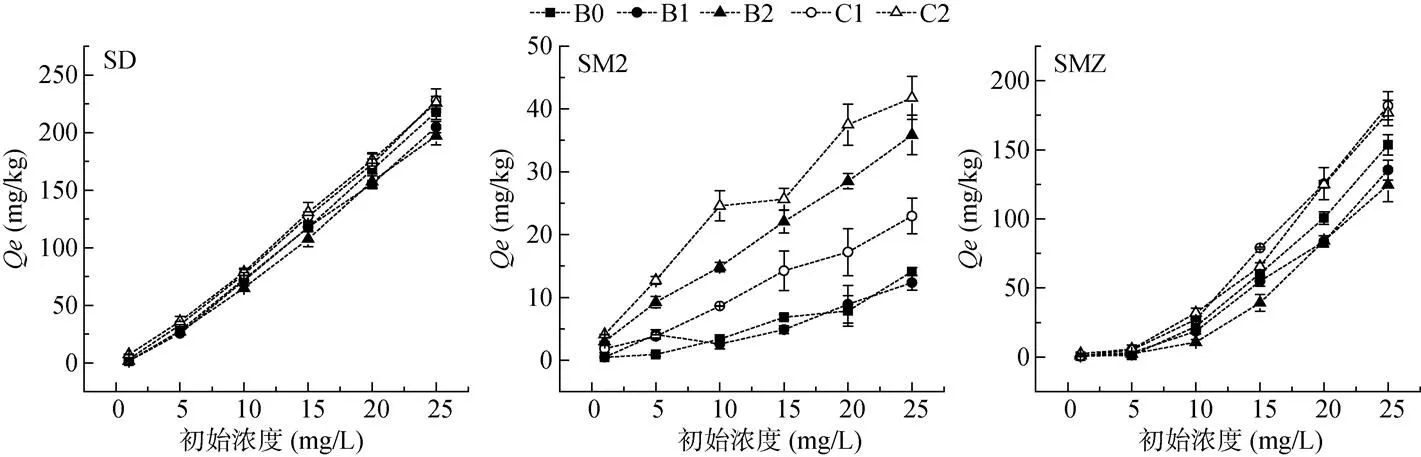

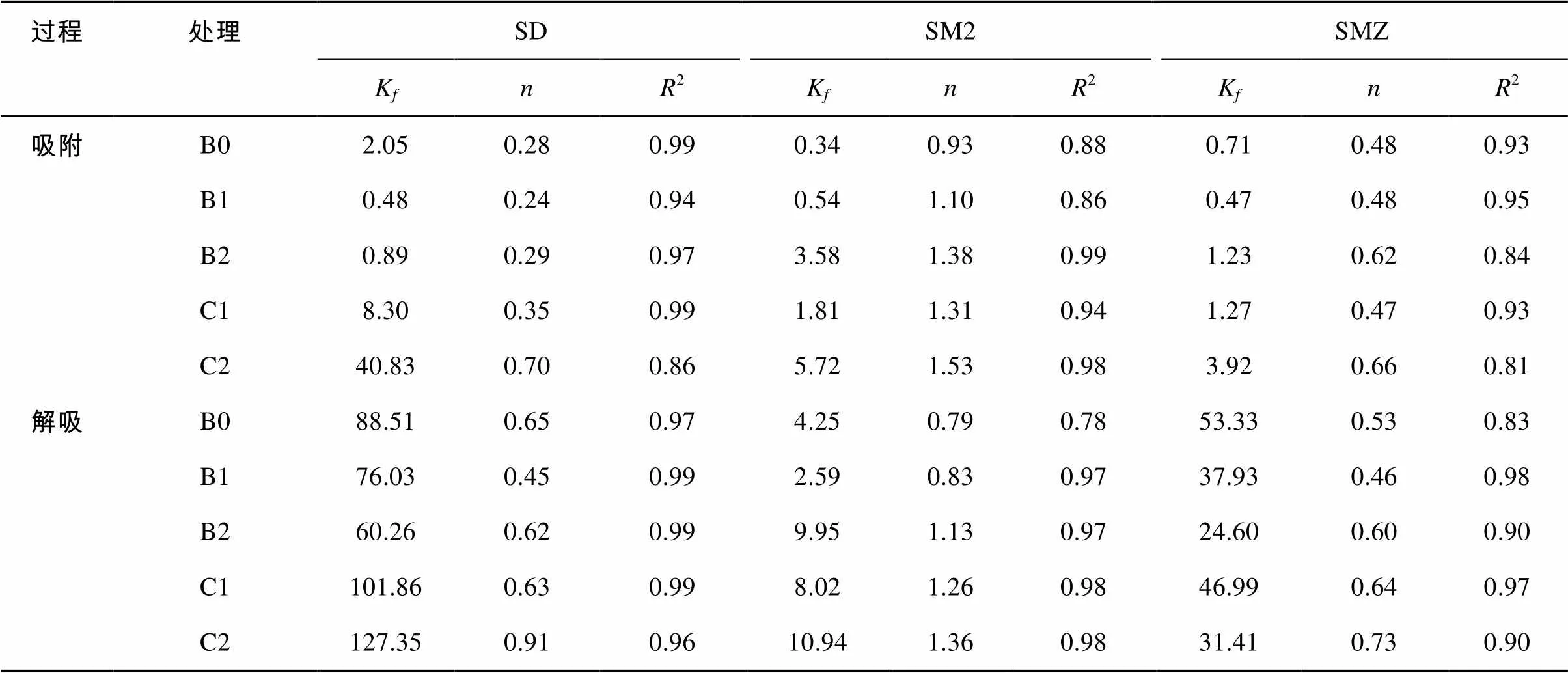
2.2 吸附–解吸等温线的Freundlich模型拟合
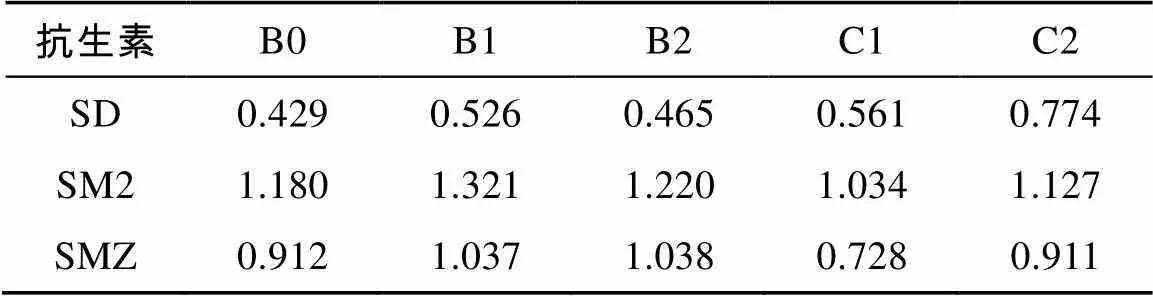
2.3 解吸过程的迟滞性
2.4 原状土柱实验

3 结论
