氧化还原介体催化强化Shewanella oneidensis MR—1还原亚硒酸盐的研究
2018-05-14李俊江宋圆圆刘雁滨郭延凯张伟宏赵蕊廉静
李俊江 宋圆圆 刘雁滨 郭延凯 张伟宏 赵蕊 廉静


摘要:针对微生物还原亚硒酸盐过程普遍存在的时间较长的问题,考察了4种水溶性醌类介体(α-AQS,AQS,1,5-AQDS和AQDS)对奥奈达希瓦氏菌(Shewanella oneidensis MR-1)还原亚硒酸盐过程的加速作用,通过单因素试验优化了培养条件,对硒纳米颗粒的Zeta电位和粒径进行了表征。结果表明,4种醌类介体都加速了亚硒酸盐的还原,其中,AQDS的加速效果最显著;在pH值为8.0,温度为30 ℃,AQDS浓度为0.2 mmol/L条件下,48 h时亚硒酸盐的转化率达到100%;加入AQDS后会生成更大尺寸的硒纳米颗粒,并可能使硒纳米颗粒表面包裹的有机物质成分及含量发生改变。研究结果为Shewanella oneidensis MR-1修复亚硒酸盐污染的实际应用提供了理论依据。
关键词:水污染防治工程;奥奈达希瓦氏菌;亚硒酸盐;硒纳米颗粒;条件优化;氧化还原介体
中图分类号:X712文献标志码:A
Characteristics of selenite bioreduction by Shewanella
oneidensis MR-1 with redox mediators
LI Junjiang1,2, SONG Yuanyuan3,4, LIU Yanbin5, GUO Yankai1,2,
ZHANG Weihong3,4, ZHAO Rui3,4, LIAN Jing1,2
(1. School of Environmental Science and Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China; 2. Pollution Prevention Biotechnology Laboratory of Hebei Province, Shijiazhuang, Hebei 050018, China; 3. School of Environmental and Municipal Engineering, Tianjin Chengjian University, Tianjin 300384, China; 4. Tianjin Key Laboratory of Aquatic Science and Technology, Tianjin 300384, China;5. Construction Office, Shijiazhuang Qiaodong Sewage Treatment Project, Shijiazhuang, Hebei 050026, China)
Abstract:Accelerating the selenite reduction rate is important in selenite bioreduction by microorganism process. This study investigates the impact of redox mediators (α-AQS, AQS, 1,5-AQDS and AQDS) on bioreduction of selenite by Shewanella oneidensis MR-1 and optimizes the bioreduction conditions with Shewanella oneidensis MR-1 and AQDS. The selenium particles obtained from cultures are analyzed using Zeta potential analyzer. The results suggest that all four tested redox mediators are able to accelerate the reduction of selenite by Shewanella oneidensis MR-1, and AQDS is the best. The optimum conditons are AQDS concentration of 0.2 mmol/L pH of 8.0 and temperature of 30 ℃. Selenite is completely removed after 48 h bioreduction by Shewanella oneidensis MR-1 with optimum conditons. Bigger size selenium nanoparticles (SeNPS) can be obtained with AQDS. AQDS may influence the composition and content of the organic layer covering around selenium nanoparticles (SeNPs). This study could provide a foundation for particle application in selenite biodegradation.
Keywords:water pollution control engineering; Shewanella oneidensis MR-1; selenite; selenium nanoparticles; optimizing culture conditions; redox mediators
硒是一种人体必需的微量元素[1],具有抗癌、抗氧化、抗衰老、增强机体免疫力等多种生物学功能[2],缺硒可导致人体出现克山病、大骨节病、白内障病及某些癌症[3]。而硒摄入过量则会引起中毒[2,4]。在自然环境中,硒存在4种价态:+6,+4,0,-2,其中亚硒酸盐(+4)和硒酸盐(+6)对生物的毒性最大[5]。在水体中,硒污染的来源有2个方面:1)个别水体流经含硒量高的地层,从而造成地下水或泉水硒的含量超标;2)炼油、精炼铜、硫酸制造、颜料染料及特种玻璃制造等工业生产过程产生的大量含硒废水[6]。硒超标的水体中,硒主要是以硒酸根离子和亞硒酸根离子形式存在,通常以亚硒酸根离子形式更普遍[7]。
近些年来,发现有多种微生物能够将毒性较大的四价硒转化成低毒的单质硒。地衣芽孢杆菌(Bacillus licheniforni)[8]、沼泽红假单胞菌(Rhodopseudomonas palustris strain N)[9]、假单胞菌(Pseudomonas alcaliphila MBR)[10]、巨大芽孢杆菌(Bacillus megaterium)[11]、奥奈达希瓦氏菌(Shewanella oneidensis MR-1)[12]等,都能够将亚硒酸盐还原为单质硒。单质硒还可以有很多方面的应用,可以应用在纳米医学、纳米传感器和环境修复等方面[13]。但是,这些微生物还原过程普遍存在着还原时间较长的缺点。Shewanella oneidensis MR-1是一种广泛分布的革兰氏阴性γ-变形菌,是一种有着独特呼吸模式的异化金属还原微生物[12],在细胞周质内以及细胞膜上有多种还原酶[14],是一种兼性厌氧微生物,和严格厌氧微生物相比,对生长环境的要求不是很严格,在生物技术应用方面更有优势[15]。
在受污染的沉积物、土壤和水体等环境中,腐殖质可以作为氧化还原介体加速难降解有机物的厌氧生物转化,这一过程起主要作用的活性基团是腐殖质上的醌类结构。由于天然腐殖质结构复杂,其氧化还原特性明显受到来源的限制[16]。与之比较,结构简单的醌类化合物如蒽醌-2-磺酸钠(AQS)、蒽醌-2,6-二磺酸钠(AQDS)等催化作用明显,而且用量不多。有报道称,蒽醌类化合物能加速高氯酸盐[17]、偶氮染料[16,18]、硝基芳香胺[19]和Cr(Ⅵ)、U(Ⅵ)[20]、Se(Ⅳ)、Te(Ⅳ)[21]等污染物的生物降解/转化过程。但氧化还原介体加速亚硒酸盐还原过程仍待深入地系统研究。
针对上述问题,本研究考察了4种水溶性醌类介体对于Shewanella oneidensis MR-1还原亚硒酸盐的加速作用,并通过单因素试验对介体加速Shewanella oneidensis MR-1还原亚硒酸盐的培养条件进行了优化,以期为微生物还原亚硒酸盐过程普遍存在的时间较长的问题,提供有效的解决方法;为Shewanella oneidensis MR-1修复亚硒酸盐污染的实际应用提供理论依据。
1试验材料与方法
1.1试验材料
1.1.1菌种来源
Shewanella oneidensis MR-1由中国海洋微生物菌种保藏管理中心(MCCC)代购(菌种保藏编号为ATCC 700550)。
1.1.2培养基成分
1)扩大培养基:酵母粉(5 g/L),胰蛋白胨(10 g/L),NaCl(10 g/L)。用1 mol/L的NaOH或HCl调节pH值至7.0,121 ℃灭菌20 min。
2)重金属还原培养基:NaCl(5.85 g/L),HEPES钠盐(11.91 g/L),NH4Cl(1.498 g/L),KCl(0.097 g/L),NaH2PO4·2H2O(0.67 g/L),C3H5O3Na(2.241 2 g/L),微量元素(1 mL/L)。用1 mol/L的NaOH或HCl调节pH值,121 ℃灭菌20 min。
3)微量元素组成:氨三乙酸(1.5 g/L),MgSO4·7H2O(30 g/L),MnSO4·H2O(5 g/L),NaCl(10 g/L),FeSO4·7H2O(1 g/L),CaCl2·2H2O(1 g/L),CoCl2·6H2O(1 g/L),ZnCl2(1.3 g/L),CuSO4·5H2O(0.1 g/L),AlK(SO4)2·12H2O(0.1 g/L),H3BO3(0.1 g/L),Na2MoO4·2H2O(0.25 g/L),NiCl2·6H2O(0.25 g/L),Na2WO4·2H2O(0.25 g/L)。
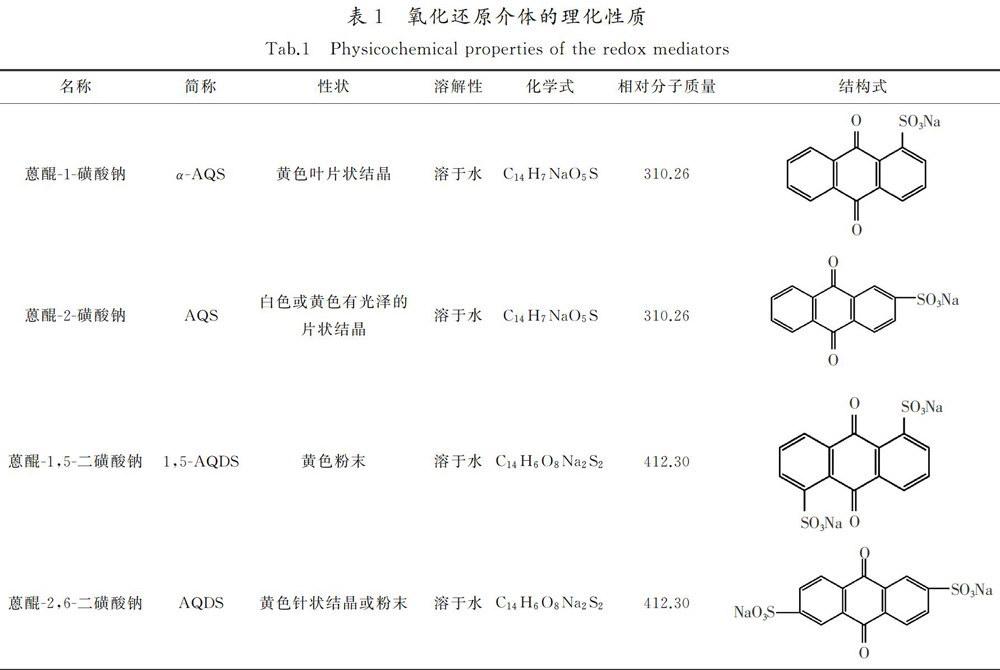
4)试验所选醌类氧化还原介体:蒽醌-1-磺酸钠(α-AQS),蒽醌-2-磺酸钠(AQS),蒽醌-1,5-二磺酸钠(1,5-AQDS),蒽醌-2,6-二磺酸钠(AQDS)。具体的物化性质如表1所示。
1.2试验方法
1.2.1Shewanella oneidensis MR-1的培养
在无菌条件下,将保存的Shewanella oneidensis MR-1菌液按5%(体积分数)的接种量接到盛有250 mL扩大培养基的250 mL锥形瓶中,置于摇床中(35 ℃,140 r/min)培养至对数后期。培养好的菌液经过离心(10 000 r/min,10 min)转接到重金属还原培养基中,控制最终菌液OD600为0.5,待用。
1.2.2Shewanella oneidensis MR-1还原亚硒酸盐
在3个体系(只有重金属还原培养基、加入了灭活的Shewanella oneidensis MR-1的重金属还原培养基、加入了Shewanella oneidensis MR-1的重金属还原培养基)中分别加入0.5 mmol/L亚硒酸钠(体系最终浓度),在重金属还原培养基初始pH值为7.0,温度为35 ℃条件下培养,每隔12 h取样测量亚硒酸钠剩余浓度。
1.2.3醌类氧化还原介体对Shewanella oneidensis MR-1还原亚硒酸盐转化率的影响
在分别加入α-AQS,AQS,1,5-AQDS和AQDS的4个体系(介体最终浓度为0.2 mmol/L)中,加入0.5 mmol/L的亚硒酸钠(体系最终浓度),在重金属还原培养基初始pH值为7.0,温度为35 ℃条件下培养,每隔12 h取样测量亚硒酸钠剩余浓度,筛选出加速效果最好的一种氧化还原介体。
1.2.4AQDS浓度对Shewanella oneidensis MR-1還原亚硒酸盐转化率的影响
确定了最佳的氧化还原介体种类后,分别在300 mL血清瓶中加入不同浓度的该种介体,最终体系的介体浓度分别为0.1,0.2,0.3,0.4 mmol/L,加入0.5 mmol/L的亚硒酸钠(体系最终浓度),在重金属还原培养基初始pH值为7.0,温度为35 ℃条件下培养,每隔12 h取样测量亚硒酸钠剩余浓度,确定氧化还原介体的最佳投加浓度。
1.2.5pH值对AQDS加速Shewanella oneidensis MR-1还原亚硒酸盐转化率的影响
分别配置初始pH值为6.0,7.0,8.0,9.0的重金属还原培养基,分别在300 mL血清瓶中加入最佳浓度的最佳介体,加入0.5 mmol/L亚硒酸钠(体系最终浓度),在温度为35 ℃条件下培养,每隔12 h取样测定体系中剩余亚硒酸钠的浓度,确定重金属还原培养基的最佳初始pH值。
1.2.6温度对AQDS加速Shewanella oneidensis MR-1还原亚硒酸盐转化率的影响
分别在300 mL血清瓶中,加入最佳浓度的最佳介体,分别设置30,35,40,45 ℃等4个不同温度,加入0.5 mmol/L亚硒酸钠(体系最终浓度),重金属还原培养基初始pH值调至最佳pH值,每隔12 h取样测定体系中剩余亚硒酸钠的浓度,确定最佳的培养温度。
1.2.7亚硒酸钠含量测定
亚硒酸钠的质量浓度采用ICP-MS进行测定。具体步骤如下:
1) 取3.0 mL的样品于10mL的离心管中,在10 000 r/min的条件下离心10 min;
2) 取质量为m1的离心上清液置于100 mL塑料瓶内,用1% (质量分数)HNO3稀释至m2,记录m1和m2的质量(ICP-MS对硒的测量范围为0~100 μg/L,体系中亚硒酸钠最大质量浓度为39.48 mg/L,样品需要适当稀释后再进行测量);
3) 按照设定好的测量方法,用ICP-MS测量出稀释后的样品中亚硒酸钠的质量浓度c2;
4) 根据稀释倍数,计算上清液中亚硒酸钠的质量浓度c1,从而得出体系中剩余亚硒酸钠的质量浓度。
体系中剩余亚硒酸钠质量浓度计算公式为
式中:m1和m2的单位为g;c1和c2的单位为μg/L。
1.2.8硒纳米颗粒的提取与表征
取适量菌液,用细胞破碎仪(JY96-IIN,宁波新芝生物科技股份有限公司提供)破碎(4 min,功率为32%),经过离心(9 740 r/min(10 000×g),30 min)后,弃去沉淀;把上清液离心(12 700 r/min(18 700×g),30 min),收集沉淀,再用超纯水将沉淀重新悬浮并离心(12 700 r/min(18 700×g),30 min)3次;最后用超纯水将沉淀重新悬浮,用Zeta电位分析仪(Nano ZS,英国马尔文公司提供)测量硒纳米颗粒表面电位及粒径分布情况。
1.3数据处理与分析
亚硒酸钠转化率的计算公式为
式中,c0表示体系中亚硒酸钠的初始质量浓度,mg/L;c1表示体系中亚硒酸钠的剩余质量浓度,mg/L;亚硒酸钠的转化率均为质量分数。
数据采用Microsoft Excel 2010统计分析,文中图由Origin 8.0软件绘制。
2结果与讨论
2.1Shewanella oneidensis MR-1还原亚硒酸盐
在pH值为7.0、温度为35 ℃的条件下,考察了重金属还原培养基中化学成分对亚硒酸盐浓度的影响以及Shewanella oneidensis MR-1菌体对亚硒酸盐的吸附作用。
由图1可知,亚硒酸盐的浓度在重金属还原培养基体系和灭活Shewanella oneidensis MR-1体系中几乎没有变化,而在接种了Shewanella oneidensis MR-1的体系中,随着培养时间的延长,亚硒酸盐的浓度逐渐降低,还原过程进行到84 h时转化率为50%;说明亚硒酸盐浓度的降低不是由于菌体的吸附作用以及重金属还原培养基中的化学物质和亚硒酸盐发生化学反应导致的,而是一个需要Shewanella oneidensis MR-1参与的生物还原过程。
本试验中,Shewanella oneidensis MR-1展现出还原亚硒酸盐为单质硒的能力,经过一段时间的还原后,重金属还原培养基的颜色由乳白色变成红色,红色是单质硒的特征颜色,表明有单质硒生成,并且随着培养时间的延长颜色逐渐加深。
2.2醌类氧化还原介体对Shewanella oneidensis MR-1还原亚硒酸盐转化率的影响
在pH值为 7.0、温度为35 ℃的条件下,考察4种醌类氧化还原介体α-AQS,AQS,1,5-AQDS和AQDS对Shewanella oneidensis MR-1还原亚硒酸盐过程的影响,结果如图2所示。
由图2可知,当Shewanella oneidensis MR-1还原亚硒酸盐过程进行到84 h时,4种醌类介体α-AQS,AQS,1,5-AQDS和AQDS对Shewanella oneidensis MR-1还原亚硒酸盐转化率的加速效果不同,转化率分别为25%,45%,40%和99%,与对照体系相比,亚硒酸盐的转化率分别提高了4%,24%,19%和78%;加速快慢順序依次为AQDS> AQS > 1,5-AQDS >α-AQS。类似的现象在其他研究中也有报道,ZHANG等[22]的研究也表明加入0.6 mmol/L的AQDS能够加速Enterobacter taylorae对亚硒酸盐的还原。HE等[23]的研究也表明加入0.15 mmol/L的AQDS可以加速Anaeromyxobacter dehalogenans对亚硒酸盐的降解,转化率提高了59%。PEARCE等[24]的研究也表明加入0.1 mmol/L的AQDS可以将亚硒酸盐的还原速率提高2倍~5倍。但是,AQDS并不是对所有的微生物都能起到显著的加速作用,WANG等[21]的研究表明,在大肠杆菌还原亚硒酸盐的过程中加入AQDS和AQS,加速效果并不明显,反而是指甲花醌很大程度上加速了还原过程。这种结果可能是由于微生物种类的不同,其亚硒酸盐还原机理也存在差异,导致AQDS对某些微生物起的加速效果并不明显。郭延凯等[25]的研究表明,5种结构相似醌介体对酸性红B生物脱色的催化效果依次为AQS>2,7-AQDS>AQDS>1,5-AQDS>α-AQS>空白组。
2.3AQDS浓度对Shewanella oneidensis MR-1还原亚硒酸盐转化率的影响
在pH值为7.0、温度为35 ℃的条件下,考察AQDS浓度对Shewanella oneidensis MR-1还原亚硒酸盐过程的影响。结果如图3所示。
由图3可知,当Shewanella oneidensis MR-1还原亚硒酸盐过程进行到84 h时,在AQDS浓度分别为0.1,0.2,0.3和0.4 mmol/L条件下,AQDS对Shewanella oneidensis MR-1还原亚硒酸盐的加速效果不同,转化率分别为55%,99%,57%和53%。在培养到84 h时,随着AQDS浓度的增加,亚硒酸盐的转化率先增加后减少,其中当AQDS浓度为0.2 mmol/L时,亚硒酸盐的转化率最高。虽然AQDS能够显著加快亚硒酸盐的去除,但是当AQDS的浓度超出一定范围时,加速效果明显减弱。李海波等[26]的研究表明,当n(AQDS)≤0.32 mmol/L时,硝酸盐氮的去除速率随着AQDS浓度的增加而增加。WANG等[19]的研究表明,当指甲花醌的浓度从0.1 mmol/L增加到0.6 mmol/L时,亚硒酸盐的转化率随着指甲花醌浓度的增加而增加,但是增加的程度逐渐减小;当指甲花醌浓度为0.4 mmol/L和0.6 mmol/L时,亚硒酸盐转化率基本相同。黄丹等[27]的研究表明,加入0.01 mmol/L AQDS时,苯酚降解速率为不加介体时的1.77倍,且随着介体浓度的增加,对Shewanella sp. XB苯酚降解过程会产生一定的抑制。
2.4pH值对AQDS加速Shewanella oneidensis MR-1还原亚硒酸盐转化率的影响
在AQDS 浓度为0.2 mmol/L、温度为35 ℃的条件下,考察pH值对AQDS加速Shewanella oneidensis MR-1还原亚硒酸盐过程的影响。在受到亚硒酸盐污染的环境中,微生物会面临比模拟条件更复杂的外界环境,外界条件的改变会对亚硒酸盐还原过程产生影响。研究pH值对AQDS加速Shewanella oneidensis MR-1还原亚硒酸盐过程的影响具有实际指导意义。结果如图4所示。
由图4可知,pH值对Shewanella oneidensis MR-1还原亚硒酸盐转化率有很大的影响,当Shewanella oneidensis MR-1还原亚硒酸盐过程进行到84 h时,在pH值分别为6.0,7.0,8.0和9.0条件下,AQDS对Shewanella oneidensis MR-1还原亚硒酸盐的加速效果不同,转化率分别为38%,67%,97%和7%。当pH值在6.0~9.0范围内时,随着pH值的增加,亚硒酸盐的转化率先增加后减少;当pH值在7.0~8.0范围内时,Shewanella oneidensis MR-1还原亚硒酸盐的转化率较高,说明弱碱性条件更适合Shewanella oneidensis MR-1对亚硒酸盐的还原。李丹等[9]的研究也表明,过高或过低的pH值都会降低光合细菌N菌株对于亚硒酸盐的转化率,中性条件更有利于N菌株还原亚硒酸盐,这与N菌株的最适生长pH值一致。研究发现,当pH值在6~11之间时,Pseudomonas alcaliphila MBR均能进行生长和对亚硒酸盐的还原,而pH值低于5或高于12时,菌体无法生长同时也失去对亚硒酸盐的还原能力,该菌株适合在碱性环境下对亚硒酸盐进行还原,这与该菌自身嗜碱的生理特性相一致[10]。
2.5温度对AQDS加速Shewanella oneidensis MR-1还原亚硒酸盐转化率的影响
在AQDS浓度为0.2 mmol/L,pH 值为8.0的条件下,考察温度对AQDS加速Shewanella oneidensis MR-1还原亚硒酸盐过程的影响。在自然环境中,温度会随着季节和地区的不同而发生变化,研究温度对AQDS加速Shewanella oneidensis MR-1还原亚硒酸盐的影响具有实际指导意义。结果如图5所示。
由图5可知,当Shewanella oneidensis MR-1还原亚硒酸盐过程进行到48 h时,在温度分别为30,35,40和45 ℃的条件下,AQDS对Shewanella oneidesis MR-1还原亚硒酸盐的加速效果不同,转化率分别为100%,77%,32%和28%,在30~35 ℃范围内时,亚硒酸盐都有较高的转化率,转化率在77%以上,30 ℃时转化率最高,温度是微生物的重要生存因子,在适宜的温度范围内,温度的升高会提高酶促反应速率,微生物的代谢速率也会相应提高[28];刘金香等[29]的研究表明,与25 ℃条件下相比,在30 ℃条件下,由于环境温度高,Shewanella oneidensis MR-1细菌活性较强,新陈代谢活动也较旺盛。当温度超过35 ℃时,亚硒酸盐的转化率有较大的降低,这可能是由于高温环境影响了Shewanella oneidensis MR-1还原亚硒酸盐相关酶的活性,从而使亚硒酸盐的转化率降低。结果表明,AQDS加速Shewanella oneidensis MR-1还原亚硒酸盐的最适温度为30 ℃。
2.6硒纳米颗粒表面Zeta电位及粒径分布
在AQDS 浓度为0.2 mmol/L,pH值为8.0,温度为30 ℃的条件下,考察AQDS对Shewanella oneidensis MR-1还原亚硒酸盐过程中产生的硒纳米颗粒表面Zeta电位的影响, 测量了生成的硒纳米颗粒在不同的pH值条件下,Zeta电位的变化情况,结果如图6所示。
如图6所示,不加AQDS的体系中生成的硒纳米颗粒,当pH值在3.0~4.5之间时,Zeta电位是正值,当pH值为4.5时,Zeta电位是0,当pH值为4.5~7.0之间时,Zeta电位是负值。加入AQDS的体系中生成的硒纳米颗粒,当pH值在3.0~4.3之間时,Zeta电位是正值,当pH值为4.3时,Zeta电位是0,当pH值在4.3~7.0之间时,Zeta电位是负值。KHOEI等[30]的研究表明,生物合成的硒纳米颗粒的Zeta电位值随着pH值的变化而发生改变,当pH值为2.0~6.0之间时,Zeta电位是正的,当pH值为6.0时,Zeta电位是0,当pH值为6.0~10.0之间时,Zeta电位是负的。JAIN等[31]的研究表明,生物合成的硒纳米颗粒表面包裹着一层胞外聚合物,它的成分包括糖类、蛋白质、腐殖质类似物等,控制着硒纳米颗粒表面的电荷;从而通过静电斥力的作用使硒纳米颗粒保持稳定[30]。本研究也得到了相似的结果,说明Shewanella oneidensis MR-1生成的硒纳米颗粒表面同样包裹着一层成分相似的物质;但是,加入AQDS的体系中生成的硒纳米颗粒表面的Zeta电位值和不加AQDS的体系中生成的硒纳米颗粒表面的Zeta电位值存在差异,这可能是由于AQDS的加入,使硒纳米颗粒表面包裹的有机物质成分及含量发生变化导致的。LAMPIS等[5]的研究表明,生物合成的硒纳米颗粒表面检测到糖类、脂质、蛋白质等成分。这些生物分子或许在亚硒酸盐的还原以及硒纳米颗粒的生成过程中起到了重要作用[32]。
在AQDS 浓度为0.2 mmol/L,pH值为8.0,温度为30 ℃的条件下,考察AQDS对Shewanella oneidensis MR-1还原亚硒酸盐过程中产生的硒纳米颗粒粒径的影响,结果如图7和表2所示。
由图7和表2可知,不加AQDS的体系中生成的硒纳米颗粒,当Shewanella oneidensis MR-1还原亚硒酸钠过程进行到24 h时的粒径分布范围为80~920 nm,平均粒径是205.7 nm, 当Shewanella oneidensis MR-1还原亚硒酸钠过程进行到48 h时的粒径分布范围为80~3 800 nm,平均粒径是227.4 nm;加AQDS的体系中生成的硒纳米颗粒,当Shewanella oneidensis MR-1还原亚硒酸钠过程进行到24 h时的粒径分布范围为96~1 300 nm,平均粒径是276.6 nm,当Shewanella oneidensis MR-1还原亚硒酸钠过程进行到48 h时的粒径分布范围为92~3 800 nm,平均粒徑是312.1 nm,随着培养时间的延长,平均粒径增大。LAMPIS等[5]的研究,检测了培养到24 h和48 h时嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia SeITE02)生成的硒纳米颗粒的平均粒径是160.6±62.2 nm和251.9±64.5 nm。
亚硒酸盐在水中以离子形态存在,很容易进入到细胞内。有研究表明,Shewanella oneidensis MR-1还原亚硒酸盐主要是发生在细胞周质内[12]。LAMPIS等[5]的研究表明S.maltophilia SeITE02 存在一种释放机制可以将早期在胞内生成的小尺寸的硒纳米颗粒转移到胞外环境中。在相同的时刻,加入AQDS的体系,生成的硒纳米颗粒粒径更大一些,可能是由于AQDS的加速作用,在早期生成了更多小尺寸的硒单质,再通过一种类似奥斯特瓦尔德成熟的过程[5,33]生长成为更大尺寸的硒纳米颗粒。
2.7醌介体加速Shewanella oneidensis MR-1还原亚硒酸盐机理探究
氧化还原介体能够从Shewanella oneidensis MR-1的呼吸链中捕获电子,加快电子向电子受体的传递[35-37],在Shewanella oneidensis MR-1还原亚硒酸盐的过程中,亚硒酸盐作为电子受体,醌类氧化还原介体的加入加速电子从Shewanella oneidensis MR-1呼吸链向亚硒酸盐的传递,并在相关酶的作用下,将亚硒酸盐还原为单质硒,从而提高了亚硒酸盐的转化率。4种醌类介体对Shewanella oneidensis MR-1还原亚硒酸盐都具有加速效果,可能是由于4种介体都具有醌基,而醌基是腐殖质加速微生物降解污染物的活性基团[38]。但是,4种醌类介体的加速效果不同,这可能是由于其化学结构(取代基数量、位置等)[39]存在差异导致。AQDS浓度与Shewanella oneidensis MR-1利用之间存在对应关系,当AQDS浓度超过Shewanella oneidensis MR-1能够利用的范围时,对微生物会造成损害[40-41],亚硒酸盐的转化率会降低。pH值、温度的改变会严重影响AQDS对Shewanella oneidensis MR-1还原亚硒酸盐的加速效果,这可能是由于超出Shewanella oneidensis MR-1的最适pH值、温度范围时,新陈代谢速率降低,从而影响了电子在呼吸链中的传递。目前的研究表明,醌介体加速污染物生物降解主要存在2种方式,即直接生物还原和间接生物还原2种方式[42],由此,推测醌介体催化强化希瓦氏菌还原亚硒酸盐的还原机理,如图8所示,具体的还原途径有待进一步研究。
3结语
Shewanella oneidensis MR-1能将亚硒酸盐还原,并产生硒纳米颗粒。由于醌基的存在,4种醌类介体(α-AQS,AQS,1,5-AQDS和AQDS)都能够加速Shewanella oneidensis MR-1对亚硒酸盐的还原;由于化学结构(取代基数量、位置等)存在差异导致加速效果不同,其中AQDS的加速效果最显著。在不考虑各因子间交互作用的条件下,AQDS加速Shewanella oneidensis MR-1还原亚硒酸盐的最适条件:pH值为8.0,温度为30 ℃,AQDS浓度为0.2 mmol/L。AQDS会影响Shewanella oneidensis MR-1生成的硒纳米颗粒的尺寸以及颗粒表面有机物质的成分和含量。综合以上结果及醌介体加速污染物生物降解主要方式,推测醌介体催化强化希瓦氏菌还原亚硒酸盐的主要还原机理为直接生物还原和间接生物还原。本研究主要考察了水溶性醌介体对Shewanella oneidensis MR-1还原亚硒酸盐过程的强化作用,然而水溶性介体在实际工程应用中会出现流失,需多次投加,还有二次污染的问题,因此在后续研究中应开展新型固定化氧化还原介体功能材料的研究,从而进一步拓宽本研究的应用前景。
参考文献/References:
[1]杜利成, 宋开平. 试论粮食中的微量元素与人体健康[J]. 绵阳师范高等专科学校学报, 2000,19 (2):54-59.
DU Licheng, SONG Kaiping. Tentatine remarks on trace elements in grain and the health of human body[J]. Journal of Mianyang Teachers' College, 2000,19(2): 54-59.
[2]宁婵娟, 吴国良. 微量元素硒与人体健康及我国富硒食品的开发状况[J].山西农业科学, 2009, 37(5):88-90.
NING Chanjuan, WU Guoliang. Trace element selenium and human health, and development situation of Se-enriched food in China[J]. Journal of Shanxi Agricultural Sciences, 2009, 37(5): 88-90.
[3]王玉標. 硒与人体健康[J]. 安徽教育学院学报, 2003,21(3):43-44.
WANG Yubiao. Selenium and human health [J]. Journal of Anhui Institute of Education, 2003,21(3): 43-44.
[4]朱建明, 梁小兵, 凌宏文, 等. 环境中硒存在形式的研究现状[J]. 矿物岩石地球化学通报, 2003, 22(1):75-81.
ZHU Jianming, LIANG Xiaobing, LING Hongwen, et al. Advances in studying occurrence modes of selenium in environment[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2003, 22(1): 75-81.
[5]LAMPIS S, ZONARO E, BERTOLINI C, et al. Selenite biotransformation and detoxification by Stenotrophomonas maltophilia SeITE02: Novel clues on the route to bacterial biogenesis of selenium nanoparticles[J]. Journal of Hazardous Materials, 2017,324(Part A):3-14.
[6]黄辉. 活性炭吸附法去除水中硒的研究[D].昆明:昆明理工大学,2005.
HUANG Hui. Studying on Removal of Selenium from Water by Activated Carbon Process[D]. Kunming: Kunming University of Science and Technology, 2005.
[7]王琳, 施永生, 毛云. 离子交换法去除水中硒的研究[J].有色金属设计, 2005, 32(1):53-57.
WANG Lin, SHI Yongsheng, MAO Yun. Study on selenium removal from water by ion-exchange process[J]. Nonferrous Metals Design, 2005, 32(1):53-57.
[8]朱建明, 雷磊, 肖湘, 等. 地衣芽孢杆菌对亚硒酸盐的还原[J]. 矿物岩石地球化学通报, 2011, 30(3):245-250.
ZHU Jianming, LEI Lei, XIAO Xiang, et al. The reduction of selenite by Bacillus licheniformis[J]. Bulletin of Mineralogy,Petrology and Geochemistry , 2011,30(3):245-250.
[9]李丹, 李保珍, 张龙颜, 等. 光合细菌还原亚硒酸盐为红色单质硒的条件优化[J]. 山西农业科学,2015,43(5):543-547.
LI Dan, LI Baozhen, ZHANG Longyan, et al. Optimizing experimental conditions for the reduction of selenite to red elemental selenium by photosynthetic bacteria Rhodopseudomonas palustris[J]. Journal of Shanxi Agricultural Sciences, 2015,43(5): 543-547.
[10]蒋华东, 何晓红, 张礼霞, 等. 一株假单胞菌(Pseudomonas alcaliphila MBR)好氧还原亚硒酸钠为红色单质硒[J].微生物学报, 2010, 50(10):1347-1352.
JIANG Huadong, HE Xiaohong, ZHANG Lixia, et al. Reduction of selenite to elemental red selenium under aerobic condition by Pseudomonas alcaliphila MBR[J]. Acta Microbiologica Sinica, 2010, 50(10):1347-1352.
[11]MISHRA R R, PRAJAPATI S, DAS J, et al. Reduction of selenite to red elemental selenium by moderately halotolerant Bacillus megaterium strains isolated from Bhitarkanika mangrove soil and characterization of reduced product[J]. Chemosphere, 2011, 84(9) :1231-1237.
[12]LI Daobo, CHENG Yuanyuan, WU Chao, et al. Selenite reduction by Shewanella oneidensis MR-1 is mediated by fumarate reductase in periplasm[J]. Scientific Reports, 2014, 4(6168): 3735.
[13]WADHWANI S A, SHEDBALKAR U U, SINGH R, et al. Biogenic selenium nanoparticles: Current status and future prospects[J]. Applied Microbiology and Biotechnology, 2016, 100(6): 2555-2566.
[14]ZHOU Nanqing, TIAN Lijiao, WANG Yucai, et al. Extracellular biosynthesis of copper sulfide nanoparticles by Shewanella oneidensis MR-1 as a photothermal agent[J]. Enzyme & Microbial Technology, 2016, 95: 230-235.
[15]XIA Zechao, CHENG Yuanyuan, KONG Wanqin, et al. Electron shuttles alter selenite reduction pathway and redistribute formed Se(0) nanoparticles[J]. Process Biochemistry, 2016,51(3): 408-413.
[16]GUO Jianbo, ZHOU Jiti, WANG Dong, et al. Biocalalyst effects of immobilized anthraquinone on the anaerobic reduction of azo dyes by the salt-tolerant bacteria[J]. Water Research, 2007,41(2): 426-432.
[17]王倩, 郭延凱, 牛博贤, 等. 生物降解高氯酸盐的影响因素研究[J]. 河北科技大学学报, 2015, 36(6): 652-658.
WANG Qian, GUO Yankai, NIU Boxian, et al. Study on the affecting factors of perchlorate biodegradation[J]. Journal of Hebei University of Science and Technology, 2015, 36(6): 652-658.
[18]陈延明, 张华雨, 赵丽君, 等. 氧化还原介体在环境治理中应用研究进展[J]. 河北工业科技, 2013, 30(4): 266-271.
CHEN Yanming, ZHANG Huayu, ZHAO Lijun, et al. Development and application of redox mediators for environmental protection[J]. Hebei Journal of Industrial Science and Technology, 2013, 30(4): 266-271.
[19]DUNNIVANT F M, SCHWARZENBACH R P, MACALADY D L. Reduction of substituted nitrobenzenes in aqueous solutions containing natural organic matter[J]. Environmental Science & Technology, 1992, 26(11): 2133-2141.
[20]GU Baohua, CHEN Jie. Enhanced microbial reduction of Cr(Ⅵ) and U(Ⅵ) by different natural organic matter fractions[J] . Geochimica et Cosmochimica Acta, 2003, 67(19): 3575-3582.
[21]WANG Xiujuan, LIU Guangfei, ZHOU Jiti, et al. Quinone-mediated reduction of selenite and tellurite by Escherichia coli[J] . Bioresource Technology, 2011, 102 (3): 3268-3271.
[22]ZHANG Y, ZAHIR Z A, AMRHEIN C, et al. Application of redox mediator to accelerate selenate reduction to elemental selenium by Enterobacter taylorae[J]. Journal of Agricultural and Food Chemistry, 2007, 55(14): 5714-5717.
[23]HE Qiang, YAO Kai. Impact of alternative electron acceptors on selenium(Ⅳ) reduction by Anaeromyxobacter dehalogenans[J]. Bioresource Technology, 2011, 102 (3): 3578-3580.
[24]PEARCE C I, PATTRICK R A, LAW N, et al. Investigating different mechanisms for biogenic selenite transformations: Geobacter sulfurreducens, Shewanella oneidensis and Veillonella atypica[J]. Environmental Technology, 2009, 30(12):1313-1326.
[25]郭延凯, 马志远, 郭建博, 等. 醌介体催化强化酸性红B生物脱色[J]. 环境工程学报, 2013,7(5): 1739-1743.
GUO Yankai, MA Zhiyuan, GUO Jianbo, et al. Enhanced biodecolorization of Acid Red B catalyzed by quinone mediators[J]. Chinese Journal of Environmental Engineering, 2013, 7(5): 1739-1743.
[26]李海波, 廉静, 郭延凯, 等. 氧化还原介体催化强化Paracoccus versutus菌株GW1反硝化特性研究[J].环境科学, 2012, 33(7): 2458-2463.
LI Haibo, LIAN Jing, GUO Yankai, et al. Biocatalyst of redox mediators on the denitrification by Paracoccus versutus strain GW1[J]. Environmental Science, 2012, 33(7): 2458-2463.
[27]黄丹, 王竞, 李培良, 等. Shewanella sp.XB缺氧反硝化降解苯酚[J]. 环境工程学报, 2014,8(4): 1345-1349.
HUANG Dan, WANG Jing, LI Peiliang, et al. Nitrate-dependent phenol degradation by Shewanella sp. XB under anoxic conditions[J]. Chinese Journal of Environmental Engineering, 2014,8(4): 1345-1349.
[28]周群英, 王士芬.環境工程微生物学[M].3版.北京:高等教育出版社,2008.
[29]刘金香. 奥奈达希瓦氏菌铀(Ⅵ)还原能力的增强机制及应用基础研究[D].衡阳:南华大学, 2015.
LIU Jinxiang. Study on Mechanism and Fundamental Application of U(Ⅵ) Reduction by Shewanella oneidensis[D]. Hengyang: University of South China, 2015.
[30]KHOEI N S, LAMPIS S, ZONARO E, et al. Insights into selenite reduction and biogenesis of elemental selenium nanoparticles by two environmental isolates of Burkholderia fungorum[J]. New Biotechnology, 2017, 34: 1-11.
[31]JAIN R, JORDAN N, WEISS S, et al. Extracellular polymeric substances govern the surface charge of biogenic elemental selenium nanoparticles[J]. Environmental Science & Technology, 2015,49(3): 1713-1720.
[32]LENZ M, KOLVENBACH B, GYGAX B, et al. Shedding light on selenium biomineralization: Proteins associated with bionanominerals[J]. Applied and Environmental Microbiology, 2011, 77(13): 4676-4680.
[33]LAMPIS S, ZONARO E, BERTOLINI C, et al. Delayed formation of zero-valent selenium nanoparticles by Bacillus mycoides SeITE01 as a consequence of selenite reduction under aerobic conditions[J]. Microbial Cell Factories, 2014, 13(1):35-48.
[34]WANG Tingting, YANG Liangbao, ZHANG Buchang, et al. Extracellular biosynthesis and transformation of selenium nanoparticles and application in H2O2 biosensor[ J].Colloids & Surfaces B Biointerfaces, 2010, 80 (1): 94-102.
[35]张霞, 肖莹, 周巧红,等. 微生物燃料电池中产电微生物的研究进展[J]. 生物技术通报, 2017,33(10): 64-73.
ZHANG Xia, XIAO Ying, ZHOU Qiaohong, et al. Research progress on electricigens in microbial fuel cell[J]. Biotechnology Bulletin, 2017,33(10): 64-73.
[36]倪红军, 陈祥, 汪兴兴, 等. 微生物燃料电池中产电微生物的研究进展[J]. 现代化工, 2017, 37(3): 46-49.
NI Hongjun, CHEN Xiang, WANG Xingxing, et al. Progress research of electricigens in microbial fuel cell[J]. Modern Chemical Industry, 2017, 37(3): 46-49.
[37]王慧勇, 梁鹏, 黄霞, 等. 微生物燃料电池中产电微生物电子传递研究进展[J]. 环境保护科学, 2009, 35(1): 17-20.
WANG Huiyong, LIANG Peng, HUANG Xia, et al. Research progress in microbial fuel cells for electrons transfer of electricigens[J]. Environmental Protection Science, 2009, 35(1): 17-20.
[38]许志诚, 羅微, 洪义国, 等. 腐殖质在环境污染物生物降解中的作用研究进展[J]. 微生物学通报, 2006,33(6): 122-127.
XU Zhicheng, LUO Wei, HONG Yiguo, et al. Recent development in effects of the humic substances on the biodegradation of priority pollutants in environment[J]. Microbiology, 2006,33(6): 122-127.
[39]康丽, 郭建博, 廉静, 等. 介体厌氧催化活性艳红K-2BP脱色及构效特性研究[J]. 环境科学, 2011, 32(4): 1060-1065.
KANG Li, GUO Jianbo, LIAN Jing, et al. Catalyst effect and the structure-activity characteristics of redox mediators on the reactive brilliant red K-2BP decolorization[J]. Environmental Science, 2011, 32(4): 1060-1065.
[40]O′LOUGHLIN E J. Effects of electron transfer mediators on the bioreduction of lepidocrocite (γ-FeOOH ) by Shewanella putrefaciens CN32[J].Environmental Science & Technology, 2008, 42(18): 6876-6882.
[41]SHYU J B H, LIES D P, NEWMAN D K. Protective role of tolC in efflux of the electron shuttle anthraquinone-2,6-disulfonate[J]. Journal of Bacteriology, 2002, 184(6): 1806-1810.
[42]郭建博, 周集体, 王栋,等. 固定化蒽醌对偶氮染料生物降解促进作用研究[J]. 环境科学, 2006, 27(10):2071-2075.
GUO Jianbo, ZHOU Jiti, WANG Dong, et al. Accelerating effects of immobilized anthanquinone on the anaerobic biodegradation[J]. Environmental Science, 2006, 27(10): 2071-2075.
