高产葡萄糖酸黑曲霉菌株的诱变选育
2018-05-14白长胜孟维珊
白长胜 孟维珊


摘要:以一株产葡萄糖酸的黑曲霉为出发菌株,对其进行紫外线诱变处理,筛选得到一株产葡萄糖酸较高的菌株,产酸力比原始菌株提高了1. 16倍,经连续传代7代,产酸性能未出现较大的差异,具有较好的遗传稳定性。
关键词:黑曲霉;葡萄糖酸;紫外线诱变;产酸能力
中图分类号:TQ921.2
文献标识码:A
文章编号:2095-9737(2018)08-0001-02
葡萄糖酸及其衍生物(如葡萄糖酸盐、葡萄糖酸δ- 内酯)作为蓬松剂、凝固剂、鳌合剂、酸味剂而广泛应用于食品、化工、水处理、建材和医药等行业[1-2]。葡萄糖酸的生产方法包括发酵法、均相化学氧化法、电解氧化法和多相催化氧化法[3]。生物发酵法是当前国内生产葡萄糖酸最有竞争力的生产方法,具有发酵周期短、发酵过程易于控制、发酵液纯度高、产品易于提取、设备要求低等优点。能发酵葡萄糖产生葡萄糖酸的微生物很多,工业上主要使用黑曲霉发酵生产葡萄糖酸[4-5]。
紫外线诱变是一种使用最早、沿用最久且应用效果明显的诱变方法,该方法设备简单、操作方便、成本低廉、诱变频率高、诱变效果明显,迄今仍然是微生物育种中最常用和有效的诱变方法之一。本研究以筛选到的产葡萄糖酸性能较高的黑曲霉为出发菌株,利用紫外线诱变处理原始菌株,筛选得到产酸能力高、遗传性能稳定的突变菌株。
1 材料与方法
1.1 菌种
黑曲霉YS由黑龙江省畜牧研究说微生物实验室筛选并保藏。
1.2 培养基
1.2.1 斜面培养基
葡萄糖60 g/L,尿素0.2 g/L,KH2P04 0.13 g/L,MgS04.7H20 0.02 g/L,玉米浆l g/L,CaC035 g/L,琼脂25 g/L,pH值6.5~7.O,121℃,灭菌15 min。
1.2.2 平板培养基
葡萄糖250 g/L,尿素0.2 g/L,KH2P04 0.13 g/L,MgS04·7H20 0.02 g/L,玉米浆1 g/L,CaC03 10 g/L,琼脂18 g/L,pH值6.5~7.0,121℃,灭菌20 min。
1.2.3 种子培養基
葡萄糖240 g/L,尿素0.2 g/L,KH2 P040.64 g/L,玉米浆7.2 g/L,CaC03 10 g/L,pH值6.5~7.0,121℃,灭菌20 min。
1.2.4 发酵培养基
葡萄糖300 g/L,尿素0.1g/L,KH2 P040.02 g/L,MgS04·7H20 0.2g/L,CaC03 40 g/L,pH值6.5~7.0,121℃,灭菌20 min。1.3 试剂与仪器
试剂:葡萄糖,尿素,MgS04.7H20,KH2 P04,琼脂,CaC03,甲醇,磷酸。
仪器:摇床,培养箱,超净工作台,高压灭菌锅,磁力搅拌器,血球计数板,显微镜,高效液相色谱仪,pH计。
1.4 方法
1.4.1 单孢子悬液制备
黑曲霉YS作为出发菌株,用无菌水5 mL冲洗下培养好的新鲜斜面孢子,用玻璃珠打散,脱脂棉过滤,制得单孢子悬浮液,取0.5 mL用无菌生理盐水适当稀释后用平板菌落计数法测菌悬液浓度[6],调整孢子液浓度为每毫升l07~l08个孢子。
1.4.2 紫外诱变
取5 mL孢子悬液于直径5 cm培养皿中,加入自制转子,置于磁力搅拌器上,在15 W紫外灯下、距离30 cm分别照射不同时间,然后将处理液梯度稀释后取104稀释度菌悬液0.1 mL处理液涂布于分离培养基平板,35℃避光培养3~5天后,进行菌落计数。以未诱变菌液培养后的菌落数为基准计算不同诱变时间的致死率,绘制致死率曲线,确定诱变剂量并进行诱变。
致死率(%)=(对照皿的菌落总数诱变处理后的菌落总数)/对照皿的菌落总数×100%
1.4.3 突变株的筛选
初筛:将菌落周围溶圈直径与菌落直径比值较大的菌株挑至斜面上,纯化后进行复筛发酵。
复筛:挑取活化后的菌种接种于装有40 mL种子培养基的150 mL三角瓶中,38℃、200 r/min振荡培养24 h,然后取5 mL转接于装有100 mL发酵培养基的500 mL三角瓶中,38℃、300 r/min振荡培养24 h,滤纸过滤后测定发酵液中葡萄糖酸的含量,以原始菌株YS产葡萄糖酸量作为对照,选取产酸量较高的菌株。
1.5 葡萄糖酸含量的测定
过滤后的发酵液稀释100倍后,用HPLC测定葡萄糖酸含量。
HPLC检测条件:色谱柱为Amethyst C18 H(250 mm×4.6 mm,5 μm),流动相为甲醇:水:1%磷酸一50:450:500,流速1.O mL/min,检测波长210 nm,进样量10 μL。
1.6 菌株遗传稳定性实验
将诱变菌株连续传代7代后,7代菌株同时进行发酵实验,测定产酸量。
2 结果
2.1 紫外诱变剂量的选择
采用紫外线诱变方法将菌悬液用紫外线分别照射o、0.55、l、1.5、2、2.5、3、3.5、4、5 min后,通过平板菌落记数法计算致死率,绘制紫外照射致死率曲线,结果如图l所示。
紫外照肘o.5 min的致死率为43. 3%,1 rmn的致死率为75. 8%,1.5 min的致死率为88. 7%,2 min的致死率为95. 2%,2.5 min的致死率为99.7%,照射3 min及以上的致死率为100%。根据诱变育种的产量变异中大多倾向于采用较低剂量的原则[7],本试验选取致死率为80%的诱变剂量,将紫外诱变紫外线照射的时间取为1.5 min。
2.2 紫外诱变筛选
紫外照射后的菌株涂布平板,初筛后共挑取117株,经摇瓶复筛测产算量,以YS产葡萄糖酸量为100%,产酸量提高的菌株有61株,但多数提高幅度不大,其中6株突变株的产酸能力提高到YS诱变前的1.1倍以上,结果见表l。
2.3 菌株的遗传稳定性
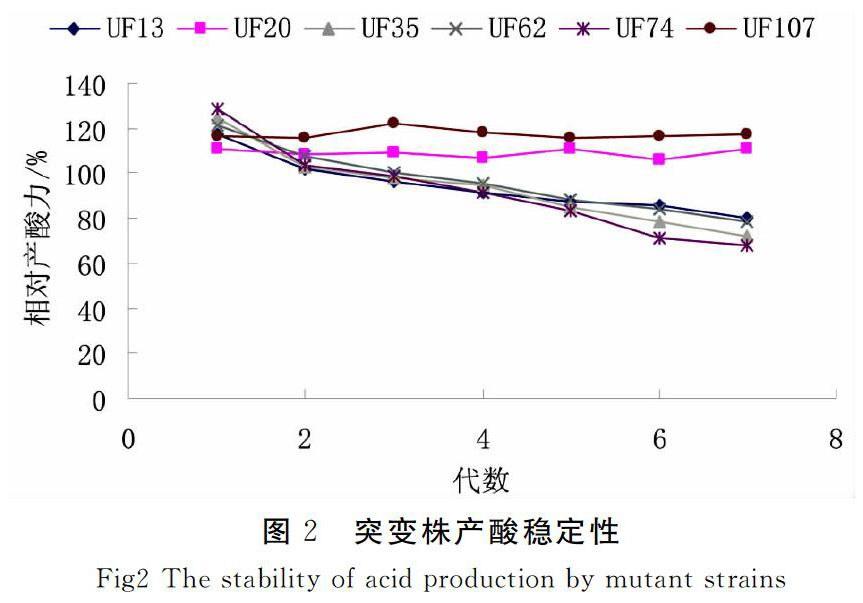
以诱变后产酸量提高明显的6株菌株为实验菌种,在斜面上连续传代7代,将所有代次菌株接种摇瓶发酵,测定产酸量,绘制突变株产酸稳定性曲线,结果如图2。
Fig2 The stability of acid production by mutant strains
由图2可知,而菌株UF13、UF35、UF62和UF74的产酸不够稳定,随着代数增加它们的产酸能力均有所下降。菌株UF20和UF107产酸性能基本稳定,表明二者遗传稳定性良好。UF107的产酸性能优于UF20,因此选用菌株UF107作为以后发酵产酸的出发菌株。
3 讨论
葡萄糖酸与碳酸钙反应在平板上形成透明圈,本研究采用透明圈法作为初步判定菌株产酸能力强弱的依据。一般认为透明圈直径比与产酸量呈现正相关性。透明圈越大,产酸越多;透明圈出现得越早,产酸越快,在实验中筛选得到的多数突变菌株产酸能力符合这种正相关性。采用这种初筛方法大大提高了筛选效率。
本试验通过紫外线诱变处理黑曲霉原始菌株YS,最终筛选得到一株产葡萄糖酸能力提高且性状稳定的菌株UF107,产酸力是原始菌株1.16倍。
参考文献:
[1]谢冬梅,韦礼宁,周朝晖,等,葡萄糖酸系列产品的研制[J].广西化工,2000,9(1):17-19.
[2] SUMITRA RAMACHANDRAN, PIERRE FONTANILLE,ASHOK PANDEY. Gluconic Acid: Properties, Applicationsand Microbial Production[J]. Biotechnol, 2006, 442: 185- 195.
[3]郭凤华,刘昌俊,葡萄糖酸合成方法研究进展[J].化學丁业与工程,2007,24(2):173-177.
[4] SINGH OV, RAJ KUMAR. Biotechnological production of glu-conic acid: future implications[J]. Appl Microbiol Biotechnol,2007(75):713-722.
[5]金其荣,张维民,徐勤,有机酸发酵工艺[M].北京:轻工业出版社,1989.
[6]沈萍,微生物学[M].北京:高等教育出版社,2000:231- 232.
[7]周德庆,微生物学教程[M].北京:高等教育出版社,2002:217.
