干燥方式对辣木叶营养活性成分、抗氧化活性及色泽的影响
2018-05-14林羡徐玉娟肖更生邹波唐道邦余元善吴继军
林羡 徐玉娟 肖更生 邹波 唐道邦 余元善 吴继军
摘 要 以辣木叶为研究对象,考察热风干燥、真空微波干燥及真空冷冻干燥等脱水方式对辣木叶营养活性成分、抗氧化活性及色泽的影响。结果表明,不同干燥方法均会引起辣木叶酚类物质、维生素C、异硫氰酸酯、多糖类物质等营养活性成分的损失,以及色泽的劣变和叶绿素的降解,并造成美拉德反应产物5-羟甲基糠醛(5-hmf)的累积。然而,通过真空微波干燥和冷冻干燥能有效避免辣木叶氧自由基清除能力的下降。不同的干燥方式各有利弊。其中冷冻干燥能较好地保持辣木叶中的维生素C、叶绿素,真空微波干燥能较好地减少酚类物质、多糖类物质等活性成分和抗氧化活性的损失并减少5-hmf的累积。对于热风干燥,热风温度对辣木叶品质的影响显著,适宜的温度有助于γ-氨基丁酸、异硫氰酸酯、多糖类物质等活性成分的保留。综合考虑干燥方式对辣木叶品质的影响及干燥效率,选择真空微波干燥作为最适宜的辣木叶干燥方式。
关键词 辣木叶;干燥方式;营养活性成分;抗氧化性;色泽中图分类号 TS255 文献标识码 A
DOI10.3969/j.issn.1000-2561.2018.12.020
辣木(Moringa oleiferaLam.)为辣木科辣木属多年生植物,广泛种植于非洲、亚洲西南部以及南美洲等地。辣木的叶、果实、花、种子等部位均含有丰富的营养[1]。辣木叶具有高蛋白质、高钙、高钾、高镁、高纤维、高维生素、低脂肪、低胆固醇等特点[2]。此外,辣木叶中还含有异硫氰酸苄酯、黄酮醇和酚酸等丰富的天然活性成分[3-5],并被确证具有抗氧化、降血糖、抑制病菌、抑制癌细胞等功效[6-9],适宜用于功能性食品的研发。
辣木叶采后容易腐烂变质,不耐贮藏。将辣木叶干燥制粉,除了可以有效延长辣木叶的保藏期、减少运输成本外,还能增加产品的应用范围,作为配方生产多种健康食品。然而干燥及制粉加工,会不可避免地引起原料的活性成分损失、色泽劣变等问题[10-11]。目前,关于干燥方式对辣木叶品质,尤其是对其营养活性成分影响的研究十分有限。Saini等[12]研究了热风干燥、微波干燥、冻干及晒干等方式对辣木叶类胡萝卜素成分、维生素C、α-生育酚及总酚含量的影响。郭刚军等[13]研究了阴干、晒干、热风干燥、微波干燥及远红外干燥对辣木叶维生素组成、氨基酸组成、黄酮、总酚及多糖等成分的影响。Wangcharoen等[10]研究了热风烘干过程辣木叶抗氧化活性、色泽及总酚含量的变化情况。然而γ-氨基丁酸和异硫氰酸酯等在辣木叶含量较高的重要营养活性成分的变化并未见报道。真空微波干燥是将真空干燥和微波干燥两项技术结合起来[14],能在较低的温度下实现快速脱水,其在辣木叶干燥中的应用也未见报道。
因此本文综合比较热风干燥、冷冻干燥以及真空微波干燥等不同干燥方式对辣木叶酚类组分、γ-氨基丁酸、维生素C、异硫氰酸酯、多糖等营养活性成分,以及抗氧化活性和色泽等品质的影响,为辣木粉功能性食品基料生产技术的研发奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 辣木叶由东莞市圣茵城市景观农业工程研究中心种植园提供。挑选成熟度一致、颜色均一的叶片用于干燥实验。
1.1.2 试剂 绿原酸、芦丁、山奈酚、槲皮素、γ-氨基丁酸、维生素C、5-羟甲基糠醛标准品(上海源叶生物科技有限公司),异硫氰酸烯丙酯标准品(Sigma-aldrich公司)。
1.2 仪器与设备
1.2.1 干燥设备 101-3-ABS型电热鼓风干燥箱:上海科恒科技实业有限公司;RX-10ZK真空微波干燥机:广州荣兴工业微波设备有限公司;ST85B3-1真空冷冻干燥机:美國Milirock公司。
1.2.2 实验仪器 荧光分光光度计:德国heraeus有限公司;LC-20A高效液相色谱仪:日本岛津公司;UltraScan VIS CIE标准可见光范围色差仪:美国Hunter Lab公司;UV-1800紫外可见分光光度计:日本岛津公司;Sorvall Stratos高速冷冻离心机:美国Thermo Scientific公司。
1.3 方法
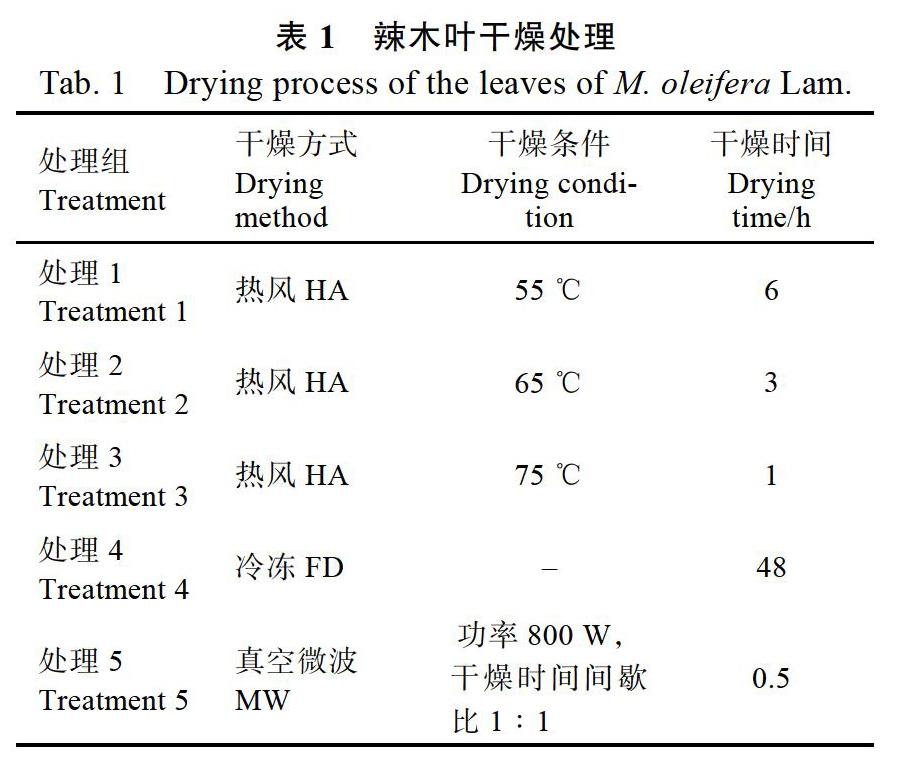
1.3.1 辣木叶的干燥 如表1所示,采用5种干燥条件将辣木叶脱水至含水量为(5±0.5)%,用粉碎机打碎成粉末,用于品质测定。对照组为辣木叶新鲜样品。
1.3.2 相关指标的测定 (1)酚组分的测定:参考Valdez-Solana等[1]的方法。酚组分的提取:精确称取辣木叶粉1 g,加20 mL 75%(V/V)乙醇,充分摇匀,超声30 min,5 000 r/min离心5 min后,收集上清液;于沉淀中再次加入20 mL 75%(V/V)乙醇,充分摇匀,超声30 min,5 000 r/min离心5 min后,收集上清液;集合2次收集的上清液,用75%(V/V)乙醇定容至50 mL,0.22 μm 滤膜过滤,用于HPLC分析。
HPLC分析条件。色谱柱:Wondasil C18柱(250 mm×4.6 mm,5 μm,日本岛津);流动相A为4%的磷酸溶液,流动相B为乙腈。梯度洗脱程序如下:0~10 min,8% B;10~55 min,8%~18% B;55~55.01 min,18%~70% B;55.01~ 60 min,70% B;60~60.01 min,70%~8% B;60.01~66 min,8% B;每个样品之间平衡5 min,进样量20 μL,流速1 mL/min,检测波长520 nm,柱温40 ℃。采用外标法定量分析单个花色苷的含量。
(2)γ-氨基丁酸(GABA)的测定:参考程威等[15]的方法。GABA的提取:准确称取辣木叶粉1 g,沸水浴提取1 h,过滤,定容至100 mL。
衍生化反应:取辣木叶提取液100 μL于样品瓶中,加入邻苯二甲醛衍生液500 μL,涡旋振荡5 s,静置2 min后,过0.45 μm滤膜,进样。
HPLC分析条件:色谱柱为KinetexC18柱(4.6 mm ×150 mm,2.6 μm);流动相A为25 mmol/L的乙酸钠,用4%的乙酸调pH至5.85~ 5.95;流动相B为乙腈。流速:0.4 mL/min。检测波长332nm,进样量10 μL,柱温40 ℃。洗脱程序如下:0~30 min,10%~60% B;30~35 min,60% B;35~40 min,60%~10% B。
(3)维生素C含量的测定:参考Wang等[16]的方法。准确称取辣木叶粉0.5 g,加入适量2%草酸,充分研磨后过滤。取样品滤液5 mL,加入0.2 g已处理好的活性炭,充分振摇后过滤。然后分别吸取已氧化处理的样品滤液1 mL于A管(样品管)、B管(样品空白管)。在A管中加入250 g/L乙酸钠溶液1 mL,在B管中加入30 g/L硼酸-250 g/L 乙酸钠溶液1 mL,充分混匀,暗处反应20 min。在避光条件下,分别于A、B管准确迅速地向各试管加入1 mL 0.2 g/L邻苯二胺溶液,充分混匀,在暗室中避光反应40 min后测定荧光强度。测定条件为:激发波长355 nm,发射波长425 nm,两端狭缝均为5 nm;样品荧光强度减去样品空白荧光强度,得到相对的荧光强度。
(4)异硫氰酸酯含量测定:参考丁轲等[17]的方法。异硫氰酸酯的提取:准确称取辣木叶粉0.5 g,加pH 6.87的磷酸缓冲液浸提(料液比为1∶20);水浴45 ℃,1.5 h,搅拌,冷却,6 000 r/min离心10 min,取滤渣;石油醚萃取3次;40 ℃真空浓缩至干燥,待测。
异硫氰酸酯的测定:50%(V/V)乙醇将提取出来的异硫氰酸酯粗提物复溶,定容至100 mL,以50%(V/V)乙醇为空白,在243 nm波长处测定吸光值。以异硫氰酸烯丙酯作为标准品绘制标准曲线。结果以每克干基所含异硫氰酸烯丙酯当量表示。
(5)多糖含量的测定。多糖的提取:精确称取1.0 g辣木叶粉,以蒸馏水为提取液,料液比为1∶25,依次经超声600 W提取60 mim、60 ℃水温浸提60 min后,4 500 r/min离心10 min,取上清液浓缩定容至50 mL。取10 mL上述多糖提取液,加40 mL无水乙醇,4 ℃静止过夜,然后4 500 r/min离心10 min,取沉淀。蒸馏水溶解沉淀并定容至50 mL。多糖含量的测定采用苯酚-硫酸法。
(6)5-羟甲基糠醛(5-hmf)的测定:参考万鹏[18]的方法。5-hmf的提取:准确称取辣木叶粉0.5 g,加入10 mL 50%(V/V)乙醇,超声提取(300 W)1 h后,5 000 r/min离心10 min,取其上清液,加入50%的乙醇,定容至25 mL,过0.45 μm有机滤膜。
HPLC分析条件:色谱柱Agilent Zorbax Eclipse XDB-C18(4.6 mm×250 mm,5 μm),柱温30 ℃;紫外检测,波长为280 nm;用10%甲醇和90%水(含1%乙酸)混合液作流动相,流速0.6 mL/min;进样量10 μL.
1.4 数据处理
每个实验重复3次。结果表示为平均值±标准偏差。应用SPSS 19.0软件对所有数据进行方差分析(ANOVA),用Duncan多重比较分析差异的显著性。计算最小显著差数LSD(p<0.05)值。
2 结果与分析
2.1 干燥方式对辣木叶酚类物质成分的影响
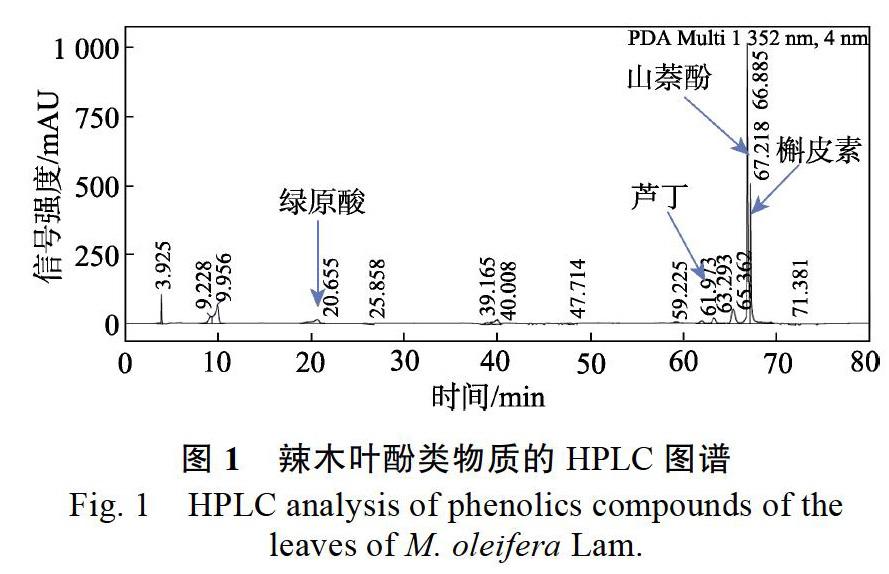
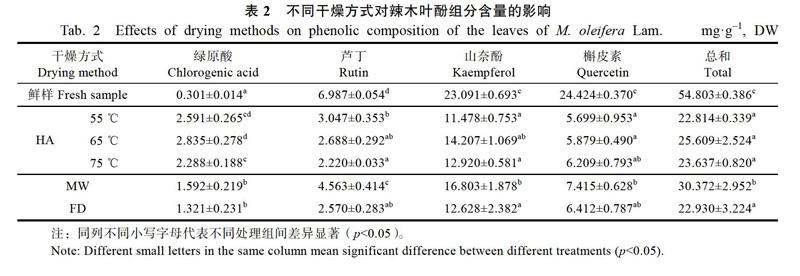
采用高效液相色谱对辣木叶的多酚类化合物进行分离,得到HPLC图谱(图1),通过标准品鉴定得到主要的多酚类化合物为绿原酸、芦丁、山奈酚和槲皮素。表2为不同干燥方式对辣木叶酚组分含量的影响。结果表明,鲜样中山奈酚和槲皮素为辣木叶的主要酚类物質,其含量显著高于绿原酸含量和芦丁的含量。与鲜样相比,所有干燥处理组的芦丁、山奈酚和槲皮素含量均显著下降,其中槲皮素含量损失最大,达70%以上。而绿原酸含量则在干燥后显著增加。经热风干燥处理后,辣木叶中山奈酚和槲皮素的差异不显著,但是热风干燥温度的提高会导致芦丁含量的损失加大和绿原酸产物的增加。比较不同干燥方式对辣木叶中酚组分的影响发现,真空微波干燥处理组的芦丁和山奈酚含量最高,而真空微波干燥处理和冷冻干燥处理组的绿原酸生成量均显著低于热风干燥处理组。比较4种主要酚类物质含量的总和发现,热风不同温度的干燥处理组和冷冻干燥处理组的总酚含量差异不显著。而真空微波干燥的辣木叶总酚保留率较高,其含量比热风干燥

2.2 干燥方式对辣木叶其他主要营养活性成分的影响
除了多酚类化合物,辣木叶中还具有GABA、维生素C、叶绿素、异硫氰酸酯类、多糖类等多种重要活性成分。不同干燥方式对辣木叶中活性成分的影响如表3所示。GABA是哺乳动物神经系统中枢中最重要的抑制性神经递质,还具有降血压、降低胆固醇、改善脑机能、抗惊厥、预防和调治癫痫等多种生理活性及保健功能。结果表明,干燥后,辣木叶中GABA的含量为23.234~ 28.096 mg/g(DW),显著高于发芽糙米[15]中GABA的含量,表明辣木叶中含有丰富的GABA。不同干燥处理组中,热风干燥温度为55和65 ℃时,所得辣木叶中的GABA含量无显著性差异,并显著高于75 ℃处理组的含量,表明过高的热风干燥温度会导致GABA损失。采用真空微波干燥和冷冻干燥后,样品的GABA含量分别为(25.749±1.036) mg/g(DW)和(24.085± 1.065) mg/g(DW),与热风干燥65 ℃处理组相比含量较低。
维生素C又称抗坏血酸,是维持人体正常生理代谢的一种重要化合物,维生素C具有防治缺铁性贫血,预防白内障和心血管疾病功能,提高人体的免疫力等功效。结果表明,冷冻干燥处理组的维生素C含量显著高于其他处理组,并与鲜样的含量无显著性差异,表明冷冻干燥可以有效避免维生素C在辣木叶脱水过程中的损失。其次是真空微波干燥,这可能与真空微波干燥处理时间短,从而减少维生素C的损失有关。
异硫氰酸酯具有抗菌、抗肿瘤、抗氧化等多种药理作用。结果表明,新鲜辣木叶的总异硫氰酸酯含量为(8.879±0.864) mg/g(DW)。干燥后,总异硫氰酸酯含量下降37%~65%。3种不同热风干燥方式相比,热风干燥能较好地保留异硫氰酸酯类物质,而冷冻干燥处理组的异硫氰酸酯类含量最低。
多糖作为生命活动的四大类基本组成物质之一,具有抗氧化、抑菌、降血糖、抗肿瘤及增强免疫等多种生物活性,参与机体的多项生命活动。辣木叶经55 ℃热风干燥处理后,总多糖含量与鲜样无显著性差异,表明该条件下能有效保留多糖类物质。当温度为75 ℃时,总多糖含量下降率达40.81%。真空微波干燥处理组中的总多糖含量也较高,而冷冻干燥处理组的则显著较低。
2.3 干燥方式对辣木叶抗氧化活性的影响
2.3.1 DPPH自由基清除能力 如图2所示,比较不同干燥处理组的DPPH EC50值可见,干燥后辣木叶的DPPH EC50值在2.08~2.44 mg/mL(DW)范围内。当热风干燥温度为65和75 ℃时,辣木叶的DPPH EC50值显著高于热风55 ℃处理组,表明热风温度的升高导致了辣木叶DPPH自由基清除能力的下降。冷冻干燥组的DPPH EC50值也显著高于热风55 ℃处理组。
2.3.2 氧自由基清除能力 图3表明,新鲜辣木叶的ORAC值为(741.61±56.52) mmol Trolox eq./ kg (DW)。不同干燥方式对辣木叶ORAC值的影响显著,其中真空微波干燥处理组和冷冻干燥处理组的ORAC较高,并且与鲜样的ORAC值相比没有显著性差异,表明这2种干燥方法能有效地避免辣木叶氧自由基清除能力的损失。而热风干燥处理组的ORAC值则显著较低。当热风温度为65和75 ℃时,辣木叶的ORAC值下降到不足鲜样ORAC值的50%,氧自由基清除能力大大降低。

2.4 干燥方式对辣木叶色泽的影响
色泽是评价果蔬干制产品品质的重要指标之一,食品在干燥过程中常常伴随着褐变反应,从而造成产品色泽的显著变化。如表6所示,实验采用L*值、a*值和b*值来表征色泽。其中L*值表示样品的白度,a值正值表示偏红,负值表示偏绿;b值正值表示偏黄,负值表示偏蓝。结果表明(表4),与鲜样品相比,热风干燥75 ℃处理组的白度、绿度和黄度均显著下降,其中绿度值下降幅度最大,达35%。热风干燥其他温度处理组的L值和b*值则与鲜样差异不显著。由此可见,热风干燥处理时,温度的升高加重辣木叶色泽的劣变。真空微波处理组和冷冻干燥处理组的辣木叶色泽则与鲜样差异不大。
叶绿素是辣木叶中绿度呈色的主要物质。如表4所示,经干燥处理后,辣木叶中的叶绿素含量大幅度下降,损失达78%以上。结果表明,对于热风干燥而言,温度对叶绿素含量的影响显著。随着温度的增加,叶绿素的损失率显著增加。冷冻干燥处理组的叶绿素含量较高。而真空微波处理组的叶绿素含量则偏低,其原因可能是真空微波干燥过程中,干燥腔体温度分布的不均匀性导致了局部样品受热过多,从而导致叶绿素含量的损失增加。
5-hmf是美拉德反应的中间产物,其含量可以反映出产品发生美拉德反应的程度。结果表明,辣木叶经干燥处理后,5-hmf均显著上升,表明不同干燥方式都会引发一定程度的美拉德反应。其中,真空微波干燥处理组的5-hmf生成量最少,这可能与其处理时间最短有关。
色泽变化的影响因素较多,干燥过程中的酶促和非酶促反应程度不同、叶绿素的降解、维生素C的氧化、美拉德反应均会影响产品的色泽。结果表明(表4),5-hmf含量和叶绿素含量均不显示与L*、a*、b*等色澤指标具有显著相关性,表明辣木叶干燥后色泽的变化是多因素共同影响的结果。
3 讨论
本研究综合考虑了不同干燥方式对辣木叶酚类组分、γ-氨基丁酸、维生素C、异硫氰酸酯、多糖等营养活性成分的影响。在酚类组分方面,通过高效液相色谱测得辣木叶主要的多酚类化合物为绿原酸、芦丁、山奈酚和槲皮素,其中山奈酚和槲皮素含量较高,这与Valdez-Solana[1]、Siddhuraju等[22]的结果一致。郭刚军[13]比较热风干燥和微波干燥的差异时,发现不同处理方式所得辣木叶总酚含量尽管有差异,但差异不大于10%。本研究中真空微波干燥的辣木叶总酚保留率比热风干燥处理组和冷冻干燥处理组的高约20%,可见,微波干燥结合真空处理显著提高了
辣木叶中的总酚保留率。在维生素C方面,不同热风干燥温度处理组的维生素C含量均较低,这与Saini[12]、马李一等[23]的结果一致,表明热风干燥会造成维生素C较大的损失,其原因可能是热风干燥耗时较长,促进了维生素C被空气中的氧所氧化。其中热风55 ℃处理组的最低,这可能是因为该条件下干燥时间最长,也可能与热风温度升高有助于快速抑制抗坏血酸氧化酶活性有关。在多糖方面,辣木叶经55 ℃热风干燥处理后,总多糖含量与鲜样无显著性差异;当温度为75 ℃时,总多糖含量下降率达40.81%。该结果与李忠虎等[24]的结果一致,表明随着热风干燥温度的增加,辣木叶中的总多糖含量显著下降,
在研究不同干燥方式对辣木叶抗氧化活性方面,发现采用DPPH自由基清除能力与氧自由基清除能力2种方法评价辣木叶的抗氧化活性的结果存在一定的差异。采用DPPH自由基清除能力评价时,发现冷冻干燥组的抗氧化能力显著低于热风55 ℃处理组,这与Saini等[12]的结果一致。Wangcharoen等[10]的结果表明,对于热风干燥而言,干燥辣木叶DPPH自由基清除能力与其褐变程度呈显著正相关,也与辣木叶中酚类物质等天然抗氧化活性成分的保留率有关。由此可推测,热风55 ℃处理组的抗氧化活性比冻干处理组的高,这可能与热风干燥过程美拉德反应产物的积累有关。
综合分析不同干燥方式对辣木叶品质的影响结果,发现不同干燥方式均会引起辣木叶酚类物质、维生素C、异硫氰酸酯、多糖类物质等活性成分以及色泽的损失,并造成美拉德反应产物5-hmf的累积。然而,不同的干燥方式各有利弊。其中,真空微波干燥能较好地减少酚类物质、多糖类物质等活性成分和抗氧化活性的损失,同时减少5-hmf的累积,但其处理样品叶绿素含量偏低,所得干燥辣木叶的总体品质较高。考虑到真空微波干燥还有脱水效率高的特点,因此选择真空微波干燥作为最适宜的辣木叶干燥方式。通过真空微波干燥参数的优化,将有望在此基础上进一步提高干燥辣木叶的品质,实现辣木叶干的节能高效生产。
参考文献
- Valdez-Solana M A, Mejía-García V Y, Téllez-Valencia A, et al. Nutritional content and elemental and phytochemical analyses of Moringa oleifera grown in Mexico[J]. Journal of Chemistry, 2015, 2015: 1-9.
- 刘凤霞, 王苗苗, 赵有为, 等. 辣木中功能性成分提取及产品开发的研究进展[J]. 食品科学, 2015, 36(19): 282-286.
- Waterman C, Cheng D M, Rojassilva P, et al. Stable, water extractable isothiocyanates from Moringa oleifera leaves attenuate inflammation in vitro[J]. Phytochemistry, 2014, 103(10): 114-122.
- F?rster N, Ulrichs C, Schreiner M, et al. Development of a reliable extraction and quantification method for glucosinolates in Moringa oleifera[J]. Food Chemistry, 2015, 166: 456-464.
- Vyas S, Kachhwaha S, Kothari S L. Comparative analysis of phenolic contents and total antioxidant capacity of Moringa oleifera Lam[J]. Pharmacognosy Journal, 2014, 7(2): 44-51.
- Abalaka M E. The antibacterial evaluation of Moringa oleifera leaf extracts on selected bacterial pathogens[J]. Journal of Microbiology Research, 2012, 2(2): 1-4.
- Suphachai C. Antioxidant and anticancer activities of Moringa oleifera leaves[J]. Journal of Medicinal Plant Research, 2014, 8(7): 318-325.
- Ghiridhari V V A, Malhati D, Geetha K. Anti-diabetic properties of drumstick (Moringa oleifera) leaf tablets[J]. International Journal of Health Nutrition, 2011, 2(1).
- Ghosh N. Anticancer effect of Moringa oleifera leaf extract on human breast cancer cell[D]. India: Jadavpur University, 2014.
- Wangcharoen W. Antioxidant activity changes during hot-air drying of Moringa oleifera leaves[J]. Maejo International Journal of Science and Technology, 2013, 7(3): 353-363.
- Nunes J C, Lago M G, Castelo-Branco V N, et al. Effect of drying method on volatile compounds, phenolic profile and antioxidant capacity of guava powders[J]. Food Chemistry, 2016, 197(Pt A): 881-890.
- Saini R K, Shetty N P, Prakash M, et al. Effect of dehydration methods on retention of carotenoids, tocopherols, ascorbic acid and antioxidant activity in Moringa oleifera leaves and preparation of a RTE product[J]. Journal of Food Science and Technology, 2014, 51(9): 2 176-2 182.
- 郭刚军, 胡小静, 徐 荣, 等. 不同干燥方式对辣木叶营养、功能成分及氨基酸组成的影响[J]. 食品科学, 2018, 39(11): 39-45.
- 江 宁, 刘春泉, 李大婧, 等. 甘薯片真空微波干燥工艺的优化[J]. 中国食品学报, 2011, 11(7): 81-88.
- 程威威, 周 婷, 吴 跃, 等. 高效液相色谱法测定发芽糙米中γ-氨基丁酸含量[J]. 食品科学, 2014, 35(12): 98-101.
- Wang C, Chen Y, Yujuan X U, et al. Effect of dimethyl dicarbonate as disinfectant on the quality of fresh-cut carrot (Daucus Carota, L.)[J]. Journal of Food Processing and Preservation, 2013, 37(5): 751-758.
- 丁 轲, 刘 佳, 陈湘宁, 等. 响应面优化辣根中总异硫氰酸酯及异硫氰酸烯丙酯水解制备工艺[J]. 中国食品学报, 2015, 15(10): 124-133.
- 万 鹏. 荔枝果汁非酶褐变机理研究[D]. 武汉: 华中农业大学, 2010.
- 马 瑞, 张钟元, 赵江涛, 等. 超声辅助烫漂对黄花菜干制品色泽的影响[J]. 现代食品科技, 2016(10): 233-238.
- Lin X, Chen J, Xiao G, et al. Extraction, molecular weight distribution, and antioxidant activity of oligosaccharides from longan (Dimocarpus Longan, Lour.) pulp[J]. Food Science and Biotechnology, 2016, 25(3): 701-706.
- Yu Y, Xu Y, Wu J, et al. Effect of ultra-high pressure homogenisation processing on phenolic compounds, antioxidant capacity and anti-glucosidase of mulberry juice[J]. Food Chemistry, 2014, 153(12): 114-120.
- Siddhuraju P, Becker K. Antioxidant properties of various solvent extracts of total phenolic constituents from three different agroclimatic origins of drumstick tree (Moringa oleifera Lam.) leaves[J]. Journal of Agricultural and Food Chemistry, 2003, 51(8): 2 144.
- 馬李一, 余建兴, 张重权, 等. 不同干燥方法对辣木叶营养价值的影响[J]. 食品科学, 2008, 29(9): 331-333.
- 李忠虎, 蔺海明, 陈 垣, 等. 不同干燥方式对党参多糖含量的影响[J]. 甘肃农业大学学报, 2007, 42(3): 64-67.
