忽地笑α-葡萄糖苷酶2编码基因的分子克隆与原核表达
2018-05-14李宜奎等
李宜奎等


摘要 {目的]克隆忽地笑{Lycorisaurea(LHér.)Herb.]α-葡萄糖苷酶2编码基因。{方法]基于忽地笑的转录组数据库,分析功能注释为α-葡萄糖苷酶2的基因片段,通过设计特异性定量PCR扩增引物分析其在各组织中的表达丰度,利用RACE(rapidamplificationofcDNAends)技术从高丰度组织中克隆获得忽地笑α-葡萄糖苷酶2编码基因。{结果]忽地笑α-葡萄糖苷酶2编码基因LauAgl2cDNA全长3185bp,开放阅读框为2961bp,编码含有986个氨基酸残基的LauAgl2蛋白质。LauAgl2蛋白质氨基酸序列具有α-葡萄糖苷酶Ⅱ特征性的保守结构域和天冬氨酸残基组成的活性中心,还具有一些蛋白质糖基化的潜在位点(N-X-S/T共有序列)。LauAgl2蛋白质与油棕、陆地棉等其他植物的α-葡萄糖苷酶2的氨基酸序列一致性为73.0%以上。利用pET表达系统,可以在大肠杆菌中实现LauAgl2蛋白质的诱导表达。{结论]成功从忽地笑花葶和花瓣中克隆到α-葡萄糖苷酶2编码基因LauAgl2并在大肠杆菌中对LauAgl2进行了异源表达,为LauAgl2蛋白质的功能鉴定及其在忽地笑种子萌发与生长发育中的作用研究奠定了基础。
关键词 忽地笑;α-葡萄糖苷酶2;分子克隆;原核表达
中图分类号S 188文献标识码
A文章编号0517-6611(2018)36-0078-05
α-葡萄糖苷酶(EC3.2.1.20)在植物种子萌发过程中具有重要的生理作用。α-葡萄糖苷酶参与植物种子萌发过程中淀粉的水解,产生为胚芽生长提供能量的物质{1]。在这过程中,α-葡萄糖苷酶作用于淀粉水解产生的麦芽糖及麦芽寡糖,生成游离的葡萄糖{2-3]。植物α-葡萄糖苷酶活性的降低会影响种子萌发过程中淀粉代谢,导致麦芽糖积累,阻止种子萌发{4]。拟南芥α-葡萄糖苷酶的缺失影响了细胞内纤维素合成酶机器中的部分N-糖蛋白的功能性糖基化修饰,使得细胞壁中主要结构组分——纤维素严重下降,从而导致早期胚胎径向膨胀,影响拟南芥早期胚胎的形态发生{5]。因此,克隆α-葡萄糖苷酶编码基因并进行深入研究对阐明其在植物种子萌发过程中的生理作用及其调控机制具有重要意义。
忽地笑{Lycorisaurea(LHér.)Herb.]是石蒜科石蒜属多年生草本球根药用植物,富含加兰他敏、石蒜碱等石蒜科植物所特有的一类生物碱{6]。加兰他敏是唯一在临床上得到应用的石蒜科生物碱,作为一种长效的、选择性的、可逆的、竞争性的乙酰胆碱酯酶抑制剂{7],其在临床上用于治疗老年痴呆症{8]。忽地笑不仅通过鳞茎进行无性繁殖,而且可以通过种子进行有性生殖,是加兰他敏工业生产的良好原料{9]。基于忽地笑的转录组数据库{10],笔者从中筛选出α-葡萄糖苷酶候选基因片段,利用RACE方法克隆到了忽地笑α-葡萄糖苷酶2编码基因,并对其进行了生物信息学分析和原核表达分析等研究,为理解α-葡萄糖苷酶2在忽地笑种子的萌发、生长与发育过程中的作用奠定了基础。
1材料与方法
1.1材料该研究所用忽地笑植株采自江苏省中国科学院植物研究所药用植物种质资源圃(库)。大肠杆菌TOP10和BL21(DE3)分别用于基因克隆和原核表达,为笔者所在实验室保存;原核表达载体pET28a购自Novagen公司;pMD19-T、T4DNAligase、PrimeScriptTMRTreagentKitwithgDNAEraser(PerfectRealTime)反转录试剂盒和限制性内切酶购自宝生物工程(大连)有限公司;SMARTerTMRACEcDNAAmplificationKit购自Clontech公司;
1.2RNA的提取称取忽地笑组织约0.1g,于液氮中充分研磨,具体参照钱彬彬等{11]的方法提取RNA以及检测RNA的纯度与完整性。
1.3组织中基因丰度分析
称取花期忽地笑的根、花柱、花葶、花苞、子房、花瓣和雄蕊及盛叶期忽地笑的叶片,液氮速冻后提取忽地笑不同组织的RNA,然后利用反转录酶获得忽地笑不同组织的cDNA;利用忽地笑内参基因TIP41{12]和α-葡萄糖苷酶候选基因CL6740的特异性引物(表1),以各组织cDNA为模板,进行实时定量PCR。PCR程序为95℃预变性5min;95℃变性15s,56℃退火15s,72℃延伸20s,共40个循环。每个样品均进行3次重复试验。利用2-ΔΔCt法计算忽地笑不同组织中α-葡萄糖苷酶候选基因的丰度。
1.4全长cDNA的克隆
基于忽地笑的轉录组数据库{10],选择功能注释为α-葡萄糖苷酶2的基因片段,设计该片段的克隆引物以及5′端和3′端的RACE(rapidamplificationofcDNAends)引物(表1)。RACE扩增程序为95℃预变性5min;95℃变性45s,56℃退火45s,72℃延伸120s,共30个循环;72℃充分延伸10min。PCR产物用琼脂糖凝胶电泳检测并用胶回收试剂盒回收;回收片段连接pMD19-T载体,并转化大肠杆菌TOP10感受态细胞;菌落PCR验证后,挑取阳性克隆子测序。
根据片段间的重叠区域拼接基因序列,获得全长cDNA序列;利用在线软件ORFfinder(http:∥www.ncbi.nlm.nih.gov/projects/gorf/)预测开放阅读框(openreadingframe,ORF),根据ORF序列设计引物LauAgl2-ORF-PF和LauAgl2-ORF-PR(表1)扩增LauAgl2的编码区。目标PCR扩增产物通过切胶回收,连接克隆载体pMD19-T,转化大肠杆菌TOP10感受态细胞;经菌落PCR验证后,挑取阳性克隆子测序,保存测序正确的重组菌株并提取质粒,获得重组质粒pMD-LauAgl2。
1.5生物信息学分析
利用在线程序BLASTp(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi)比对分析氨基酸序列;利用BioEdit软件{13]和ClustalW程序分别进行氨基酸序列的联立与比对分析;利用PROSITE(http:∥prosite.expasy.org)数据库对LauAgl蛋白进行功能结构预测;利用Protter(http:∥wlab.ethz.ch/protter/start/)分析氨基酸序列的信号肽及糖基化位点{14]。
1.6LauAgl2的原核表达及SDS-PAGE电泳检测
质粒pET28a利用限制性内切酶NdeⅠ和XhoⅠ进行双酶切;利用引物对pET28a-LauAgl2-PF和pET28a-LauAgl2-PR(表1)扩增获得LauAgl2的编码序列(LauAgl2);利用OneStepCloningKit将LauAgl2组装到pET28a质粒的NdeⅠ与XhoⅠ位点之间,获得pET28a-LauAgl2,经测序正确后提取质粒并连同空载体pET28a转化至大肠杆菌BL21(DE3)感受态细胞中,挑取阳性克隆子进行原核表达分析。
将构建的重组菌株接种于3mLLB液体培养基中,过夜培养,然后按1%的接种量将菌液转接入50mLLB液体培养基中,于37℃、200r/min培养至A600达0.6~0.8,吸取菌液1mL,并加入终浓度0.1mmol/L异丙基硫代半乳糖苷(IPTG)进行诱导表达24h;菌液于12000r/min离心5min,弃上清液,加入200μL无菌水重悬菌体,加入50μL5×SDS上样缓冲液,沸水浴10min,室温下12000r/min离心10min;取20μL上清液进行SDS-PAGE蛋白电泳分析。
2结果与分析
2.1α-葡萄糖苷酶2候选基因在忽地笑不同组织中的丰度
基于忽地笑的转录组数据库{10],根据注释为α-葡萄糖苷酶2的基因片段CL6740序列设计特异性定量PCR扩增引物,以忽地笑TIP41基因为内参基因{12],采用实时定量PCR的方法分析α-葡萄糖苷酶候选基因在忽地笑不同组织中的丰度(图1)。CL6740基因片段在忽地笑的鳞茎、根、叶、花柱、花葶、花苞、子房、花瓣和雄蕊中均有表达,且在花葶和花瓣中的丰度较高,在雄蕊中的丰度次之,其余组织中的丰度相对较低。这说明CL6740基因片段在忽地笑中的表达具有一定的组织特异性。
2.2忽地笑α-葡萄糖苷酶2编码基因的克隆
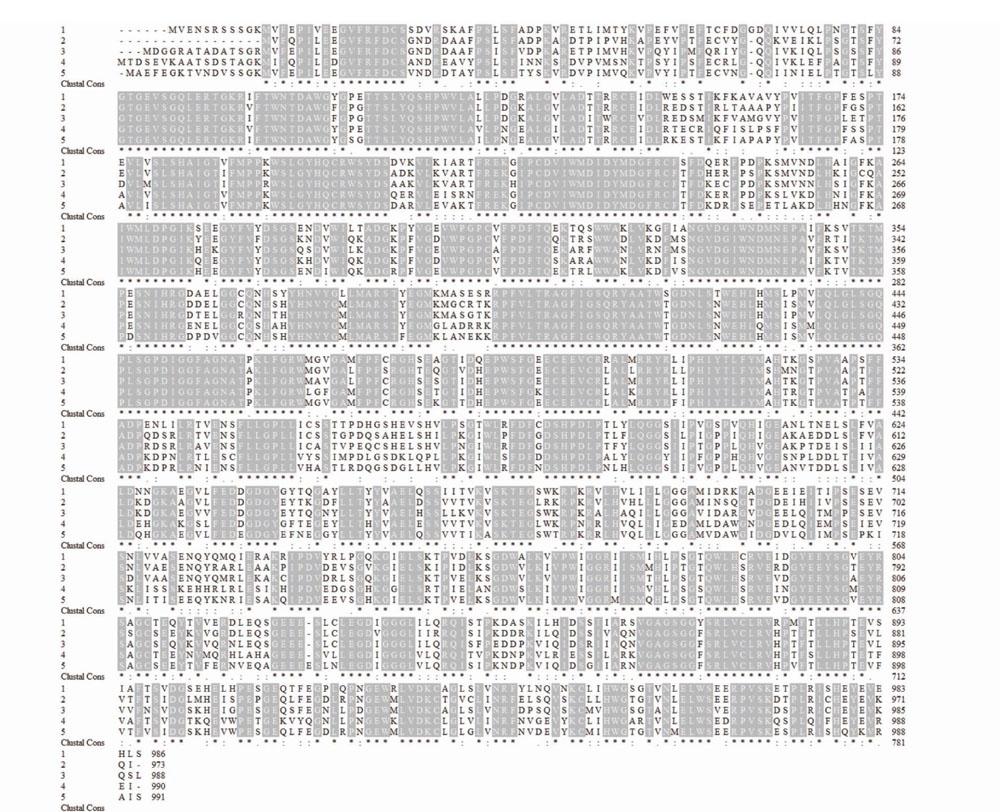
以忽地笑花葶和花瓣组织的cDNA為模板,利用PCR技术扩增获得了CL6740片段及其5′端和3′端,通过拼接测序结果,得到1条长度为3185bp的全长cDNA序列,包含一个2961bp的开放阅读框,编码一个包含986个氨基酸残基的蛋白质(图2)。进一步通过BLASTp分析发现,编码的蛋白质属于糖苷水解酶31家族,含有α-葡萄糖苷酶Ⅱ特征性的保守结构域(图3A),而且具有α-葡萄糖苷酶的保守基序(图3B),所以将该基因命名为LauAgl2。
2.3LauAgl2蛋白质氨基酸序列的生物信息学分析
通过分析LauAgl2基因编码的氨基酸序列,结果表明LauAgl2蛋白质的理论相对分子质量109916Da,理论等电点pI5.19;LauAgl2蛋白质氨基酸序列中具有一些蛋白质糖基化的潜在位点——N-X-S/T共有序列,说明LauAgl2蛋白可能在翻译后水平上需要糖基化修饰,可能是以糖蛋白的形式执行功能。
分析预测的LauAgl2蛋白质的二级结构,结果显示该蛋白质中含有大量的无规则卷曲和β-折叠以及少量的α-螺旋和β-转角;具体上,LauAgl2蛋白质的二级结构中包含47.67%的无规则卷曲、25.56%的β-折叠、18.66%的α-螺旋和8.11%的β-转角。
2.4LauAgl2氨基酸序列的同源性
通过与其他植物α-葡萄糖苷酶2进行氨基酸序列多重比对,结果显示,LauAgl2与凤梨{Ananascomosus(Linn.)Merr.]、油棕(ElaeisguineensisJacq.)、陆地棉(GossypiumhirsutumLinn.)、博落回{Macleayacordata(Willd.)R.Br.]等植物的α-葡萄糖苷酶2的氨基酸序列一致性达73.0%~80.7%;LauAgl2的氨基酸序列与上述植物α-葡萄糖苷酶2的氨基酸序列具有很多保守区域,均具有α-葡萄糖苷酶Ⅱ的特征模序,包括有天冬氨酸组成的活性中心(DGIWNDMNE)(图4),表明植物的α-葡萄糖苷酶2具有较高的保守性。
2.5LauAgl2的原核表达分析
在大肠杆菌BL21(DE3)中,通过将LauAgl2的编码序列组装到pET28a表达系统,并在N-端融合组氨酸标签序列,利用异丙基硫代半乳糖苷(IPTG)进行诱导蛋白的表达,并对诱导细胞进行SDS-PAGE电泳检测,结果表明,经IPTG诱导后,在含重组质粒pET28a-LauAgl2的细胞中检测到1条相对分子质量约为110kDa的蛋白质条带(图5),与预测的6hisLauAgl2蛋白质的理论相对分子质量基本一致,这说明目标蛋白质6hisLauAgl2在大肠杆菌中成功表达。而且,随着IPTG诱导时间的延长,6hisLauAgl2蛋白质的表达量显著增加。
3讨论
该研究在分析忽地笑转录组数据库的基础上,通过考察忽地笑不同组织中α-葡萄糖苷酶2候选基因片段CL6740的丰度,进一步利用RACE方法从忽地笑花葶和花瓣中克隆得到一个α-葡萄糖苷酶2编码基因LauAgl2。LauAgl2基因cDNA全长3185bp,存在一个2961bp长度的开放阅读框,编码1个含有986个氨基酸残基的蛋白质LauAgl2。LauAgl2蛋白质属于糖苷水解酶31家族(GH31),其氨基酸序列的N-端不具有分泌信号肽序列。LauAgl2蛋白质与其他植物来源的α-葡萄糖苷酶2氨基酸序列具有较高的一致性,且具有相似的保守结构域和相同的活性位点,说明该蛋白在进化上是高度保守的。
α-葡萄糖苷酶不仅能够催化麦芽糖等物质末端非还原性的α-1,4连接的葡萄糖苷键的水解,释放D-葡萄糖,还能够将从低聚糖类底物非还原末端释放的葡萄糖残基转移到另一糖类、酯类或蛋白质类底物上,形成α-1,6葡萄糖苷键,产生非发酵性的低聚异麦芽糖或糖苷、糖酯、糖肽等物质{15-17],在低聚异麦芽糖及一些非天然的α-葡萄糖苷等生产领域具有重要的应用。该研究克隆到忽地笑α-葡萄糖苷酶2編码基因LauAgl2为其功能基础研究及应用研究奠定了良好的基础。
参考文献
{1]TAGAMIT,YAMASHITAK,OKUYAMAM,etal.Molecularbasisfortherecognitionoflong-chainsubstratesbyplantαglucosidases{J].JBiolChem,2013,288(26):19296-19303.
{2]STANLEYD,REJZEKM,NAESTEDH,etal.Theroleofα-glucosidaseingerminatingbarleygrains{J].PlantPhysiol,2011,155(2):932-943.
{3]SUNZT,HENSONCA.Aquantitativeassessmentoftheimportanceofbarleyseedαamylase,βamylase,debranchingenzyme,andαglucosidaseinstarchdegradation{J].ArchBiochemBiophys,1991,284(2):298-305.
{4]KONISHIY,OKAMOTOA,TAKAHASHIJ,etal.EffectsofBaym1099,anα-glucosidaseinhibitor,onstarchmetabolismingerminatingwheatseeds{J].BiosciBiotechnolBiochem,1994,58(1):135-139.
{5]GILLMORCS,POINDEXTERP,LORIEAUJ,etal.α-glucosidaseIisrequiredforcellulosebiosynthesisandmorphogenesisinArabidopsis{J].JCellBiol,2002,156(6):1003-1013.
{6]GUOY,PIGNINB,ZHENGYH,etal.AnalysisofbioactiveAmaryllidaceaealkaloidprofilesinLycorisspeciesbyGCMS{J].NatProdCommun,2014,9(8):1081-1086.
{7]NOVIKOVAIY,TULAGANOVAA.Physicochemicalmethodsfortheanalysisofgalanthamine(Review){J].Pharmaceuticalchemistryjournal,2002,36(11):623-627.
{8]马广恩.加兰他敏治疗老年性痴呆症的研究概况{J].药学进展,1998,22(3):153-156.
{9]谷海燕,谢孔平,李世丽,等.石蒜属植物的无性繁殖研究{J].中国林副特产,2012(2):32-35.
{10]WANGR,XUS,JIANGYM,etal.DenovosequenceassemblyandcharacterizationofLycorisaureatranscriptomeusingGSFLXtitaniumplatformof454pyrosequencing{J].PLoSOne,2013,8(4):1-10.
{11]钱彬彬,李宜奎,李洁,等.忽地笑CYP98A的分子克隆与表达分析{J].分子植物育种,2018,16(11):3533-3541.
{12]MAR,XUS,ZHAOY,etal.Selectionandvalidationofappropriatereferencegenesforquantitativereal-timePCRanalysisofgeneexpressioninLycorisaurea{J].FrontPlantSci,2016,7:536.
{13]HALLTA.BioEdit:AuserfriendlybiologicalsequencealignmenteditorandanalysisprogramforWindows95/98/NT{J].NucleicAcidsSympSer,1999,41(2):95-98.
{14]OMASITSU,AHRENSCH,MULLERS,etal.Protter:Interactiveproteinfeaturevisualizationandintegrationwithexperimentalproteomicdata{J].Bioinformatics,2014,30(6):884-886.
{15]MALSˇ,DVORˇKOVH,HRABALR,etal.Towardsregioselectivesynthesisofoligosaccharidesbyuseofα-glucosidaseswithdifferentsubstratespecificity{J].CarbohydrRes,1999,322(3/4):209-218.
{16]OKUYAMAM,SABURIW,MORIH,etal.α-glucosidasesandα-1,4-glucanlyases:Structures,functions,andphysiologicalactions{J].CellMolLifeSci,2016,73(14):2727-2751.
{17]SUGIMOTOM,FURUIS,SASAKIK,etal.Transglucosylationactivitiesofmultipleformsofα-glucosidasefromspinach{J].BiosciBiotechnolBiochem,2003,67(5):1160-1163.
