基于Gd的造影剂在T1加权MRI上的研究进展
2018-05-14王凯丽田启威杨仕平
王凯丽 田启威 杨仕平

摘要:
磁共振成像(MRI)由于具有較深的组织穿透能力和高的空间分辨率,已成为临床医学常规使用的诊断工具之一.MRI造影剂能有效提高病灶区域和周围组织的对比度,被广泛应用于MRI医疗诊断.基于Gd的MRI造影剂,由于其能最大程度地加速纵向弛豫,产生更明亮的图像,使得该类造影剂被科研工作者不断开发和研究.综述了Gd造影剂在T1加权MRI上的最新研究进展.
关键词:
磁共振成像; 钆; 钆配合物; 钆纳米材料; T1-T2双模式成像
中图分类号: O 614.24文献标志码: A文章编号: 1000-5137(2018)01-0078-12
Recent advance of Gd-based contrast agents on T1-weighted MRI
Wang Kaili, Tian Qiwei*, Yang Shiping*
(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China)
Abstract:
Magnetic resonance imaging (MRI) has become one of the most common diagnostic tools in clinical medicine due to its deep tissue penetration and high spatial resolution.MRI contrast agent has been widely used in MRI medical diagnosis because it can effectively improve the contrast effect of the lesion area and surrounding tissue.Since Gd-based MRI contrast agents can accelerate the longitudinal relaxation to the maximum extent and produce brighter images,they have been deeply developed and studied by researchers.Thus,the advance of the Gd-based contrast agents on T1 weighted MRI was introduced in this review.
Key words:
magnetic resonance imaging (MRI); gadolinium; gadolinium complexes; gadolinium nanomaterials; T1-T2 dual mode imaging
收稿日期: 2017-09-13
基金项目: 国家自然科学基金(21601124,21671135)
作者简介: 王凯丽(1992-),女,硕士研究生,主要从事纳米材料在造影剂方面的研究.E-mail:1023109044@qq.com
*通信作者: 田启威(1983-),男,博士,副教授,主要从事生物材料的开发和应用方面的研究.E-mail:qiweitian@shnu.edu.cn;杨仕平(1969-),男,博士,教授,主要从事MRI造影剂的开发及其应用方面的研究.E-mail:shipingy@shnu.edu.cn
引用格式: 王凯丽,田启威,杨仕平.基于Gd的造影剂在T1加权MRI上的研究进展 [J].上海师范大学学报(自然科学版),2018,47(1):78-89.
Citation format: Wang K L,Tian Q W,Yang S P.Recent advance of Gd-based contrast agents on T1-weighted MRI [J].Journal of Shanghai Normal University(Natural Sciences),2018,47(1):78-89.
0引言
磁共振成像(MRI)由于其独特的优势,已成为临床医学常规使用的诊断工具之一.相对于非辐射影像技术,如荧光成像以及超声成像等,MRI的组织穿透能力具有明显的优势;而相对于其他具有较深组织穿透能力的成像技术,如电子计算机断层扫描(CT)、正电子发射断层扫描(PET)以及单电子发射计算机断层扫描(SPECT),MRI具有无辐射的技术优点[1].由于具有较深的组织渗透能力和高的空间分辨率,自1985年FDA批准以来,MRI在过去几十年中经历了爆发式的发展,目前在临床医学中起着至关重要的作用[2].MRI获得的信号强度取决于水分子中质子的弛豫率,可以通过水密度、质子弛豫时间或水分子扩散率的变化来检测组织间的差异.由于组织间的差异性,使得MRI成像技术通常无需注射任何试剂,即可获得需要的诊断信息.然而,当组织间的差异不大,如肿瘤和周围组织的区分度很小,为了获得更有效的、更明显的诊断信息,就需借助能增强MRI对比效果的造影剂.目前大约50%的临床MRI检查需要使用造影剂来提高图像的质量[3].
根据所呈现出的图像的对比度,可分为T1加权成像和T2加权成像,而且T1加权成像是组织中的质子(主要是水分子)纵向弛豫时间的三维表示.在图像中,短的弛豫时间导致明亮的对比,在一定范围内也与造影剂浓度正相关.相反,T2加权成像则会出现暗对比度增加,本质上它们均由氢质子在不同扫描序列条件下所给出的信号强度差异决定.相对于T2成像造影剂,T1成像造影剂在软组织检测方面表现出明显优势.同时T1造影剂通常在临床上提供更高的空间分辨率,感兴趣区域的增白效应也更容易与其他正常组织区分开,这样可有效避免T2模态的假信号读数.所以开发出具有T1加权成像效果的新型造影剂更能引起研究者的注意[4].
钆是具有7个不成对电子的顺磁金属离子,在周期表所有元素中数量最多,磁矩较高(7.94 μB),并且其对称8S7/2基态提供相对较长的电子弛豫时间,这些特征使Gd3+成为广泛研究的MRI造影剂.当用钆化合物时,由于质子核自旋与不成对电子自旋产生的局部磁场间的偶极-偶极相互作用,溶剂(水)的弛豫速率将会增加.然而,小分子造影剂的功效有限,需要较高的剂量才能获得所需的对比度,比如Gd-DTPA和Gd-DOTA[5].为了改善此问题,实行将Gd3+纳入纳米载体(纳米级造影剂)的策略,通过改善T1的弛豫率和血液循环时间,可有效放大损伤部位的对比度信号.本综述主要介绍钆基纳米级造影剂,包括Gd3+的络合物、Gd3+的氧化物、掺杂Gd3+的化合物以及含有Gd3+的复合物在T1加权成像中的应用.
1MRI的作用机制
MRI主要检测内源性水的1H核磁共振(NMR)信号.在人体MRI的过程中,促成因素是水分子的质子,其在强场中自旋排列整齐(在磁场方向上取向的质子大部分是低能量质子,其他质子是高能质子).当外在施加一个射频(RF)脉冲,一些低能量的质子吸收由脉冲传递的能量且旋转自旋.当RF脉冲停止,质子逐渐恢复正常旋转,同时以无线电波的形式释放能量并由接收器测量最终制成MR图像.在临床MRI中,不同组织中不同的含水量(质子密度)和各种磁性、物理性质被用于产生图像对比,以便描绘解剖和病理学.
MRI有几个重要参数需要介绍(图1),包括T1,T2,r1和r2.RF脉冲停止时,质子的磁矩恢复到平衡状态,所花费的时间称为弛豫时间.弛豫在纵向和橫向两个方向上测量,并分别由时间常数T1和T2表征.T1表示磁化方向上的磁化矢量要恢复到其原始幅度的63%所需的时间,T2表示垂直于磁场平面中的磁化矢量减少到37%的净信号所需的时间.用于MRI的造影剂通常影响T1和T2 ,T1 造影剂主要减少T1弛豫时间,并导致信号强度(亮对比度)增加,通常包括Mn2+,Eu2+和Gd3+的金属络合物上的顺磁性纳米粒子,以及在饱和转移的情况下的其他镧系元素造影剂.T2 造影剂主要缩短T2弛豫时间,并使信号强度降低,主要涉及超顺磁性氧化铁纳米粒子(SPION)[6].对比度增强通过弛豫速率Ri =1/Ti(s-1)来测量,其中i=1或2.造影剂的有效性则通过参数ri(ri=Ri/c(mmol·L-1·s-1))定义,称为弛豫率,其中c代表负责对比度的离子物质的量浓度.r1和r2之间的比值(r2/r1)用于确定对比度效率.较低的比率表示T1造影剂的效率更高,反之亦然.
图1MRI的机制示意图.(a) 质子在外部磁场B0下进动;(b) 在引入RF脉冲之后,
质子被激发,在去除RF脉冲之后发生弛豫[7]
根据内外球理论(图2),在添加顺磁性物质时,观察到的弛豫率(1/T1,obs)可以被描述为不存在顺磁性物质时的弛豫率(1/T1,d)和所述顺磁离子的影响(1/T1,p)之和.后者线性依赖于顺磁性造影剂的物质的量浓度,
1T1,obs=1T1,d+1T1,p+r1[CA],
(1)
其中,T1,obs为观察到的弛豫时间,T1,d为不存在顺磁性物质时的弛豫时间,[CA]为造影剂的物质的量浓度.1/T1,p的贡献来源于三方面,分别是与顺磁性试剂直接接触的内部水分子(Inner sphere,IS)、以氢键作用结合到配体上的位于第二球体的水分子(Second sphere,SS)和外球水分子(Outer sphere,OS).尽管第二球体水分子以及外球水分子不直接与顺磁性试剂结合,但它们对弛豫率的贡献也是显著的,特别是在具有低水合数的小造影剂中.例如,在Gd-DOTA和Gd-DTPA中,第二球体和外部球体对弛豫度的总贡献约占观察到的弛豫度的一半.
图2影响造影剂弛豫度的因素的图形表示[8]
只考虑内球影响的条件下,根据Solomon-Bloembergen-Morgan(SBM)方程,内球的弛豫机制可分为分别由电子相互作用和核相互作用引起的标量(SC)和偶极-偶极(DD)贡献.
1T1,p=1TIS1,P+1TSS1,P+1TOS1,P,(2)
1TIS1,P=[CA]55.56q(T1,M+tm),(3)
1T1,M=1TSC1+1TDD1,(4)
其中,TIS1,p为内球水分子的弛豫时间,TSC1为标量相互作用的弛豫时间,TDD1为偶极偶极相互作用的弛豫时间,q是内部水分子的数量,T1,M是结合水分子的纵向弛豫相关时间、tm是结合水分子与自由水分子交换率(kex)的倒数.偶极-偶极相互作用受重新定位的核自旋电子旋转速度、电子自旋驰豫、水交换速率影响,标量项则不依赖于分子的重新定向,而仅取决于电子自旋弛豫和水交换.
1TIS1,P=[CA]q55.56T1,M,(5)
1T1,M=1TDD1∝3tcl1+w2Lt2cl,
(6)
1tcl=1tm+1tR,(7)
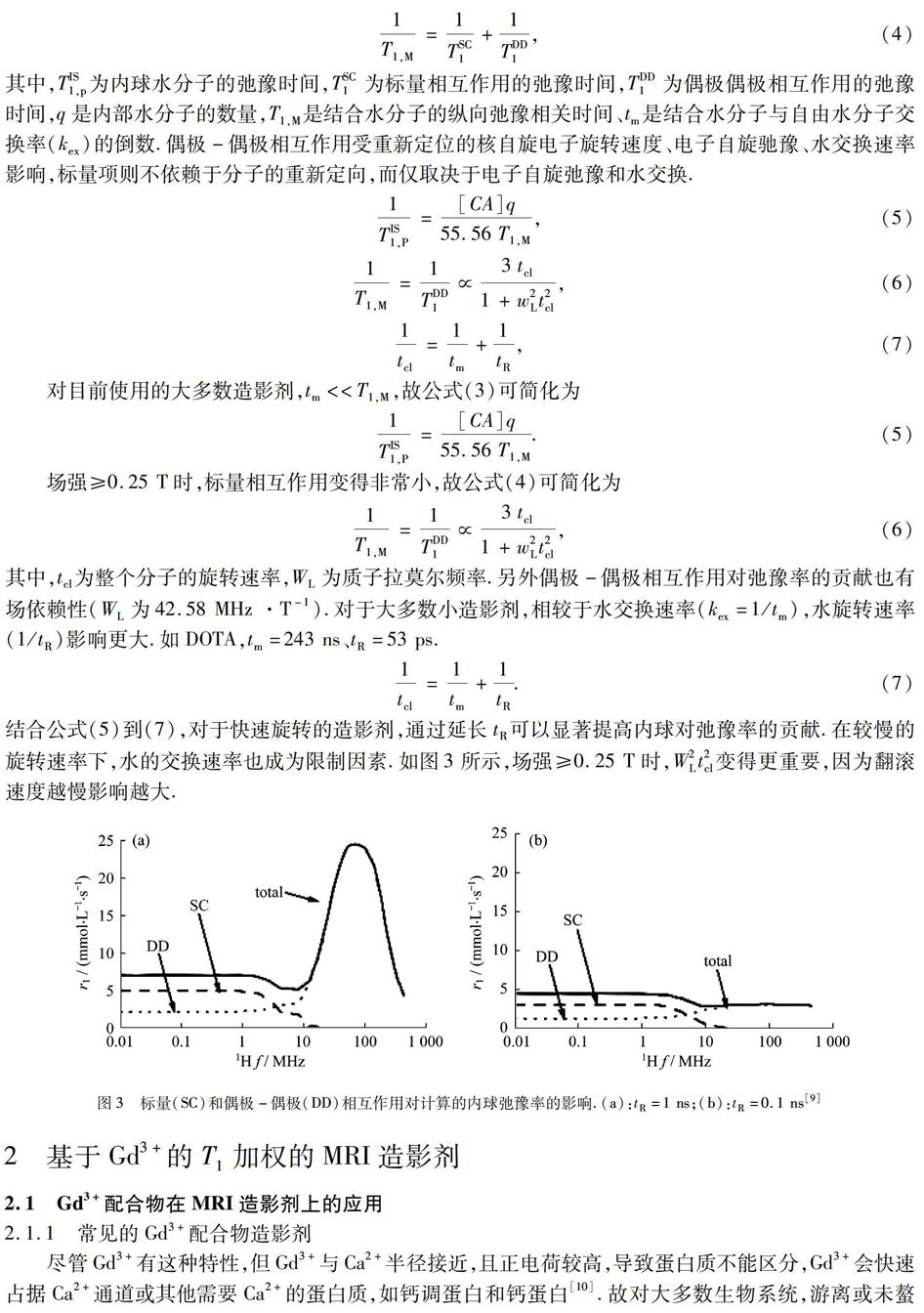
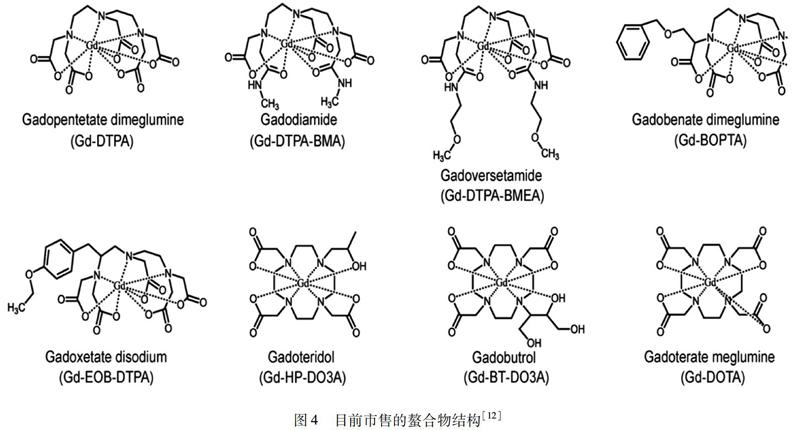
对目前使用的大多数造影剂,tm< 1TIS1,P=[CA]q55.56T1,M.(5) 场强≥0.25 T时,标量相互作用变得非常小,故公式(4)可简化为 1T1,M=1TDD1∝3tcl1+w2Lt2cl,(6) 其中,tcl为整个分子的旋转速率,WL为质子拉莫尔频率.另外偶极-偶极相互作用对弛豫率的贡献也有场依赖性(WL为42.58 MHz ·T-1).对于大多数小造影剂,相较于水交换速率(kex=1/tm),水旋转速率(1/tR)影响更大.如DOTA,tm=243 ns、tR=53 ps. 1tcl=1tm+1tR.(7) 结合公式(5)到(7),对于快速旋转的造影剂,通过延长tR可以显著提高内球对弛豫率的贡献.在较慢的旋转速率下,水的交换速率也成为限制因素.如图3所示,场强≥0.25 T时,W2Lt2cl变得更重要,因为翻滚速度越慢影响越大. 图3标量(SC)和偶极-偶极(DD)相互作用对计算的内球弛豫率的影响.(a):tR=1 ns;(b):tR =0.1 ns[9] 2基于Gd3+的T1加权的MRI造影剂 2.1Gd3+配合物在MRI造影剂上的应用 2.1.1常见的Gd3+配合物造影剂 尽管Gd3+有这种特性,但Gd3+与Ca2+半径接近,且正电荷较高,导致蛋白质不能区分,Gd3+会快速占据Ca2+通道或其他需要Ca2+的蛋白质,如钙调蛋白和钙蛋白[10].故对大多数生物系统,游离或未螯合的Gd3+有毒.为了克服这一障碍,已经开发与单个Gd3+紧密结合的有机配体,这些配体大部分建立在环状DOTA、DTPA以及其他无环类似物,配位体通常是7或8个,即允许2个或1个水分子直接与9配位的Gd3+相互作用,如图4所示.可以预期q越高,稳定性越低[11]. 图4目前市售的螯合物结构[12] 通过将钆螯合物并入纳米载体,r1能有效提高.同时,引入目标配体、多模态成像和治疗功能可提高纳米平台诊断准确性.常与钆螯合物耦合的有介孔二氧化硅、碳材料、聚合物纳米材料等. 2.1.2介孔二氧化硅担载的Gd3+配合物造影剂 介孔二氧化硅纳米粒子(MSN)的高表面积和结构可调的孔结构引起研究者的注意.Guo等[13]开发一种基于MSNs-树突-钆结合物的纳米级造影剂.其r1值(60.5 mmol·L-1·s-1,0.5 T)比Gd-DTPA增加约11倍.为了实现MSN纳米平台上的多功能效果,已设计了MRI与药物传递、PET[14]等相结合.典型的例子是Yang等[15]开发的在MSN上结合成像剂钆、光敏剂Ce6和光热剂碳点的探针.探针表面涂覆热/pH敏感的聚合物作为关键的“守门人”,以控制化学疗法.关于MR性质,该体系在1.2 T时显示r1值为18.05 mmol·L-1·s-1,注射后肿瘤区域的表观信号增强.同时在影像的引导下,实现了对肿瘤的化疗、光热治疗(PTT)和光动力治疗(PDT). 2.1.3碳纳米材料担载的Gd3+配合物造影剂 各种类型的碳纳米材料,包括氧化石墨烯(GO),碳纳米管(CNTs),富勒烯和碳量子點(CQD),也用来构建用于肿瘤成像的有吸引力的钆基纳米级MRI 造影剂.如图5所示,Guo[16]已制备出用前列腺干细胞抗原(PSCA)的单克隆抗体(mAb)和Gd-DTPA修饰的PAMAM树枝状分子(DEN)枝接GO纳米片,进而靶向肿瘤的造影剂(GO-DEN(Gd-DTPA)-mAb).该造影剂在0.5 T时显示出8.3 mmol·L-1·s-1的纵向弛豫度,T1加权MRI表明在肿瘤部位GO-DEN(Gd-DTPA)-mAb组比GO-DEN(Gd-DTPA)组有明显的时间依赖性增强作用,在1 h和4 h时信号分别增加5.8%和21.8%.加载DOX的GO-DEN(Gd-DTPA)-mAb还能实现抗癌药物靶向递送到恶性前列腺肿瘤并抑制肿瘤生长.对于CNTs,现已成功利用非共价方法在天冬酰胺-甘氨酸-精氨酸(NGR)修饰的单臂碳纳米管系统装载DOX和Gd-DTPA,形成具有靶向特异性的诊疗一体化系统[17].此外,0.5 T 时比较人血清白蛋白(HSA)修饰并结合Gd-DOTA与富勒烯衍生物(PC61BA)的大分子MRI 造影剂的r1值,终产物(89.1 mmol·L-1s-1)比Gd-DOTA(4.7 mmol·L-1·s-1)更大[18].注射4 h后MRI对比度最大,比未处理的小鼠高约350%.另一方面,以CQDs作为纳米载体,表面共轭Gd-DTPA和FA形成光学和MR成像的平台也首次被Zhang等发现[19]. 图5GO-DEN(Gd-DTPA)-mAb的合成路径[16] 2.1.4聚合物纳米材料担载的Gd3+配合物造影剂 Gd的螯合物修饰聚合物,构建成像探针已司空见惯,这些聚合物大致可分为胶束、水凝胶、脂质体等.使用胶束构建钆基纳米级MRI造影剂具有优势,因为它可赋予造影剂高的弛豫度和长循环时间,这有助于肿瘤成像.Tong等[20]设计了1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-聚(乙二醇)-嵌段-聚(丙烯酰胺-共-丙烯腈)(DOTA-PEG-b-poly(AAm-co-AN))的官能化聚合物.DOX和Gd3+被加载到疏水核心中,并在自组装时螯合在胶束的壳,从而赋予胶束药物递送和MRI功能.这种神经胶束表现出高的DOX释放量(62 %)和高质子弛豫率(3 T,25.88 mmol·L-1·s-1). 通过聚合物链的化学或物理交联形成的聚合物纳米颗粒,纳米水凝胶已引起生物医学领域日益增长的兴趣.对于肿瘤成像,Ringhieri 等[21]将钆螯合剂纳入自组装的淀粉纳米凝胶(Gd-CHPOA).在1.4 T显示高的r1弛豫率(24.1 mmol·L-1·s-1),4 h后可高水平的积累在小鼠的4T1肿瘤(信号强度增加约35%),这种高信号增强可持续7 d.重要的是,在注射后3个月内,试体主要器官没有损伤. 对于掺入钆的脂质体,Ren等[22]报道了一种双分子层中含紫杉醇,空腔中含Gd-DOTA,表面上负载靶向配体(c(RGDyk))的多功能脂质体.注入肿瘤鼠后,T1值在44 min内从1 664 ms减少到922 ms.通过MRI监测该多功能脂质体的抗癌效率,治疗前后材料组肿瘤体积从8 mm3变为17 mm3,而生理盐水组的变化则在9 mm3到30 mm3之间,表明潜在的治疗效果. 除此之外,也有与超支化聚赖氨酸(HBPLL)[23-24],聚吡咯纳米棒(PPy)[25-26],聚(乳酸-共-乙醇酸)(PLGA)[27]结合作为造影剂的研究. 2.1.5贵金属纳米材料担载的Gd3+配合物造影剂 一些贵金属如金,通过硫醇或二硫键与钆螯合物结合来作为理想的造影剂.比如用脂质酸修饰的DTPA和DO3A(Lip-DTPA和Lip-DO3A)已被设计为基于金NPs T1造影劑[28].Lip-DO3A@AuNPs和Lip-DTPA@AuNPs的r1在1.47 T时分别为14.6和13.7 mmol·L-1·s-1.由于金NPs的光热效应,当与T1 MRI结合时,基于金纳米材料的具有光热治疗(PTT)功能的纳米平台会被开发.例如,Huang[29]等将金纳米棒(GNRs)加载到Gd-DTPA缀合的壳聚糖(Gd-DTPA-CS),进一步用聚(谷氨酸)-g-(乙二醇)(PGA-g-mPEG)修饰形成GNR/Gd-DTPA-CS@PEG NPs纳米平台,尾静脉注射后6 h达到最大增强信号. 2.2Gd3+的纳米材料在MRI造影剂上的应用 2.2.1Gd3+的氧化物纳米材料 由于大的表面与体积比的超小型Gd2O3纳米颗粒表面上钆离子较多,对水质子的纵向弛豫有强烈的影响,故其作为肿瘤成像的潜在阳性造影剂被广泛研究[30]. 基于Gd2O3建立MR/上转换荧光(UCL)、MR/荧光(FI)、MR/近红外持续发光(NIR)的双模态成像探针取得较大进展.比如,Wang[31]等通过一锅法合成透明质酸(HA)修饰的Gd2O3纳米探针,HA赋予纳米探针优良的生物相容性,基于SBM理论,HA促进增加一个颗粒中有效Gd3+的数量和百分比,延长内球水分子旋转翻滚时间,协同效应有效提高HA-Gd2O3纳米探针的r1值.类似地,Chen等[32]通过液体激光切割合成直径小于9 nm的单斜晶Gd2O3∶Tb3+纳米粒子.研究了Tb3+浓度(掺杂物质的量浓度分别为0.5%、1.0%、5.0%、10.0%和20.0%)对可见绿色荧光和纵向弛豫度的影响,表明Tb3+掺杂量为1.0%时荧光性能最佳,但所有样品仍是有效的T1加权造影剂. 为了开发理想的多模态成像探针,Wang等[33]基于白蛋白制备了花菁标记的钆氧化物纳米晶体(Cy-GdNCs).Cy-GdNCs有近红外荧光、光声和MRI三模态成像以及光热治疗能力(图6),对于MRI,Cy-GdNCs显示强烈的MR成像能力且在24 h内信号强度随时间依赖性增加. 图6作为近红外荧光、光声、磁共振成像三模态成像引导的光热法治疗肿瘤的Cy-GdNCs 作为纳米复合材料的示意图[33] 为了同时实现诊断和治疗,Wu等[34]利用水热法制备Eu-Gd2O3纳米棒,再用二官能化聚乙二醇(Mal-PEG-NHS)缀合精氨酸-甘氨酸-天冬氨酸(RGD)和氯毒素(CTX),结果表明RGD/CTX共轭的Eu-Gd2O3纳米棒(RGD-NRs-CTX)能特异性靶向U251细胞,导致细胞凋亡.体内MRI显示RGD-NRs-CTX优先靶向和积累在早期肿瘤,体内发光成像在肿瘤区域具有良好的浸润能力. 2.2.2Gd3+的氟化物纳米材料 对于掺杂Gd3+的化合物,常见的是在高沸点二元溶剂混合物中通过成核和生长相进行尺寸可控合成的NaGdF4[35].并且NaGdF4掺杂镧系元素(Yb3+,Er3+,Eu3+)也是设计MRI/光学探针常用的策略[36].例如,利用奥斯特瓦尔德过程制备哑铃状NaYF4∶Yb/Er@NaGdF4核壳结构NPs,进一步用聚(乙二醇)-聚(丙烯酸)二嵌段聚合物(PEG-PAA)修饰作为多模式探针.通过3 T临床MR扫描仪评估r1值(7.81 mmol·L-1·s-1)是相似尺寸的NPs(3.75 mmol·L-1·s-1)和Gd-DTPA(3.06 mmol·L-1·s-1)的2倍[37].其他双模态探针,如MRI与CT可通过高度单分散Dy3+掺杂的NaGdF4表面涂覆PEG或聚乙烯吡咯烷酮(PVP)开发[38].此外,还通过构建核壳纳米复合材料,设计了涉及MRI/CT/光学成像[39]和MRI/PA/光学成像的多模式成像技术[40]. 为了同时实现生物医学成像和癌症治疗,基于NaGdF4的神经酰胺纳米平台引起重视.Zhang等[41]设计合成FA靶向的NaGdF4∶Yb/Tm@SiO2@TiO2纳米复合材料(FA-Gd-Si-Ti NPs),具有MRI和NIR响应的PDT效果(图7).FA-Gd-Si-Ti NPs的r1为4.53 mmol·L-1·s-1,小鼠体内MRI显示MCF-7肿瘤信号明亮,PDT表明肿瘤的抑制率达到88.6%. 图7用于MRI和NIR响应性PDT的FA-Gd-Si-Ti NPs的示意图[41] 除了NaGdF4,Zhang等[42]以聚乙二醇(PEG)为基础以溶剂热法将BaGdF5纳米颗粒附着在氧化石墨烯(GO)纳米片表面,形成GO/BaGdF5 /PEG纳米复合材料.复合材料显示阳性的磁共振对比和较好的X射线衰减特性,其增强的近红外吸收和有效的肿瘤被动靶向导致体内肿瘤的高效光热消融. 2.2.3Gd3+掺杂的纳米材料 除此之外,Ni等[43]发现将NaxGdWO3与聚(乙二醇)-硫醇(PEG-SH)连接形成的纳米棒可作为光学探针,Shao等[44]开发了可靶向微小脑胶质瘤的MR/荧光双模态成像的Gd-MnCO3 NPs,Chen等[45]则利用微波以聚丙烯酸为表面活性剂制备镧系元素(Ln3+)掺杂的Y(Gd)VO4纳米晶体应用于光学/MRI/CT三模态成像. 3基于Gd3+的T1-T2双模式MRI造影剂 如前所述,对于T2 造影剂,主要是顺磁性氧化铁纳米粒子(SPIONs).为了改善生物相容性,多模态成像或治疗作用,常在SPIONs表面用涂层修饰.事实上,改性后的SPIONs涂层和其本身粒径大小对最终的T2弛豫均有不可替代的影响[46]. 由于每种类型的MRI 造影剂都有固有的限制,即T1造影剂的短血液循环时间和T2 造影剂的磁化率伪影,所以建立双峰造影剂以实现T1和T2优势互补吸引了研究者的注意[47-50].比如,Yang等[51]利用热分解法制备直径21 nm的Fe3O4@SiO2核壳纳米材料,表面共价共轭Gd-DTPA和RGD.弛豫度测量显示,Gd/Fe摩尔比为0.3∶1时,具有4.2 mmol·L-1·s-1的T1弛豫率和17.4 mmol·L-1·s-1的T2弛豫率,表明其可作为T1阳性和T2阴性造影剂的潜力.Li等以Fe3O4为核,Gd2O3纳米管为壳制备DMCAs,1.5 T下r1(45.24 mmol·L-1·s-1)和r2(186.51 mmol·L-1·s-1)分别为Gd2O3和Fe3O4的2倍[49].尾静脉注射剂量为2 mg Fe/kg的材料10、30、60 min后,肝脏区域的T1和T2加权MRI有明显的信号对比.另外,氧化铁中掺杂Gd[53-54]、BaGdF5中掺杂镧系元素[55-56]、GdF3结合Fe[57]也成为DMCAs候选者之一. 值得注意的是,当改变两种MRI 造影剂间的距离,磁耦合也相应受到影响,從而获到需要的MR信号,常通过控制包附在磁性纳米粒子表面SiO2涂层的厚度或偶联在其表面聚乙二醇(PEG)的长度实现[58-59].例如,当改变SiO2厚度,分别为2、4、7、10、12和18 nm时,Choi等[60]发现Zn0.4Fe2.6O4@SiO2-Gd(DOTA)在3 T下T1 MRI信号随分离距离的增加而增强(图8),r1值随分离距离的减小从1.58降低到0.13 mmol·L-1·s-1,当分离距离为7 nm时,r1淬灭效率为50 %.这种距离相关的T1 MRI信号的变化可理解为主要由电子自旋波动率的变化决定. 图8(a) 基于纳米尺度的距离相关的磁共振效应示意图,其显示可变的T1 MRI信号取决于顺磁性增强剂 (Gd-DOTA)与超顺磁猝灭剂(Zn0.4Fe2.6O4)间的距离;(b) T1 MRI表明信号随分离距离减小 而淬灭.T1 MRI信号猝灭显示在颜色映射图像中,其中红色和蓝色分别代表高和低的信号映射[60] 利用PEG的研究也有很多,例如,Liu等[61]在哑铃状Au-Fe3O4核心嵌入致密的PEG壳体获得新型纳米探针,PEG另一端修饰Cy5,FA和Gd的络合物.尾静脉注射该纳米探针可在小鼠肿瘤部位积累,测量0.55 T下的MR,Cy5-Au-Fe3O4-PEG-Gd-DTPA-FA(14.11 mmol·L-1·s-1)纵向弛豫明显比Cy5-Au-Fe3O4-PEG和PEG-Gd-DTPA-FA的混合物(8.04 mmol·L-1·s-1)以及PEG-Gd-DTPA-FA(5.47 mmol·L-1·s-1)高很多.这可能是Fe3O4和Gd络合物紧密耦合,使该探针翻滚速率减慢,导致T1时间减少.同样,r2值也相应增加.这大概是PEG增加了Gd3+和NPs间的距离,并且外层中固定有相当数量的Gd3+,相邻的Gd3+和Gd3+间偶极-偶极作用可能相互产生增加的横向电子弛豫.因此,T1顺磁钆螯合物猝灭T2信号.这些结果证明Cy5-Au-Fe3O4-PEG-Gd-DTPA-FA可作为理想的T1-T2双模态造影剂. 4总结和展望 临床上对肿瘤组织的早期和精准检测的需求日益增加,激励各种类型的纳米级MRI 造影剂的快速发展,其中钆基纳米造影剂发展潜力巨大.迄今为止,已报道的钆基造影剂,如掺入纳米载体中的钆螯合物、钆离子纳米颗粒,被证明在肿瘤组织的诊断和治疗上有广阔的前景.然而,为了获得早期肿瘤的精准信息,同时确保造影剂在体内循环的安全性,钆基造影剂还有很多问题需要解决.对于掺入钆螯合物的纳米级造影剂,主要挑战是改善单个钆的纵向弛豫度和每个纳米颗粒的钆离子的有效载荷.对于钆纳米颗粒,主要任务是增强纳米粒子的稳定性,防止游离钆离子释放.随着科学家们的不断努力,相信在不久的将来,钆基造影剂肯定会有突破性发展. 参考文献: [1]Peng E,Wang F,Xue J M.Nanostructured magnetic nanocomposites as MRI contrast agents [J].Journal of Materials Chemistry B,2015,3(11):2241-2276. [2]Park Y I,Lee K T,Suh Y D,et al.Upconverting nanoparticles:A versatile platform for wide-field two-photon microscopy and multi-modal in vivo imaging [J].Chemical Society Reviews,2015,44(6):1302-1317. [3]Salerno M,Porqueras D S D.Alzheimer′s disease:The use of contrast agents for magnetic resonance imaging to detect amyloid beta peptide inside the brain [J].Coordination Chemistry Reviews,2016,327:27-34. [4]Yang C T,Padmanabhan P,Gulyas B Z.Gadolinium(III) based nanoparticles for T1-weighted magnetic resonance imaging probes [J].RSC Advances,2016,6(65):60945-60966. [5]Louie A.Multimodality imaging probes:Design and challenges [J].Chemical Reviews,2010,110(5):3146-3195. [6]Barrow M,Taylor A,Murray P,et al.Design considerations for the synthesis of polymer coated iron oxide nanoparticles for stem cell labelling and tracking using MRI [J].Chemical Society Reviews,2015,44(19):6733-6748. [7]Cao Y,Xu L,Kuang Y,et al.Gadolinium-based nanoscale MRI contrast agents for tumor imaging [J].Journal of Materials Chemistry B,2017,5(19):3431-3461. [8]Debroye E,Parac-Vogt T N.Towards polymetallic lanthanide complexes as dual contrast agents for magnetic resonance and optical imaging [J].Chemical Society Reviews,2014,43(23):8178-8192. [9]Caravan P,Ellison J J,McMurry T J,et al.Gadolinium(III) chelates as MRI contrast agents:structure,dynamics,and applications [J].Chemical Reviews,1999,99(9):2293-2352. [10]Davies G L,Kramberger I,Davis J J.Environmentally responsive MRI contrast agents [J].Chemical Communications,2013,49(84):9704-9721. [11]Jung K H,Kim H K,Park J A,et al.Gd complexes of DO3A-(Biphenyl-2,2′-bisamides) conjugates as MRI blood-pool contrast agents [J].ACS Medicinal Chemistry Letters,2012,3(12):1003-1007. [12]Fraum T J,Ludwig D R,Bashir M R,et al.Gadolinium-based contrast agents:a comprehensive risk assessment [J].Journal of Magnetic Resonance Imaging,2017,46(2):338-353. [13]Guo C,Hu J,Bains A,et al.The potential of peptide dendron functionalized and gadolinium loaded mesoporous silica nanoparticles as magnetic resonance imaging contrast agents [J].Journal of Materials Chemistry B,2016,4(13):2322-2331. [14]Laprise-Pelletier M,Bouchoucha M,Lagueux J,et al.Metal chelate grafting at the surface of mesoporous silica nanoparticles (MSNs):Physico-chemical and biomedical imaging assessment [J].Journal of Materials Chemistry B,2015,3(5):748-758. [15]Yang D,Yang G,Gai S,et al.Imaging-guided and light-triggered chemo-/photodynamic/photothermal therapy based on Gd (III) chelated mesoporous silica hybrid spheres [J].ACS Biomaterials Science & Engineering,2016,2(11):2058-2071. [16]Guo L,Shi H,Wu H,et al.Prostate cancer targeted multifunctionalized graphene oxide for magnetic resonance imaging and drug delivery [J].Carbon,2016,107:87-99. [17]Hu B,Zeng M,Chen J,et al.External magnetic field-induced targeted delivery of highly sensitive Iron oxide nanocubes for MRI of myocardial infarction [J].Small,2016,12(34):4707-4712. [18]Huang C L,Huang C C,Mai F D,et al.Application of paramagnetic graphene quantum dots as a platform for simultaneous dual-modality bioimaging and tumor-targeted drug delivery [J].Journal of Materials Chemistry B,2015,3(4):651-664. [19]Zhang Y,Zou T,Guan M,et al.Synergistic effect of human serum albumin and fullerene on Gd-DO3A for tumor-targeting imaging [J].ACS Applied Materials & Interfaces,2016,8(18):11246-11254. [20]Tong G,Fang Z,Huang G,et al.Gadolinium/DOTA functionalized poly(ethylene glycol)-block-poly(acrylamide-co-acrylonitrile) micelles with synergistically enhanced cellular uptake for cancer theranostics [J].RSC Advances,2016,6(56):50534-50542. [21]Ringhieri P,Mannucci S,Conti G,et al.Liposomes derivatized with multimeric copies of KCCYSL peptide as targeting agents for HER-2-overexpressing tumor cells [J].International Journal of Nanomedicine,2017,12:501-514. [22]Ren L,Chen S,Li H,et al.MRI-visible liposome nanovehicles for potential tumor-targeted delivery of multimodal therapies [J].Nanoscale,2015,7(30):12843-12850. [23]Zu G,Liu M,Zhang K,et al.Functional hyperbranched polylysine as potential contrast agent probes for magnetic resonance imaging [J].Biomacromolecules,2016,17(6):2302-2308. [24]Cheng K,Yang M,Zhang R,et al.Hybrid nanotrimers for dual T1 and T2-weighted magnetic resonance imaging [J].ACS Nano,2014,8(10):9884-9896. [25]Zhou J,Wang X,Li L,et al.Gadolinum complex-modified polypyrrole nanorods for magnetic resonance imaging and infrared thermal imaging-guided photothermal therapy of cancer [J].Science of Advanced Materials,2015,7(9):1708-1716. [26]Liang X,Li Y,Li X,et al.PEGylated polypyrrole nanoparticles conjugating Gadolinium chelates for dual-modal MRI/photoacoustic imaging guided photothermal therapy of cancer [J].Advanced Functional Materials,2015,25(9):1451-1462. [27]Li Q,Li C,Tong W.Nile red loaded PLGA nanoparticles surface modified with Gd-DTPA for potential dual-modal imaging [J].Journal of Nanoscience and Nanotechnology,2016,16(6):5569-5576. [28]Holbrook R J,Rammohan N,Rotz M W,et al.Gd(III)-dithiolane gold nanoparticles for T1-weighted magnetic resonance imaging of the pancreas [J].Nano Letters,2016,16(5):3202-3209. [29]Huang Y,Cao J,Zhang Q,et al.Chitosan oligosaccharide based Gd-DTPA complex as a potential bimodal magnetic resonance imaging contrast agent [J].Magnetic Resonance Imaging,2016,34(1):1-7. [30]Park J Y,Baek M J,Choi E S,et al.Paramagnetic ultrasmall Gadolinium oxide nanoparticles as advanced T1 MRI contrast agent:Account for large longitudinal relaxivity,optimal particle diameter,and in vivo T1 MR images [J].ACS Nano,2009,3(11):3663-3669. [31]Wang H,Fu Y-Y,Zhang X,et al.Hyaluronic acid-mediated one-pot facile synthesis of a sensitive and biocompatible Gd2O3 nanoprobe for MR imaging in vivo [J].RSC Advances,2015,5(113):93041-93047. [32]Chen F,Chen M,Yang C,et al.Terbium-doped gadolinium oxide nanoparticles prepared by laser ablation in liquid for use as a fluorescence and magnetic resonance imaging dual-modal contrast agent [J].Physical Chemistry Chemical Physics,2015,17(2):1189-1196. [33]Wang Y,Yang T,Ke H,et al.Smart albumin-biomineralized nanocomposites for multimodal imaging and photothermal tumor ablation [J].Advanced Materials,2015,27(26):3874-3882. [34]Wu Z,Huang Z,Yin G,et al.RGD/CTX-conjugated multifunctional Eu-Gd2O3 NRs for targeting detection and inhibition of early tumor [J].Journal of Materials Chemistry B,2017,5(25):4863-4875. [35]Johnson N J J,Oakden W,Stanisz G J,et al.Size-tunable,ultrasmall NaGdF4 nanoparticles:Insights into their T1 MRI contrast enhancement [J].Chemistry of Materials,2011,23(16):3714-3722. [36]Yoo S P,Pineda F,Barrett J C,et al.Gadolinium-functionalized peptide amphiphile micelles for multimodal imaging of atherosclerotic lesions [J].ACS Omega,2016,1(5):996-1003. [37]Wen H Q,Peng H Y,Liu K,et al.Sequential growth of NaYF4∶Yb/Er@NaGdF4 nanodumbbells for dual-modality fluorescence and magnetic resonance imaging [J].ACS Applied Materials & Interfaces,2017,9(11):9226-9232. [38]Yang M,Wang T,Wang Y,et al.Ultra-small and size tunable PVP-NaGdF4∶Dy nanoparticles with high biocompatibility for multimodal tumor imaging [J].RSC Advances,2016,6(108):106355-106363. [39]Jin X,Fang F,Liu J,et al.An ultrasmall and metabolizable PEGylated NaGdF4∶Dy nanoprobe for high-performance T1 and T2-weighted MR and CT multimodal imaging [J].Nanoscale,2015,7(38):15680-15688. [40]Ma D,Meng L,Chen Y,et al.NaGdF4∶Yb3+/Er3+@NaGdF4∶Nd3+@sodium-gluconate:multifunctional and biocompatible ultrasmall core-shell nanohybrids for UCL/MR/CT multimodal imaging [J].ACS Applied Materials & Interfaces,2015,7(30):16257-16265. [41]Zhang L e,Zeng L,Pan Y,et al.Inorganic photosensitizer coupled Gd-based upconversion luminescent nanocomposites for in vivo magnetic resonance imaging and near-infrared-responsive photodynamic therapy in cancers [J].Biomaterials,2015,44:82-90. [42]Zhang H,Wu H,Wang J,et al.Graphene oxide-BaGdF5 nanocomposites for multi-modal imaging and photothermal therapy [J].Biomaterials,2015,42:66-77. [43]Ni D,Zhang J,Wang J,et al.Oxygen vacancy enables markedly enhanced magnetic resonance imaging-guided photothermal therapy of a Gd3+-doped contrast agent [J].ACS Nano,2017,11(4):4256-4264. [44]Shao C,Li S,Gu W,et al.Multifunctional gadolinium-doped manganese carbonate nanoparticles for targeted MR/fluorescence imaging of tiny brain gliomas [J].Analytical Chemistry,2015,87(12):6251-6257. [45]Chen C,Li C,Li T,et al.Water-soluble,monodisperse,lanthanide-doped Y(Gd)VO4 nanocrystals as promising multimodal bioprobe [J].European Journal of Inorganic Chemistry,2015,2015(19):3108-3115. [46]Na H B,Song I C,Hyeon T.Inorganic nanoparticles for MRI contrast agents [J].Advanced Materials,2009,21(21):2133-2148. [47]Lee N,Yoo D,Ling D,et al.Iron oxide based nanoparticles for multimodal imaging and magnetoresponsive therapy [J].Chemical Reviews,2015,115(19):10637-10689. [48]Shin T-H,Choi Y,Kim S,et al.Recent advances in magnetic nanoparticle-based multi-modal imaging [J].Chemical Society Reviews,2015,44(14):4501-4516. [49]Li F,Zhi D,Luo Y,et al.Core/shell Fe3O4/Gd2O3 nanocubes as T1-T2 dual modal MRI contrast agents [J].Nanoscale,2016,8(25):12826-12833. [50]Zhang Q,Wang P,Li X,et al.Preparation of highly dispersed γ-Fe2O3 and GdPO4 co-functionalized mesoporous carbon spheres for dual-mode MR imaging and anti-cancer drug carrying [J].Journal of Materials Chemistry B,2017,5(20):3765-3770. [51]Yang H,Zhuang Y,Sun Y,et al.Targeted dual-contrast T1 and T2-weighted magnetic resonance imaging of tumors using multifunctional gadolinium-labeled superparamagnetic iron oxide nanoparticles [J].Biomaterials,2011,32(20):4584-4593. [52]Yang L,Zhou Z,Liu H,et al.Europium-engineered iron oxide nanocubes with high T1 and T2 contrast abilities for MRI in living subjects [J].Nanoscale,2015,7(15):6843-6850. [53]Li X,Qian Y,Liu T,et al.Amphiphilic multiarm star block copolymer-based multifunctional unimolecular micelles for cancer targeted drug delivery and MR imaging [J].Biomaterials,2011,32(27):6595-6605. [54]Thorat N D,Bohara R A,Yadav H M,et al.Multi-modal MR imaging and magnetic hyperthermia study of Gd doped Fe3O4 nanoparticles for integrative cancer therapy [J].RSC Advances,2016,6(97):94967-94975. [55]Sun R,Yin T,Huang P,et al.Hydrothermal synthesis of monodispersed BaGdF5∶Yb/Er nanoparticles for CT and MR imaging [J].Journal of the Chinese Chemical Society,2016,63(12):977-984. [56]Zhang P,He Y,Liu J,et al.Core-shell BaYbF5∶Tm@BaGdF5∶Yb,Tm nanocrystals for in vivo trimodal UCL/CT/MR imaging [J].RSC Advances,2016,6(17):14283-14289.
