高效液相色谱-串联质谱法分析马铃薯和土壤中甲基硫菌灵及其代谢物的降解动力学及残留量
2018-05-14张文君朱倩王晨晨董崭官帅陈子雷
张文君 朱倩 王晨晨 董崭 官帅 陈子雷

摘要 [目的]确保甲基硫菌灵的安全使用。[方法]利用超高效液相色谱-串联质谱建立了马铃薯和土壤中甲基硫菌灵及代谢物多菌灵的检测方法,通过田间样品分析评价甲基硫菌灵及多菌灵在马铃薯上的消解趋势、残留水平。[结果]该方法的灵敏度、精密度和准确性等各项性能指标均满足农药残留分析要求,适用于马铃薯植株、马铃薯和土壤中甲基硫菌灵及多菌灵的测定;甲基硫菌灵在土壤中消解动态满足一级降解动力学方程,半衰期为11.5~11.9 d;在马铃薯植株消解动态中检出量均小于0.01 mg/kg;马铃薯最终残留均不大于0.01 mg/kg。[结论]建议70%甲基硫菌灵可湿性粉剂防治马铃薯环腐病,施药次数1次,拌种量为0.42~0.70 g a.i./kg种薯。
关键词 甲基硫菌灵;超高效液相色谱-串联质谱法;马铃薯;降解动力学;残留
中图分类号 S481+.8文献标识码 A文章编号 0517-6611(2018)34-0169-04
甲基硫菌灵商品名甲基托布津,是一种广谱性内吸低毒杀菌剂,具有内吸、预防和治疗作用,进入植物体内后能转化成多菌灵,可广泛用于粮、棉、油、蔬菜、果树等多种作物上病害的防治。甲基硫菌灵易降解[1],但若不规范使用,仍存在超标的可能性。农药在植物体和土壤化学行为研究是制定农药残留最大残留限量(MRL)的基本数据之一,同时也是建立良好农业生产规范(GAP)、保证农药等不超标的重要依据 [2-3],对农产品质量和食品安全意义重大。马铃薯产量高、营养丰富,对环境的适应性较强,现在我国马铃薯种植面积居世界第二位,其性平味甘,可以治胃痛、痄肋、痈肿等疾病,维生素C含量是苹果的4倍左右[4-5]。目前,欧盟规定马铃薯中甲基硫菌灵和多菌灵的临时残留限量均为0.1 mg/kg,我国GB 2763—2016中未规定甲基硫菌灵在马铃薯中残留量,国际食品法典委员会(CAC)、韩国、日本等同样未规定马铃薯中甲基硫菌灵和多菌灵残留限量。因此研究甲基硫菌灵在马铃薯和土壤中的降解行为,评估其使用的安全性,对于制定马铃薯中残留限量及保证其质量安全有重要的意义。
甲基硫菌灵和多菌灵的测定方法主要有高效液相色谱法(HPLC)[6-7]和超高效液相色谱串联质谱法(UPLC-MS-MS)[8-9]。张念洁等[6]应用高效液相色谱检测中药材中多菌灵、甲基硫菌灵农药残留量,结果精确性、稳定性较好,检出限0.01 mg/kg。李福琴等[8]应用超高效液相色谱串联质谱法测试草莓中甲基硫菌灵、多菌灵,方法可行,灵敏度更高,定量限在2.1~14.1 μg/kg。笔者参照已有研究文献,利用HPLC- MS/MS分析甲基硫菌灵在马铃薯和土壤中的降解动力学和残留量,旨在为农业合理用药、确定休药期、制定马铃薯中残留限量提供可参考理论依据。
1 材料與方法
1.1 仪器
LC-20A HPLC(日本岛津公司);AB SCTEX QTRAP 5500 串联质谱(美国AB公司);T25 D高速匀浆机(德国IKA公司);MS3 D S25涡旋混合仪(德国IKA公司);BSA224S - CW 万分之一电子天平(德国 Sartorius公司);LDZS - 2 高速离心机(北京京立离心机公司);0.22 μm 有机系微孔滤膜(北京科瑞海科学仪器有限公司)。
1.2 试剂 甲基硫菌灵及其代谢产物多菌灵标准品100 mg/L,农业部环境保护科研监测所(天津);乙腈、甲醇(HPLC级,美国 Fisher 公司);氯化钠、甲酸 (分析纯,国药集团)。
1.3 田间试验设计
1.3.1 消解动态试验。
根据厂家推荐,70%甲基硫菌灵可湿性粉剂防止马铃薯环腐病拌种用药量为0.42~0.70 g a.i./kg种薯,播种时拌种使用一次。按照《农药残留试验准则》要求,于2015—2016年在山东省济南市、湖南省长沙市开展试验。
马铃薯消解动态试验设1个处理,重复3次,每小区面积15 m 随机排列,小区间设置隔离区,另设空白对照小区。施药时期为播种时拌种(参照BBCH Monograph对应的图谱和编号)施药,施药时应保证用于动态试验的马铃薯种均匀拌种。甲基硫菌灵拌种量为1.05 g a.i./kg种薯,在马铃薯出苗后(2片真叶)开始第一次取样,并以0天计(2 h)、1 d、3 d、7 d、14 d、21 d、28 d、35 d、42 d,随机采集马铃薯植株10~20株,每次采样量不少于500 g。采集样品后装入样本容器中,在样品容器外贴标签(下同),并用透明胶带固定,制备样品待测。
土壤消解动态单独设置在未种植马铃薯小区,施药时期同植株动态试验,施药后并以0天计(2 h)、1 d、3 d、5 d、7 d、14 d、21 d、28 d、42 d、56 d、80 d,随机采集土壤样品,每次采集样本1~2 kg。
1.3.2 最终残留试验。
70%甲基硫菌灵可湿性粉剂最终残留试验设低剂量和高剂量2个水平。低剂量拌种量为0.70 g a.i./kg种薯,高剂量拌种量为1.05 g a.i./kg种薯。播种时拌种使用,每个处理重复3次,小区面积15 m2(参照BBCH Monograph对应的图谱和编号记录作物生长情况)。采样时间距离最后一次施药的间隔时间为收获前7 d和收获期(参照BBCH Monograph对应的图谱和编号分别记录作物生长情况)。另设清水空白对照,处理间设保护带。在各小区内多点随机采样马铃薯及土壤残留样本备用,每小区采集马铃薯9个点,采集块茎不少于2 kg。
1.4 标准溶液配制 将100 mg/L甲基硫菌灵及其代谢产物多菌灵标准品,用甲醇稀释成 5、10、50、100、500 μg/L系列混合标准溶液,于 0~4 ℃ 冰箱中贮存,待用。
1.5 样品前处理 田间样本在采集后8 h内运回实验室,并立即制备成实验室样品冷冻保存。
植株样品:将田间植株样本剪切成1 cm以下的小段或切碎,在不锈钢盆中充分混匀,用四分法缩分样品,分取2份200 g的样品,分别装入封口样品容器中,粘好标签,贮存于-20 ℃冰柜中保存。
马铃薯样品:将采集马铃薯样品去壳,充分混匀,分取100 g样品两 分别装入封口样品容器中,粘好标签,贮存于-20 ℃冰柜中保存。
土壤样品:将采集到的土壤样本碾碎后过筛,收集于搪瓷盘或其他适宜的容器中,充分混匀,用四分法分取200~300 g样品2份,分别装入封口样品容器中,贴好标签,贮存于- 20 ℃冰柜中保存。
称取20.0 g处理好的马铃薯、土壤、马铃薯植株样品于离心管里,加入40 mL乙腈,高速匀浆提取1 min,离心取上清液,待测。
1.6 仪器分析条件
1.6.1 色谱条件。色谱柱为Infinity Lab Poroshell 120 EC-C18色谱柱(4.6 mm×100 mm,2.7 um);柱温40 ℃;流速0.5 mL/min;进样量1.0 μL。流动相为0.1%甲酸水(A)与乙腈(B);梯度洗脱,其程序见表1。
1.6.2 质谱条件。
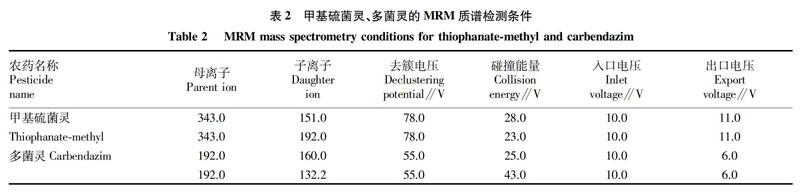
大气压电喷雾离子源(ESI);正离子模式;气帘气CUR 241.3 kPa;碰撞气CAD:中等;喷雾电压IS:5 500 (ESI);雾化温度TEM:550 ℃;雾化气GS1:379.2 kPa;辅助气GS2:379.2 kPa;检测方式:MRM监测。定性离子对、定量离子对、去簇电压、碰撞能量等离子检测条件见表2。
2 结果与分析
2.1 线性范围、检出限及定量限
在“1.6”仪器条件下,测定甲基硫菌灵与多菌灵5、10、50、100、500 μg/L系列混合标准溶液,甲基多菌灵的相对保留时间是5.04 min左右,多菌灵相对保留时间是3.61 min左右,见图1。以各组分标准溶液浓度与监测离子峰面积绘制标准曲线,得出甲基硫菌灵标样线性方程为Y=1.47×108X+88 14 相关系数(r)为0.999,最小检出量为8.9×10-4 ng,其中Y为多菌灵峰面积,X为标准溶液浓度;多菌灵标样线性方程为Y=6.89×107X+14 076,相关系数(r)为0.996,最小检出量为2.8×10-4 ng,其中Y为甲基硫菌灵峰面积,X为标准溶液浓度。
2.2 精密度及准确度 分别在马铃薯植株、马铃薯和土壤空白样品中添加0.01、0.10和0.50 mg/kg 3个不同浓度水平的甲基硫菌灵与多菌灵混标,每个水平重复5次,部分试验图谱见图2。从图2可以看出,3种空白基质均可检出微量多菌灵(<0.01 mg/kg),由于多菌灵在3种基质中信噪比均满足定量要求(>10倍噪声),由此即使添加水平为0.01 mg/kg,也可准确定量;对于甲基硫菌灵来说,其在空白土壤中未检出,其余2种基质中检出量大约在0.001 mg/kg,均不影响其准确定量。按“1.5”方法测定回收率,经分析发现,甲基硫菌灵在马铃薯植株、马铃薯及土壤中的添加回收率分别为82.4%~104.4%、88.9%~105.2%、86.4%~97.3%,相对标准偏差分别为5.8%~9.0%、2.5%~6.7%、1.7%~4.3%;多菌灵在马铃薯植株、马铃薯及土壤中的添加回收率分别为81.8% ~103.9%、86.4%~106.5%、85.7%~101.9%,相对标准偏差分别为6.3%~9.9%、4.7%~9.0%、2.6%~7.2%(表3)。
2.3 消解动态试验
甲基硫菌灵施药后,部分可代謝为多菌灵,其残留量以多菌灵、甲基硫菌灵折合成多菌灵总量计。
农药在大田环境下的降解是一个复杂过程,通常采用一级动力学方程描述其降解规律,以半衰期T 1/2表示农药在土壤和植物体中的消解程度,以施药后的时间(t)为横坐标、残留量(C)为纵坐标绘制指数曲线(图3)。
2年的甲基硫菌灵消解动态试验结果表明,马铃薯植株中甲基硫菌灵与多菌灵的检出量小于0.01 mg/kg,所以不做评价;甲基硫菌灵在土壤中消解动态满足一级降解动力学方程,山东省济南市2015和2016年消解半衰期分别为11.5、11.8 d,消解动态方程分别为C=0.046 1e-0.060 3t和C=0.041 4e-0.058 5t,相关系数分别为0.840 5和0.832 2;湖南省长沙市2015和2016年消解半衰期分别为11.9、11.6 d,消解动态方程分别为C=0.038 4e-0.058 2t和C=0.035 2e-0.059 8t,相关系数分别为0.829 1和0.829 8。
2.4 甲基硫菌灵在马铃薯中的最终残留量
据2015—2016年山东省、湖南省残留试验结果,70%甲基硫菌灵可湿性粉剂防治马铃薯环腐病,拌种量为0.70和1.05 g a.i./kg施药次数1次,收获及收获前7 d中马铃薯残留量均不大于0.01 mg/kg,试验结果均符合要求。
3 结论
建立了马铃薯植株、马铃薯和土壤中甲基硫菌灵及多菌灵检测方法,在5~500 μg/L质量浓度范围内,甲基硫菌灵和多菌灵的仪器响应值与质量浓度呈良好的线性关系,平均回收率为88.3%~97.1%,相对标准偏差为1.3%~9.9%,精确度、准确度和检出限均符合农药残留分析要求,且前处理操作简单。通过田间样品分析评价甲基硫菌灵在马铃薯上的消解趋势、残留水平,2年的消解动态残留试验结果表明,甲基硫菌灵在土壤中消解速率较快,半衰期为11.5~11.9 d,甲基硫菌灵属于易降解农药,其消解动态满足一级降解动力学方程,用药14 d后甲基硫菌灵残留值已较低,消解量均达90%以上,对环境安全;马铃薯植株动态检出量均小于0.01 mg/kg,不做评价;马铃薯最终残留均小于0.01 mg/kg。综上所述,建议70%甲基硫菌灵可湿性粉剂防治马铃薯环腐病,施药次数1次,拌种量为0.42~0.70 g a.i./kg种薯。
参考文献
[1]苑学霞,梁京芸,王文博,等.苹果和土壤中甲基硫菌灵及其代谢物残留消解动态[J].生态环境学报,2016,25(1):135-140.
[2]毛江胜,赵永红,张广霞,等.超高效液相色谱串联质谱法研究烟嘧磺隆在玉米和土壤中的降解动力学及残留[J].山东农业科学,2017,49(10):121-125.
[3]农业部农药检定所.农药登记残留田间试验标准操作规程[M].北京:中国标准出版社,2007:5.
[4]黄越,李帅兵,石瑛.马铃薯不同品种块茎矿质营养品质的差异[J].作物杂志,2017(4):33-37.
[5]李彦军,耿伟,史超,等.马铃薯营养特性及产业发展前景[J].中国果菜,2017, 37(8):16-17,20.
[6]张念洁,吴信子,姜旭.高效液相色谱法同时测定人参中多菌灵和甲基硫菌灵农药残留的含量[J].现代食品科技,2013,29(4):907-910.
[7]李涛,李文辉,李俊毅,等.HPLC测定菠萝汁中多菌灵、噻菌灵和甲基硫菌灵[J].食品工业,2017,38(4):289-291.
[8]李福琴,石丽红,王飞,等.QuEChERS-液相色谱-串联质谱法同时检测土壤和柑橘中吡唑醚菌酯甲基硫菌灵及其代谢物多菌灵的残留[J].色谱,2017,35(6):620-626.
[9]王昕璐,贾琪,许彦阳,等.QuEChERS-超高效液相色谱-串联质谱法同时测定草莓中甲基硫菌灵、多菌灵和乙嘧酚残留[J].农药学学报,2017,19(5):603-608.
