利用废弃烟梗发酵生产白僵菌的响应面优化
2018-05-14陈辰朱润琪臧晓静刘丽马轩叶晓婉刘珍珍谷萌萌席宇朱大恒
陈辰 朱润琪 臧晓静 刘丽 马轩 叶晓婉 刘珍珍 谷萌萌 席宇 朱大恒
摘 要:为实现废弃烟梗资源化利用,以废弃烟梗为主要发酵底料,白僵菌产孢量为响应值,采用响应面法(Response Surface Methodology,RSM)对烟梗发酵生产白僵菌的条件进行了优化。通过Plackett-Burman(PB)试验筛选出影响废弃烟梗发酵生产白僵菌最显著的因素,设计最陡爬坡试验逼近最佳条件区域,进一步设计Box-Behnken Design(BBD)响应面优化,分析并确定最佳条件。结果表明,当培养时间为9.40 d,蛋白胨含量1.21%,酵母粉含量1.03%时,白僵菌孢子产量预测最优值为1.17×1010个/g,实际孢子产量为1.13×1010个/g,拟合度达到96.58 %,白僵菌产孢量显著提高。因此,采用该方法优化得到的最佳发酵条件合理而有效,对烟草生物防治以及烟梗废料的综合利用具有实际应用价值。
关键词:白僵菌;废弃烟梗;固态发酵;响应面法优化
中图分类号:S435.72 文章编号:1007-5119(2018)02-0046-08 DOI:10.13496/j.issn.1007-5119.2018.02.007
Optimization of Fermentation Conditions of Beauveria bassiana Using Waste Tobacco Stem as Fermentation Substrate with Response Surface Methodology
CHEN Chen1, ZHU Runqi2, ZANG Xiaojing1, LIU Li1, MA Xuan1, YE Xiaowan1, LIU Zhenzhen1, GU Mengmeng1, XI Yu1, ZHU Daheng1*
(1. College of Life Sciences, Zhengzhou University, Zhengzhou 450001, China; 2. College of Pharmacy, Huazhong University of Science and Technology, Wuhan 430074, China)
Abstract: In order to realize the resource utilization of waste tobacco stems and improve the application status on waste tobacco stem, using waste tobacco stem as fermentation substrate, and the production of Beauveria bassiana as response value, the fermentation process of Beauveria bassiana was optimized using the response surface methodology (RSM). Through Plackett-Burman (PB) design, the most significant factors affecting the production of Beauveria bassiana using waste tobacco stem as fermentation substrate were identified. Based on the results of the Plackett-Burman (PB) experiment, the steepest ascent experiment was used to approach the optimal region, and the mathematical model of optimization of Box-Behnken Design (BBD) response surface was established to determine the optimal conditions. The results showed that when the incubation time was 9.40 days, concentration of peptone and yeast powder was 1.21% and 1.03% respectively, the prediction spore yield of Beauveria bassiana was 1.17×1010/g, the actual spore yield was 1.13×1010/g, and the fitting degree was 96.58%. Therefore, the optimal fermentation conditions from RSM are reasonable, and have practical application value in microbial prevention and control and the comprehensive utilization of waste tobacco stems.
Keywords: Beauveria bassiana; waste tobacco stem; solid-state fermentation; response surface methodology
白僵菌(Beauveria bassiana)作為一种昆虫病原真菌,在病害虫的防治与调控中具有重要的作用,因其寄生范围广,可侵染种类多、数量大(包括15个目、149个科的700多种昆虫及蜱螨目的6科10
基金项目:河南省教育厅科学技术研究重点项目“烟草废弃物发酵联产单细胞蛋白和草炭技术研究”(13B180358);郑州大学大学生创新创业训练计划资助项目“有机废水资源化利用生物工艺研究”(2015xjxm198);国家自然科学基金项目(31401918)
作者简介:陈 辰(1994-),男,硕士研究生,研究方向为微生物学与烟草生物工程。E-mail:chenchenem@aliyun.com
*通信作者,E-mail:zhudaheng2000@aliyun.com
收稿日期:2017-11-15 修回日期:2018-01-29
余种螨和蜱),易大规模生产等特点[1],并且具有专一性强、对人畜无害、防治效果好、生物降解无残毒等优点[2-3],从而被认为是目前世界上研究和应用最广泛的生物杀虫剂之一[4-7],在病虫害防治中发挥着越来越重要的作用[8-10]。但目前固态发酵白僵菌大多是粮食生物质底料作为发酵基质[11],例如麦麸、棉籽、米糠、碎米和稻壳等,成本较高,成为限制白僵菌推广的主要因素之一,所以寻找合适的廉价废弃原料物发酵生产白僵菌,不仅能够降低生产成本,而且能够降低污染,实现资源的回收再利用,已成为当前的热点领域。
烟梗是烟草卷烟工业的副产物[12],占烟叶总重的20%~30%[13],主要堆积于打叶复烤厂的仓库中,严重浪费仓储资源,目前对废弃烟梗的处理主要采用造纸法生产烟草薄片,但生产过程耗能耗热量大、产生的污水量高[14],对环境造成污染。烟梗中含有丰富的糖类、氮类、磷、钙、钾等营养物质[15-18],可作为发酵培养基质[19-20]。李超等[21]以废弃烟梗提取液为底物进行液态发酵,采用正交组合试验设计,对苏云金芽孢杆菌的培养基成分和发酵条件进行优化,结果表明,优化后苏云金芽孢杆菌产量明显增加。郭大城等[22]采用Plackett-Burman(PB)试验对影响深红酵母(Rhodotorula rubra)JLC发酵烟梗废料产类胡萝卜素的相关因素进行了分析和筛选,结果表明,在PB试验条件下,JLC发酵产类胡萝卜素产量明显提高,可达21.54 ?g/g。
目前关于利用废弃烟梗发酵生产白僵菌的研究未见报道。本试验以烟梗为主要发酵底料,在前期初步探究发酵因素(水分含量、发酵温度、pH值等)的基础上,进一步优化完善培养基和发酵工艺条件,以使废弃烟梗利用率和白僵菌产孢量实现最大化。通过PB试验从初选的相关因素中筛选出影响白僵菌产孢量的主要效应因子,进一步设计最陡爬坡试验逼近最优条件区域,然后设计Box-Behnken Design-Response Surface Methodology(BBD-RSM)优化,分析并确定最佳发酵条件,使白僵菌产孢量达到最大值,旨在为废弃烟梗资源化应用和生物防治领域相关微生物资源的开发提
供新思路和理论依据。
1 材料与方法
1.1 试验材料
试验材料:废弃烟梗,由天昌国际烟草有限公司提供(直径为0.30~0.50 cm,长度为4.0~5.0 cm)。
1.2 烟梗预处理
将废弃烟梗于60 ℃下烘干至恒重,粉碎过16目标准筛除尘,与蒸馏水按1∶3.5质量比混合,常温下浸泡16 h,1×105 Pa灭菌20 min作为废弃烟梗发酵预培养基。
1.3 菌种及培养基
菌种:球孢白僵菌(Beauveria bassiana)(菌种编号:ACCC30713),商业菌种,菌种保藏及活化采用马铃薯葡萄糖琼脂(Potato Dextrose Agar,PDA)斜面培养基,琼脂含量为1.8%,4 ℃保存备用。
马铃薯葡萄糖琼脂(PDA)培养基,培养基配制方法参考文献[23];液体种子培养基,同PDA培养基,不加琼脂即可;筛选固态发酵培养基,经预处理的原梗10 g;蛋白胨,郑州创生生物工程有限公司;酵母粉,英国OXOID公司;葡萄糖、NH4NO3、NaH2PO4、FeSO4、MnSO4均为分析纯,天津市科密欧化学试剂开发中心。
1.4 试验方法
1.4.1 種子液的制备 从PDA斜面培养基上挑取白僵菌菌种,接入装有50 mL液体种子培养基的锥形瓶中,28 ℃、180 r/min条件下培养48 h。
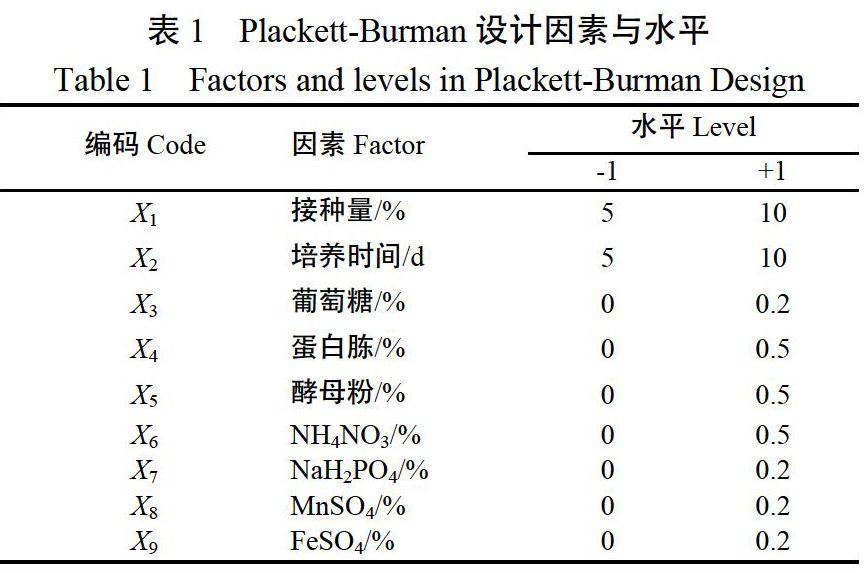
1.4.2 Plackett-Burman试验设计 选用N=12的Plackett-Burman(PB)设计对初选的影响废弃烟梗发酵产白僵菌的9种相关因素:接种量、培养时间、葡萄糖、蛋白胨、酵母粉、NH4NO3、NaH2PO4、MnSO4、FeSO4进行考察分析,以白僵菌孢子产量为响应值,每种因素取高(+)低(?)两个水平,高水平倍数不超过低水平2倍,因素之间间隔分布,每组3个重复,孢子产量取平均值,9种因素的编码、单位及水平见表1。
表1 Plackett-Burman设计因素与水平
Table 1 Factors and levels in Plackett-Burman Design
编码Code 因素Factor 水平Level
-1 +1
X1 接种量/% 5 10
X2 培养时间/d 5 10
X3 葡萄糖/% 0 0.2
X4 蛋白胨/% 0 0.5
X5 酵母粉/% 0 0.5
X6 NH4NO3/% 0 0.5
X7 NaH2PO4/% 0 0.2
X8 MnSO4/% 0 0.2
X9 FeSO4/% 0 0.2
1.4.3 最陡爬坡试验设计 根据PB试验选取对白僵菌孢子产量影响最显著的3个因素:培养时间(X2)、蛋白胨含量(X4)、酵母粉含量(X5)进行最陡爬坡试验。由于这3个因素对白僵菌孢子产量都有明显的正效应,因此将它们的含量逐渐增加以此来寻找最佳响应区域,根据PB试验结果设定变化方向与步长,每组3个重复,孢子产量取平均值,具体设计如表2所示。
1.4.4 BBD-RSM Design 采用Box-Behnken Design响应面法,在PB試验的基础上,根据最陡爬坡试验结果,设计Box-Behnken Design,每组处理3个重复,孢子产量取平均值,各因素及水平取值见表3。
1.4.5 白僵菌孢子数测定 发酵结束后向培养瓶中加入含有0.5 %吐温80的蒸馏水70 mL,28 ℃、180 r/min条件下振荡20 min,分两次洗脱白僵菌孢子,将两次洗脱液合并制成白僵菌孢子液,采用25×16型血球计数板直接计数,计算公式为:
白僵菌孢子数=50000×A×B×V/m
其中:A—5个中格内白僵菌孢子的总数;
B—稀释倍数;
V—白僵菌孢子液的体积;
m—物料的质量
1.5 数据处理
试验数据采用SPSS 19.0和Design-Expert 8.0.6进行统计和分析。
2 结 果
2.1 Plackett-Burman试验
2.1.1 Plackett-Burman设计及响应值 试验方案及响应值见表4。由表4可知,响应值白僵菌孢子产量在试验过程中变化幅度较大,表明所选因素对白僵菌产孢量有显著影响。
表2 最陡爬坡试验设计
Table 2 Design of Steepest Ascent Experiment
试验组
Experimental group 培养时间
Incubation
time/d 蛋白胨
Peptone/% 酵母粉
Yeast powder/%
1 6 0.3 0.3
2 7 0.5 0.5
3 8 0.7 0.7
4 9 0.9 0.9
5 10 1.1 1.1
6 11 1.3 1.3
7 12 1.5 1.5
表3 Box-Behnken试验设计因素与水平
Table 3 Factors and levels in Box-Behnken Design
因素Factor 水平Level
-1 0 1
培养时间/d
Incubation time/d 7 9 11
蛋白胨/%
Peptone/% 0.5 0.9 1.3
酵母粉/%
Yeast powder/% 0.5 0.9 1.3
表4 PB试验设计及结果
Table 4 Design and results of Plackett-Burmant Design
试验组 Experimental group X1 X2 X3 X4 X5 X6 X7 X8 X9 孢子产量 Spore yield/(109·g-1)
1 1 1 -1 1 1 1 -1 -1 -1 8.94
2 -1 1 1 -1 1 1 1 -1 -1 8.14
3 1 -1 1 1 -1 1 1 1 -1 8.02
4 -1 1 -1 1 1 -1 1 1 1 3.78
5 -1 -1 1 -1 1 1 -1 1 1 3.42
6 -1 -1 -1 1 -1 1 1 -1 1 6.76
7 1 -1 -1 -1 1 -1 1 1 -1 3.30
8 1 1 -1 -1 -1 1 -1 1 1 1.67
9 1 1 1 -1 -1 -1 1 -1 1 7.28
10 -1 1 1 1 -1 -1 -1 1 -1 4.99
11 1 -1 1 1 1 -1 -1 -1 1 7.59
12 -1 -1 -1 -1 -1 -1 -1 -1 -1 4.21
2.1.2 Plackett-Burman设计各因素效应分析 各因素的影响度和模型贡献率如表5所示。影响度[24]是指模型中的某个因素从低水平(?1)向高水平(+1)变化时对模型响应值所产生的影响,其中负值表示该因素对响应值具有负效应,影响度值越大说明该影响因子对响应值的影响越显著。模型贡献率[25]是指模型中某个因素的平方和占模型中所有因素平方和的总和的比例,其值大小表明该因素对响应值影响程度的大小。
本试验P值为0.0013,表明模型高度显著。其中接种量、培养时间、蛋白胨、酵母粉、NH4NO3、NaH2PO4、MnSO4、FeSO4为有意义的模型参数(P值均小于0.05)。但是接种量、NH4NO3、NaH2PO4、MnSO4、FeSO4的模型贡献率较低,对孢子产量影响较小。根据模型贡献率、影响度和P值综合评价,培养时间、蛋白胨含量、酵母粉含量为影响白僵菌产孢量的主要效应因子,因此选取培养时间、蛋白胨、酵母粉3个因素,采用响应面分析法作进一步的探究。
表5 PB试验设计效应分析
Table 5 Statistical analysis of Plackett-Burman design
因素
Factor 影响度/% 模型贡献率/% P值
Effect/% Contribution/% P Value
模型 Model ― ― 0.0013
X1接种量 Inoculum concentration 6.51 2.03 0.007
X2培养时间 Incubation time 42.23 85.54 0.0002
X3葡萄糖 Glucose 0.59 0.017 ―
X4蛋白胨 Peptone 8.8 3.72 0.0038
X5酵母粉 Yeast powder 9.22 4.07 0.0035
X6 NH4NO3 6.39 1.96 0.0073
X7 NaH2PO4 2.7 0.35 0.0387
X8 MnSO4 -3.94 0.74 0.0188
X9 FeSO4 4.49 0.97 0.0145
2.2 最陡爬坡试验结果
根据PB试验结果,对白僵菌孢子产量影响最显著的3个因素培养时间、蛋白胨含量、酵母粉含量设计最陡爬坡试验,结果如图1所示。
由图1可知,培养时间对白僵菌的孢子产量影响显著,随着培养时间的延长,孢子产量增加,且从试验组3到试验组4的孢子产量增幅最大、差异最为显著,试验组4到7的白僵菌孢子产量虽有所
注:图中不同小写字母表示在P<0.05水平上的显著性差异。
Note: Values of spore yield marked by different lowercase letters in the graph indicate significant difference at the level of P<0.05.
图1 最陡爬坡试验结果
Fig. 1 Results of Steepest Ascent Design
增加,但差异均不明显,而且考虑到延长培养时间会增加生产成本,因此以试验组4为中心点,每个因素取3水平,以(?l,0,1)编码,设计Box-Behnken Design,以筛选出培养时间、蛋白胨和酵母粉含量的最优配比。
2.3 响应面优化
2.3.1 Box-Behnken试验设计及响应值 根据PB和最陡爬坡试验结果,对选取的3种主要效应因素培养时间(A)、蛋白胨(B)和酵母粉(C)含量進行Box-Behnken试验,响应值为孢子产量,设置17个试验点,其中12个试验点为析因点,其余5个试验点为零点,零点的主要作用是估计试验误差,具体设计和响应值见表6。
表6 Box-Behnken试验设计及其试验结果
Table 6 Experimental design and results of Box-Behnken Design
试验组
Experimental group A B C 孢子产量
Spore yield/(109·g-1)
实际值
Experimental
value 预测值
Predicted
value
1 ?1 ?1 0 7.69 7.92
2 1 ?1 0 8.52 8.66
3 ?1 1 0 9.22 9.09
4 1 1 0 10.76 10.53
5 0 0 0 10.84 11.34
6 1 0 ?1 9.49 9.45
7 ?1 0 1 8.71 8.75
8 0 0 0 11.09 11.34
9 0 ?1 ?1 9.58 9.49
10 0 1 ?1 10.56 10.83
11 0 0 0 11.09 11.34
12 0 1 1 11.32 11.41
13 ?1 0 ?1 8.58 8.44
14 0 0 0 10.89 11.34
15 0 ?1 1 9.98 9.71
16 1 0 1 9.80 9.94
17 0 0 0 10.89 11.34
2.3.2 二次回归模型拟合及方差分析 通过多元回归法对试验数据进行分析,得到回归方程:
Y=11.34+0.55A+0.76B+0.20C+0.18AB+0.045AC+0.090BC-1.75A2-0.54B2-0.44C2
其中Y代表白僵菌孢子产量(109个/g),A、B和C分别代表培养时间/d、蛋白胨含量/%和酵母粉
含量/%。
方差分析结果如表7所示,模型P值为0.0003,表明该模型高度显著。决定系数R2为0.9637,表明模型的相关性较好,变异系数为3.54 %,值较小,表明该模型能够有效地反映真实值的情况。
表7 响应面方差分析
Table 7 ANOVA for Box-Behnken Design
方差来源
Source of variance 平方和
Sum of square 自由度
Degree of freedom 均方
Mean of square F P 显著性
Significance
模型
Model 23.51 9 2.61 20.67 0.0003 ***
A 2.39 1 2.39 18.89 0.0034
B 4.64 1 4.64 36.68 0.0005
C 0.32 1 0.32 2.53 0.1556
AB
AC 0.13
0.007 1
1 0.13
0.007 1.00
0.064 0.3513
0.8074
BC 0.032 1 0.032 0.26 0.6282
A2 12.95 1 12.95 102.46 <0.0001
B2 1.22 1 1.22 9.67 0.0171
C2 0.82 1 0.82 6.49 0.0383
残差Residuals 0.88 7 0.13
失拟项Lack of fit 0.34 3 0.11 0.85 0.5341 ns
净误差Pure error 0.54 4 0.13
总差Total 24.40 16
R2-0.9637 R2adj-0.9171 R2pred-0.9393
Adeq Precision-12.813 C.V. %-3.54
注:***,P<0.001;ns,不显著。Note: ***,P<0.001. ns means no significance.
2.3.3 响应面分析及最佳发酵条件的确定 根据回归方程绘制响应面和等高线图,结果如图2、3、4所示。由图可知,培养时间(A)、蛋白胨含量(B)的交互作用以及培养时间(A)、酵母粉含量(C)的交互作用显著,而蛋白胨含量(B)和酵母粉含量(C)交互作用不明顯。从响应图和模型分析可知回归方程存在最大值,最优条件为:培养时间9.40 d,蛋白胨1.21 %,酵母粉1.03 %时,白僵菌产孢量预测最优值为1.17×1010个/g。
由图2可知,当培养时间(A)处于最优值时,随着蛋白胨含量(B)的增加,白僵菌孢子产量逐渐升高,但升高幅度不明显,表明蛋白胨含量对白僵菌孢子产量有一定的影响。当蛋白胨的含量处于一定范围内,随着培养时间的延长,白僵菌孢子产量先增加后减少,变化幅度较大,表明培养时间的变化对白僵菌孢子产量具有显著的影响,培养时间过短或过长都不利于白僵菌孢子产量的提高。培养时间与蛋白胨含量交互作用的等高线图呈椭圆形,表明交互作用显著。
图2 培养时间(A)与蛋白胨含量(B)交互作用对白僵菌产孢量的响应面与等高线图
Fig. 2 Surface and contour plot showing interactions between incubation time (A) and peptone concentration (B) on spore content of Beauveria bassiana
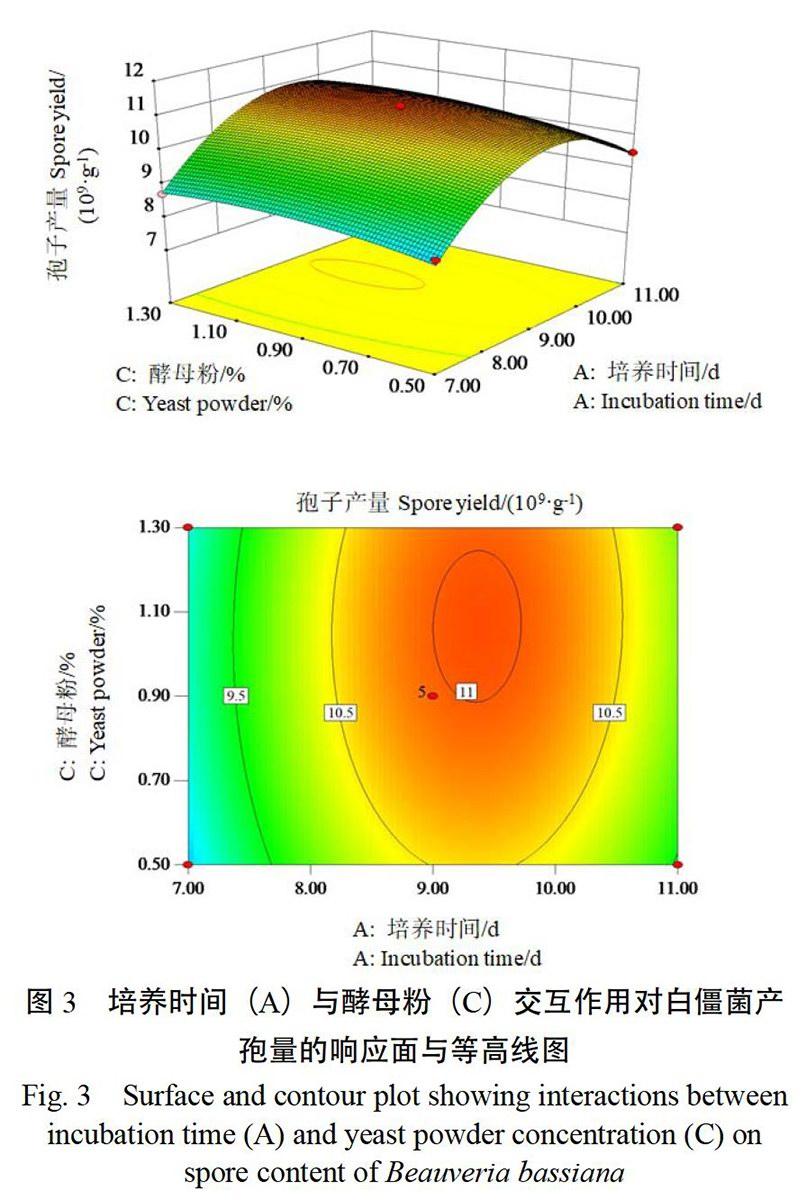
由图3可知,当酵母粉含量(C)处于最优值时,随着培养时间(A)的逐渐延长,白僵菌孢子产量先增加后减少,表明培养时间的变化对白僵菌孢子产量具有显著的影响,培养时间过短或过长,都不利于固态发酵白僵菌孢子产量的增加。当培养时间处于一定范围内,随着酵母粉含量的增加,白僵菌孢子产量没有明显的变化,表明酵母粉含量对白僵菌孢子产量的影响不显著。培养时间和酵母粉含量交互作用的等高线图接近椭圆形,表明交互作用显著。
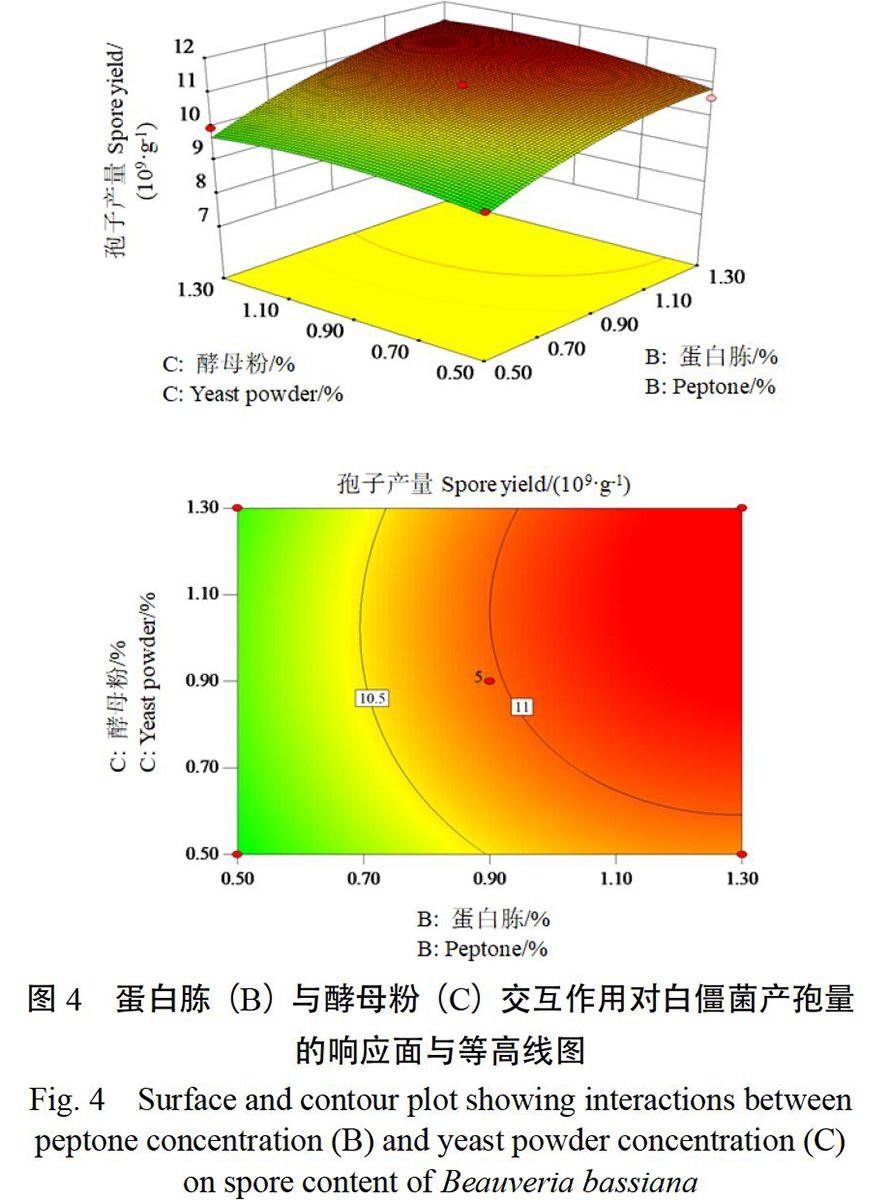
由图4可知,当蛋白胨含量(B)处于一定范围内,随着酵母粉含量(C)的增加,孢子产量几
乎没有变化,表明酵母粉含量对白僵菌产孢量影响不显著;当酵母粉含量处于一定范围内,随着蛋白胨含量的增加,白僵菌孢子产量逐渐增加,表明蛋白胨含量对白僵菌孢子产量影响明显。蛋白胨与酵母粉含量交互作用的等高线图接近圆形,表明交互作用不显著。
图3 培养时间(A)与酵母粉(C)交互作用对白僵菌产孢量的响应面与等高线图
Fig. 3 Surface and contour plot showing interactions between incubation time (A) and yeast powder concentration (C) on spore content of Beauveria bassiana
图4 蛋白胨(B)与酵母粉(C)交互作用对白僵菌产孢量的响应面与等高线图
Fig. 4 Surface and contour plot showing interactions between peptone concentration (B) and yeast powder concentration (C) on spore content of Beauveria bassiana
2.3.4 模型验证 通过BBD-RSM优化得到利用废弃烟梗发酵产白僵菌的最佳条件为:蛋白胨1.21%,酵母粉1.03%,培养时间9.40 d时,白僵菌孢子产量预测最优值为1.17×1010个/g。以此条件进行发酵试验,得到实际孢子产量为1.13×1010个/g(3次重复平均值),拟合度达到96.58 %,表明通过响应面法对发酵废弃烟梗产白僵菌工艺条件的优化合理而有效,具有实际意义。
3 讨 论
本试验利用废弃烟梗作为固态发酵白僵菌的主要基质,通过添加适量的葡萄糖作为碳源,适量蛋白胨和酵母粉作为有机氮源,NH4NO3为无机氮源补充营养,并添加无机盐NaH2PO4、MnSO4、FeSO4作为矿质元素促进白僵菌孢子的萌发和产量的提高。通过Plackett-Burman试验筛选出对白僵菌孢子产量影响最显著的3个因素:培养时间、蛋白胨和酵母粉含量。其中培养时间对白僵菌孢子产量的影响度和模型贡献率最高,表明废弃烟梗发酵培
养基可以为白僵菌的生长提供充足的营养,在一定范围内随着培养时间的延长,孢子产量呈现增加趋势,但考虑到过程中孢子产量、变化幅度以及工业生产成本等方面,应根据实际情况进行适当的控制。接种量是与发酵培养基利用率直接相关的参数,高的接种量尽管可以使菌体生长快、周期短,但后期可能因缺乏营养而无法提高孢子产量;而接种量太低则会造成营养利用不充分,导致发酵周期的延长,染菌机率增高[26],本试验中接种量的大小对白僵菌孢子产量的提高没有明显的促进作用,表明烟梗中营养成分丰富,可以满足白僵菌的生长,而且接种量过高也会增加生产成本,因此选用5%的接种量进行后续试验,结果表明白僵菌生长情况良好,孢子产量较高,因此在本试验中不需要补充额外的糖类,而且糖类含量过高易使发酵前期产酸增加,导致发酵基质pH降低,不利于白僵菌的生长。氮素是真菌合成核酸、氨基酸、细胞质和蛋白质的主要物质,有机氮源蛋白胨和酵母粉比无机氮源NH4NO3更适合白僵菌的生长,氮源的添加可以改善烟梗发酵培养基的碳氮比,提高发酵性能,提升产品品质[27]。在白僵菌的生长中,许多矿质元素都直接参与细胞的组成、能量的转移、维持原生质的胶质体系和渗透性,对菌体生长起着重要的作用[28]。本试验中NaH2PO4、MnSO4、和FeSO4的影响度和模型贡献率均较低,对孢子产量的提高影响不大,表明烟梗中无机盐的种类和含量丰富,在固态发酵白僵菌的过程中不需要补充额外的无机盐。
4 结 论
通过响应面优化,综合分析得到废弃烟梗发酵产白僵菌的最佳工艺条件为:发酵温度28 ℃,起始pH 6.0,m(烟梗)∶m(水)=1∶3.5,蛋白胨1.21 %,酵母粉1.03 %,培养时间9.40 d。在此条件下,白僵菌产孢量理论值为1.17×1010个/g,实际孢子产量为1.13×1010个/g,拟合度达到96.58 %。本研究探究并优化了废弃烟梗固态发酵白僵菌的工艺条件,显著提高了白僵菌产孢量,为废弃烟梗的资源化利用、烟草生物防治领域的后续研究和开发提供理论
依据与技术支持。
参考文献
[1] 路杨,徐文静,隋丽,等. 球孢白僵菌植物内生性及其应用研究进展[J]. 东北农业科学,2016,41(1):73-77.
LU Y, XU W J, SUI L, et al. Beauveria bassiana: endophytic colonization and applications in plant protection[J]. Journal of Northeast Agricultural Sciences, 2016, 41(1): 73-77.
[2] JACKSON M A, DUNLAP C A, JARONSKI S T. Ecological considerations in producing and formulating fungal entomopathogens for use in insect biocontrol[J]. Biocontrol, 2010, 55(1): 129-145.
[3] UGINE T A, WRAIGHT S P, SANDERSON J P. Microbial biological control potential of three strains of Beauveria bassiana s. l. against greenhouse shore fly Scatella tenuicosta: Assessment of virulence, mass production capacity, and effects on shore fly reproduction[J]. Biological Control, 2013, 65(3): 348-356.
[4] OWNLEY B H, GRIFFIN M R, KLINGEMAN W E, et al. Beauveria bassiana: endophytic colonization and plant disease control[J]. Journal of Invertebrate Pathology, 2008, 98(3): 267-270.
[5] SMITH S M, MOORE D, KARANJA L W, et al. Formulation of vegetable fat pellets with pheromone and Beauveria bassiana to control the larger grain borer, Prostephanus truncatus (Horn)[J]. Pesticide Science, 1999, 55(7): 711-718.
[6] 劉晨,朱耿平,陈易彤,等. 球孢白僵菌和绿僵菌对日本双棘长蠹林间防治效果的研究[J]. 环境昆虫学报,2015,37(2):343-347.
LIU C, ZHU G P, CHEN Y T, et al. Study on the field management of Sinoxylon japonicum using Beauveria bassiana and Metarhizium anisopliae[J]. Journal of Environmental Entomology, 2015, 37(2): 343-347.
[7] 张龙娃,康克,刘玉军,等. 美国白蛾高毒力球孢白僵菌菌株筛选[J]. 昆虫学报,2016,59(1):111-118.
ZHANG L W, KANG K, LIU Y J, et al. Evaluation of Beauveria bassiana isolates as potential agents for control of Hyphantria cunea (Lepidoptera: Arctiidae) [J]. Acta Entomologica Sinica, 2016, 59(1): 111-118.
[8] LOPEZ D C, SWORD G A. The endophytic fungal entomopathogens Beauveria bassiana and Purpureocillium lilacinum enhance the growth of cultivated cotton (Gossypium hirsutum) and negatively affect survival of the cotton bollworm (Helicoverpa zea)[J]. Biological Control, 2015, 89: 53-60.
[9] QAZZAZ F Q, AL-MASRI M I, BARAKAT R M. Effectiveness of Beauveria bassiana Native isolates in the biological control of the med-iterranean fruit fly (Ceratitis capitata)[J]. Advances in Entomology, 2015
(3): 44-55.
[10] DAVARI B, LIMOEE M, KHODAVAISY S, et al. Toxicity of entomopathogenic fungi, Beauveria bassiana and Lecanicillium muscarium against a field-collected strain of the German cockroach Blattella germanica (L.) (Dictyoptera: Blattellidae)[J]. Tropical Biomedicine, 2015, 32(3): 463-470.
[11] 張璐璐. 防治西花蓟马的球孢白僵菌液固双相发酵条件优化[D]. 北京:中国农业科学院,2016.
ZHANG L L. Optimization of liquid solid biphasic fermentation conditions for Beauveria bassiana in the control of Frankliniella occidentalis[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016
[12] BRI?KI, F, GOMZI Z, HORGAS N, et al. Aerobic composting of tobacco solid waste[J]. Acta Chimica Slovenica, 2003, 50(4): 715-729.
[13] 龙章德,陈皓睿,刘鸿,等. 利用果胶降解菌塔宾曲霉GYC 501改善梗丝品质及其发酵条件的优化[J]. 江西农业学报,2017,29(2):95-98.
LONG Z D , CHEN H R, LIU H, et al. Application of pectin-degrading fungus Aspergillus tubingensis GYC 501 in improvement of tobacco cut-stem quality and optimization of its fermentation conditions[J]. Acta Agriculturae Jiangxi, 2017, 29(2): 95-98.
[14] 尚善斋,雷萍,吴恒,等. 造纸法烟草薄片的研究进展[J]. 纸和造纸,2015,34(4):45-49.
SHANG S Z, LEI P, WU H, et al. Progress on the research of paper-making tobacco sheet[J]. Paper and Paper Making, 2015, 34(4): 45-49.
[15] ZHAO D, DAI Y, FENG G, et al. Chemical composition and fiber morphology of tobacco stem, scrap and dust[J]. Tobacco Science & Technology, 2016, 49(6): 36-44.
[16] ZHENG Y X, WANG Y L, PAN J, et al. Semi-continuous production of high-activity pectinases by immobilized Rhizopus oryzae using tobacco wastewater as substrate and their utilization in the hydrolysis of pectin-containing lignocellulosic biomass at high solid content[J]. Bioresource Technology, 2017, 241: 1138-1144.
[17] 孙平,汤朝起,王军,等. 烟梗人工醇化过程中主要化学成分的变化[J]. 烟草科技,2014,47(4):50-54.
SUN P, TANG Z Q, WANG J, et al. Variation of main chemical components in tobacco stem during artificial aging[J]. Tobacco Science & Technology, 2014, 47(4): 50-54.
[18] 赵德清,戴亚,冯广林,等. 烟梗、烟叶碎片和烟末的化学成分与纤维形态[J]. 烟草科技,2016,49(3):91-98.
ZHAO D Q, DAI Y, FENG G L, et al. Chemical composition and fiber morphology of tobacco stem, scrap and dust[J]. Tobacco Science & Technology, 2016, 49(3): 91-98.
[19] ZHENG Y, WANG Y, ZHANG J, et al. Using tobacco waste extract in pre-culture medium to improve xylose utilization for l-lactic acid production from cellulosic waste by Rhizopus oryzae[J]. Bioresource Technology, 2016, 218: 344-350.
[20] 王姣,陳彦好,张向磊,等. 废弃烟梗提取液为基质的产油脂酵母菌的筛选与鉴定[J]. 烟草科技,2015,48(8):15-19.
WANG J, CHEN Y H, ZHANG X L, et al. Screening and identification of oleaginous yeasts from fermentation of tobacco stem extract[J]. Tobacco Science & Technology, 2015, 48(8): 15-19.
[21] 李超,杜雷,席宇,等. 烟梗废料液态发酵生产苏云金芽孢杆菌的适宜条件筛选[J]. 烟草科技,2011(3):69-76.
LI C, DU L, XI Y, et al. Producing Bacillus thuringiensis by liquid state fermentation of waste stem[J]. Tobacco Science & Technology, 2011(3): 69-76.
[22] 郭大城,张可可,董贵彬,等. 深红酵母JLC固态发酵废弃烟梗制备类胡萝卜素研究[J]. 天然产物研究与开发, 2015,27(2):232-235.
GUO D C, ZHANG K K, DONG G B, et al. Carotenoids production by Rhodotorula rubra JLC under solid state fermentation of waste tobacco stems[J]. Natural Product Research and Development, 2015, 27(2): 232-235.
[23] 沈萍,陈向东. 微生物学实验[M]. 第4版. 北京:高等教育出版社,2007.
SHEN P, CHEN X D. Microbiology experiment[M]. 4th ed. Beijing: Higher Education Press, 2007.
[24] SHEN L, MORRIS M D. Augmented Plackett–Burman designs with replication and improved bias properties[J]. Journal of Statistical Planning & Inference, 2016, 179: 15-21.
[25] FATIMA B. Plackett Burman Design[M]. Holland: Elsevier Science Publishers B. V, 2014.
[26] 李华祥. 高产孢白僵菌的发酵与茶叶病害虫防治[D]. 无锡:江南大学,2012.
LI H X. Fermentation of Beauveria bassiana in control of tea pests[D]. Wuxi: Jiangnan University, 2012.
[27] 张亚平. 防治蓟马的白僵菌营养和发酵条件研究[D]. 北京:中国农业科学院,2014.
ZHANG Y P. Study on the nutrition and fermentation conditions of Beauveria bassiana in control of Frankliniella occidentalis[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014
[28] 朱静. 球孢白僵菌适应环境pH变化及胞内pH稳态维持的遗传分子基础及其对生物防治潜能的贡献[D]. 杭州:浙江大学,2016.
ZHU J. Genetic molecular basis of adaptation to change of environmental pH and homeostasis of intracellular pH and its contribution to biocontrol potential of Beauveria bassiana[D]. Hangzhou: Zhejiang University, 2016.
