烤烟不同生长发育时期叶片保水力变化特征
2018-05-14许志文张小全胡育玮魏星张鋆鋆郭传滨杨立均夏宗良
许志文 张小全 胡育玮 魏星 张鋆鋆 郭传滨 杨立均 夏宗良


摘 要:为探明烤烟不同生长发育时期叶片保水力变化特征,以抗旱性不同的3个烤烟品种移栽后10、30、50和70 d的离体叶片为材料,研究了不同发育时期叶片保水力、叶片失水24 h前后抗氧化酶活性、激素和抗逆胁迫响应基因表达的变化特征。结果表明,品种、发育时期以及两者互作对叶片保水力的贡献率分别为63.09%、24.65%、12.25%,3因素均对烤烟叶片保水力有极显著的影响。3个品种的叶片保水力表现为植株发育后期相对较高,同一发育时期为豫烟6号最高,ND202最低。叶片失水后抗氧化酶活性(SOD、POD、CAT)均表现升高,其中以豫烟6号增幅最大,SOD与POD活性在植株发育后期增幅较大;MDA含量与相对电导率增幅为豫烟6号最小,各品种在植株發育后期增幅较小;叶片失水后ABA含量升高,IAA含量略有降低,烤烟发育后期IAA、CTK和GA含量明显降低;叶片失水后胁迫响应基因(AREB、CDPK2、LEA5、ERD10C)表达量显著升高,以豫烟6号增幅最大,各时期增幅均表现出豫烟6号>K326>ND202,与品种间叶片保水力趋势相一致。本试验说明品种的遗传因素是影响烤烟叶片保水力的关键因素,各时期均可采用叶片保水力进行抗旱鉴定。
关键词:叶片保水力;生长发育时期;品种因素;胁迫响应基因
中图分类号:S572.01 文章编号:1007-5119(2018)02-0017-08 DOI:10.13496/j.issn.1007-5119.2018.02.003
Characteristics of Leaf Water Retention Capacity in Flue-cured Tobacco at Different Growth Stages
XU Zhiwen1, ZHANG Xiaoquan1*, HU Yuwei1, WEI Xing1, ZHANG Yunyun1, GUO Chuanbin2,
YANG Lijun2, XIA Zongliang3
(1. College of Tobacco Sciences, Henan Agricultural University, Zhengzhou 450002, China; 2. Zhumadian Tobacco Company of Henan Province, Zhumadian 463000, China; 3. College of Life Sciences, Henan Agricultural University, Zhengzhou 450002, China)
Abstract: In order to elucidate the characteristics of leaf water retention at different developmental stages of flue cured tobacco, excised leaves of three varieties Yuyan 6, ND202 and K326 with different drought resistance 10, 30, 50 and 70 d after transplanted were used as materials to analyze the change of leaf water retention, antioxidant enzyme activities, hormone and stress resistance gene expression. The results showed that variety, growth stage and their interaction all had significant effects on the water holding capacity, with the contribution rates being 63.09%, 24.65% and 12.25%, respectively. The water holding capacity of leaves of the three varieties was relatively higher at the late stage, with Yuyan6 being the highest and ND202 being the lowest at the same development stage. The activities of antioxidant enzymes (SOD, POD, CAT) were all increased after dehydration, and the increase of Yuyan 6 was the largest. The activities of SOD and POD increased greatly at the late stage. The increase of MDA content and relative conductivity of the three varieties were lower at later stage, and Yuyan6 had the lowest increase. After dehydration, the content of ABA increased, the content of IAA decreased slightly, and the contents of IAA, CTK and GA decreased obviously at the later stage. The expression levels of four stress responsive genes (AREB, CDPK2, LEA5, ERD10C) increased greatly after dehydration, and the largest increase was found in Yuyan 6, followed by K326 and ND202, which is consistent with the trend of water retention between varieties. The results suggested that the genetic factors of the varieties were the key factors affecting water holding capacity of tobacco, and leaf water retention could be used in drought resistance identification at different developmental stages in the field.
Keywords: leaf water retention capacity; growth and development stage; variety factor; stress responsive gene
基金项目:河南省烟草公司驻马店市公司项目“驻马店烟区特色烤烟品种筛选与配套技术研究”(ZMDKJ201502);河南省烟草公司重点项目
“烤烟抗旱分子标记的开发及其育种应用潜力研究”(HYKJ201401)
作者简介:许志文(1992-),男,在读硕士,研究方向:烟草遗传育种。E-mail:xzw15218026@163.com。*通信作者,E-mail:zxq013415@163.com
收稿日期:2017-10-27 修回日期:2018-01-08
水分是调控烟株生长发育并影响烤烟产质量的关键因素。持续水分胁迫容易导致烤烟光合作用受阻,生长发育受到抑制,内在化学成分失调,产质量大幅下降[1-3]。叶片保水力是叶片在离体条件下保持自身水分的能力,作为重要抗旱性鉴定指标具有操作方法简单、样本容量大的优点,在小麦[4]、玉米[5]、油菜[6]、烟草[7]、红树等[8]抗旱性鉴定中有大量应用。吴兆苏[9]认为测定离体叶片保水力可能是筛选小麦抗旱性最有希望的技术。
大量研究表明叶片保水力的大小与植物遗传性、细胞特性和原生质胶体性质有关,同时与叶片发育状态相关。CLARKE等[10-11]对不同发育阶段不同基因型的硬质小麦离体叶片保水力进行了测定,发现不同发育时期叶片保水力存在差异,得出了需在抽穗期之前完成取样的结论。张小全等[12]研究表明,烤烟叶片保水力的合适测定时间为离体叶片自然失水24 h,且相同发育时期不同叶位之间保水力差异不显著。而不同烤烟品种在不同发育时期叶片保水力变化特征却不清楚。本研究以抗旱性不同的3个烤烟品种豫烟6号、ND202和K326为材料[13],研究了烤烟品种与发育时期对叶片保水力的影响,测定了不同发育时期3个烤烟品种抗氧化酶活性、激素和抗逆胁迫响应基因表达量的变化特征,以期探明品种与发育时期对叶片保水力影响的机制,为应用叶片保水力作为烟草抗旱性鉴定和抗旱育种选择指标提供依据。
1 材料与方法
1.1 试验材料与处理
选用抗旱性不同的豫烟6号、ND202和K326为试验品种。试验于2016年在河南农业大学许昌校区进行,选取3个品种整齐一致的烟苗于4月30日移栽至大田,株距55 cm,行距120 cm。每品种种植4行,每行100株。供试土壤为轻壤土,土壤中碱解氮含量为48.8 mg/kg,速效磷含量为51.7 mg/kg,速效钾含量为103.9 mg/kg,pH为7.7。田间管理措施按当地优质烟叶栽培技术規程进行。
于移栽后10 d(还苗期)、30 d(团棵期)、50 d(旺长期)和70 d(圆顶期),分别选取各烟株正常生长,叶片完整、朝向一致中部叶片9片,用于叶片保水力及相关生理指标的测定。
1.2 测定指标与方法
1.2.1 叶片保水力的测定 采用离体叶片自然失水法测定,具体步骤如下:早上8:00—9:00在田间摘取叶片后,迅速装入塑料封口袋密封,置于冰盒内迅速带回人工气候室(温度25±1 ℃,相对湿度40%)。将样叶取出,迅速擦干叶片上沾有的水分,选取3片叶用电子天平称取叶片鲜质量(mf0),而后悬挂于人工气候室内,24 h后再次称其质量,获得每个样品的mf24。然后将称量后的叶片105 ℃杀青30 min,95 ℃烘干至恒质量,称取干质量(md)。分别在0 h和24 h各选取6片叶,用于相关生理指标含量变化测定。叶片保水力采用下面公式计算:
叶片保水力(%)= (mf24-md)×100/(mf0-md)
1.2.2 生理指标测定 抗氧化酶活性测定参考文献[14]的方法。丙二醛(MDA)含量和相对电导率参照李合生[15]的方法测定。可溶性蛋白含量测定参照考马斯亮蓝法测定[16]。脱落酸(ABA)、生长素(IAA)、细胞分裂素(CTK)和赤霉素(GA)含量的测定采用酶联免疫吸附分析法[17]。
1.2.3 胁迫响应基因的相对表达量分析 样品总RNA的提取按照美国Invitrogen公司TRIZOL试剂说明书操作,反转录参照立陶宛Fermentas公司的RevertAid TM First Strand cDNA Synthesis Kit产品说明书进行,合成第一链cDNA。PCR扩增采用BioRad iQ5实时定量PCR仪进行。反应结束后将荧光值(CT)导入Excel 2007,按照公式2-△△CT计算目的基因的相对表达量[18],并绘制基因表达差异图。AREB、CDPK2、ERD10C和LEA5为4个研究较多的干旱胁迫响应基因[19-22]。内参基因(ACTIN2)和4个胁迫响应基因的引物信息参考文献[23]。
1.3 数据处理
试验数据的统计分析采用DPS 7.05和Excel 2007进行。
2 结 果
2.1 不同发育时期叶片保水力变化
由表1看出,品种、发育时期以及两者互作3个因素均对烤烟叶片保水力有极显著的影响,品种、发育时期以及两者互作对叶片保水力的贡献率分别达到了63.09%、24.65%和12.25%。说明品种因素对叶片保水力起着关键作用,不同发育时期叶片状态以及叶片与生长环境的互作也对烤烟叶片保水力有重要的影响。
由表2看出,3个品种的叶片保水力均表现为叶片发育后期相对较高,豫烟6号和K326移栽后50 d左右叶片保水力达到最大,ND202移栽后70 d左右叶片保水力达到最大。移栽后10、30、50和70 d各品种中部叶片的保水力均表现为豫烟6号最高、ND202最低,豫烟6号在4个时期均显著高于ND202。说明烤烟不同发育时期的叶片保水力是变化的,但在相同发育时期品种间的趋势是一致的。
2.2 不同发育时期叶片离体失水前后生理指标变化
3个品种不同发育时期叶片失水24 h前后的生理指标测定结果显示,不同发育时期叶片失水后抗氧化酶活性均呈现不同程度的上升,其中以豫烟6号增幅最大(图1A、B、C),说明豫烟6号抗逆反应较为高效。3个品种叶片失水前后SOD活性的增幅随发育时期呈不断扩大趋势(图1A),POD活性增幅也表现为移栽后50 d较高(图1B),说明随着叶片发育,各结构功能趋于完善,抗逆反应变得更加高效。不同发育时期叶片经过24 h失水,叶片可溶性蛋白含量均增加,且同时期均为豫烟6号增幅最大(图1E)。烤烟叶片失水后相对电导率以及MDA含量均不同程度增加,同时期以豫烟6号增幅最小,ND202增幅最大(图1D、F),说明豫烟6号叶片细胞伤害程度较轻,ND202最重,这与同时期保水力趋势相一致。MDA含量、可溶性蛋白含量以及相对电导率增幅均在移栽后70 d时表现出最小(图1D、E、F),与此时期气温较高,叶片蒸腾失水较多且频繁,且叶片已发育完全,使叶片对脱水有了较强的适应能力,叶片细胞抗脱水能力也有所增强有关。
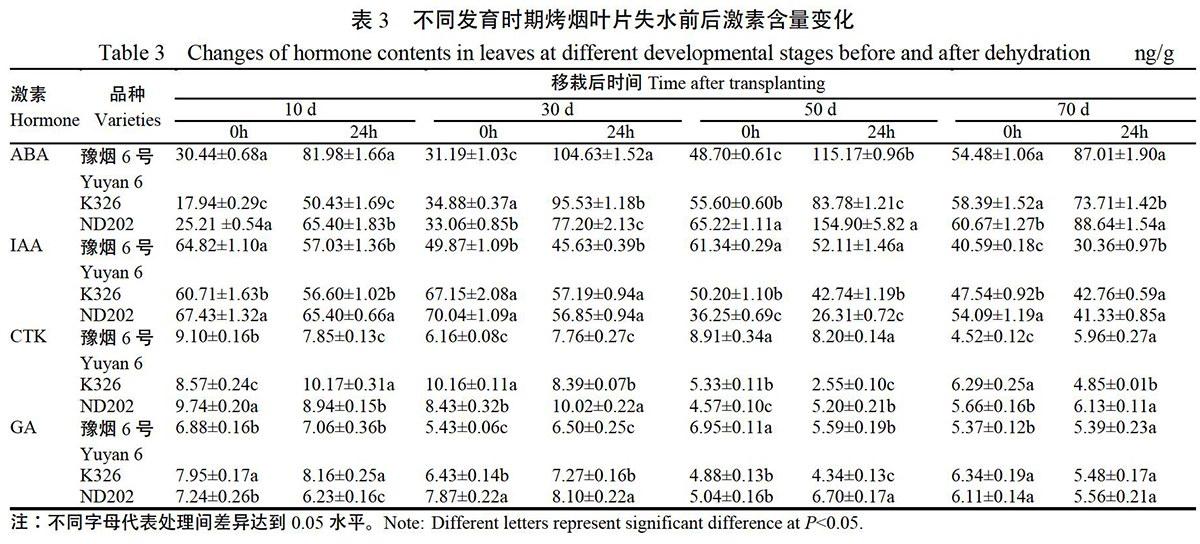
2.3 不同发育时期叶片离体失水前后激素含量变化
表3显示,各品种叶片失水后ABA含量均表现升高,豫烟6号增幅较大,说明其抗逆反应较为高效。IAA含量略有降低。ABA水平随发育时期呈先升后降趋势,移栽后50 d时达到最高值。促进植物生长发育的IAA、CTK、GA含量均表现为叶片发育后期明显低于前期,与后期叶片发育逐渐完成,生长需求降低一致。
2.4 不同发育时期烤烟叶片抗逆基因相对表达量变化
4个干旱胁迫响应基因的相对表达量分析结果显示(图2),叶片失水24 h后4个基因的相对表达量均显著升高,各时期增幅均表现出豫烟6号>K326>ND202,与品种间叶片保水力趋势相一致。不同发育时期3品种鲜叶片的各胁迫应答基因表达量均无显著差異,说明在正常水分条件下品种间胁迫响应基因表达状况较为接近,在感受到水分亏缺后不同品种的胁迫应答基因会做出不同程度的反应,从而造就了不同品种叶片保水力不同,抗旱性也不同。说明不同烤烟品种的叶片保水力差异主要是由品种的遗传因素决定的。
3 讨 论
保持水分散失与自身吸水率间的平衡是植物维持自身含水量的重要途径[24]。植物的吸水主要通过根系,但水分散失主要通过叶片。叶片离体以后吸水途径丧失,只能通过保持自身水分来维持细胞平衡,此过程中会发生一系列代谢反应并最终通过叶片保水力反映出来。因此,离体叶片的保水力可以反应植物原生质的耐脱水能力和叶片角质层的保水能力。对3个烤烟品种不同发育时期叶片离体24 h前后抗氧化酶活性、MDA含量、相对电导率、激素和抗逆胁迫响应基因表达量的变化特征研究发现,保水力高的品种豫烟6号胁迫响应相关基因AREB、CDPK2、LEA5和ERD10C的相对表达量增幅均最大,干旱胁迫信号激素ABA含量的上升幅度、清除活性氧应激的抗氧化酶(SOD、POD、CAT)活性的上升幅度在各时期也均最大。说明烤烟品种本身的遗传因素是影响烤烟叶片保水力的关键因素。
本研究发现,发育时期因素对烤烟叶片保水力有极显著的影响,贡献率达到24.65%,不同发育时期的烤烟叶片保水力存在显著差异,与CLARKE等[10-11]在小麦上的研究结果一致。3个品种的叶片保水力均表现为叶片发育后期相对较高。移栽后10d豫烟6号和K326中部叶的叶片保水力均极显著的低于之后时期,ND202则是在移栽后70 d叶片保水力才显著的增加,与田间ND202前期地上部分生长发育较慢,叶片伸长和扩展较其他2个品种滞后的现象一致。烟草叶片的生长分为3个时期,一是细胞分裂生长期,即从幼叶出现到定型叶长的20%~40%为止,叶片增大以细胞分裂增加为主;二是细胞伸长生长期,从定型叶长度的20%~40%到70%~80%,此时期叶面积的增大以细胞伸长为主;三是细胞腔隙扩展期,从定型叶长度的70%~80%到叶片定长为止,叶片增大以细胞间隙填充为主[25]。移栽后30 d到70 d,烤烟中部叶片逐渐由细胞分裂生长期变化到细胞腔隙扩展期,叶片内含物增加,叶片组织结构由疏松变紧凑,且角质层发育逐渐完整,因此叶片保水力随着发育时期的推进逐渐增加。田间烤烟生长发育后期气温较高,叶片频繁遭遇大量蒸腾失水,植株常处于水分胁迫状态,IAA、GA等生长发育相关激素含量会降低以减缓自身生长,提高抗旱力,减轻逆境造成的伤害[26],这可能也是本试验中烤烟发育后期保水力较高的原因。烤烟叶片的保水力高低与品种本身的遗传因素、叶片的发育时期均相关,品种的遗传因素是影响烤烟叶片保水力的关键因素。因而,在应用叶片保水力作为烟草抗旱性鉴定和抗旱育种选择指标时,在相同的环境条件、相同的发育时期、相同的叶位取样鉴定,叶片保水力的高低可反映出不同材料抗旱性能的强弱。而不同品种叶片自身结构对叶片保水力的影响,以及品种间胁迫响应基因表达高低不同的原因尚不明确,可对叶片超微结构、角质层及抗逆基因的时空表达规律等进一步深入研究。
4 结 论
烤烟品种、发育时期以及两者互作均对烤烟叶片保水力有极显著的影响,品种因素对叶片保水力的贡献率达到了63.09%。叶片保水力随着发育时期
的推进逐渐增加,同一发育时期叶片保水力均为 豫烟6号最高,ND202最低。不同发育时期3个烤 烟品种抗氧化酶活性、激素和抗逆胁迫响应基因表 达量变化特征的研究结果也证实,品种的遗传因素 是影响烤烟叶片保水力的关键因素,在烤烟田间生 长各时期均可测定叶片保水力进行抗旱鉴定。
参考文献
[1]陈洁宇,周冀衡,邓小刚,等.干旱胁迫对不同育苗方式烤烟生长和生理生化特性的影响[J].烟草科技,2011(8):84-88.
CHEN J Y, ZHOU J H, DENG X G, et al. Effects of drought stress on growth, physiological and biochemical characteristics of flue-cured tobacco from seedling cultured by different seedbed systems[J]. Tobacco Science&Technology, 2011(8): 84-88.
[2]董顺德,张延春,孙德梅,等. 干旱胁迫下烤烟矿质养分含量与烟叶产、质量的关系[J].烟草科技,2005(2):30-34.
DONG S D, ZHANG Y C, SUN D M, et al. Relationship between content of mineral nutrients and yield and quality of flue-cured tobacco under dought stress[J]. Tobacco Science&Technology, 2005(2): 30-34.
[3]胡玮,康俊,刘阳,等.干旱胁迫对不同烟草品种光合生理特性的影响[J].中国烟草科学,2013,34(2):69-73.
HU W, KANG J, LIU Y, et al. The effect of drought stress on photosynthetic physiological characteristics of the different tobacco varieties[J]. Chinese Tobacco Science, 2013, 34(2): 69-73.
[4]WINTER S R, MUSIK K B. Evaluation of screening technique for breeding drought-resistant winter wheat[J]. Crop Science, 1988, 28: 512-516.
[5]徐蕊,王启柏,张春庆,等.玉米自交系抗旱性评价指标体系的建立[J]. 中国农业科学,2009,42(1):72-84.
XU R, WANG Q B, ZHANG C Q, et al. Drought-resistance evaluation system of maize inbred[J]. Scientia Agricutura Sinica, 2009, 42(1): 72-84.
[6]王丹丹.甘蓝型油菜遗传图谱构建及苗期耐旱相关性状的QTL定位[D].重庆:西南大学,2014.
WANG D D. Mapping and QTL analysis of genes to drought tolerance in Brassica napus L.[D]. Chongqing: Southwest University, 2014.
[7]钱泽勇,张会龙,荆晓姝,等.胡杨Ring finger E3连接酶PeRH2提高烟草耐旱机制研究[J].基因组学与应用生物学,2015,34(3):454-463.
QIAN Z Y, ZHANG H L, JING X S, et al. Overexpression of ring finger E3-ligase gene PeRH2 from populus euphratica in tobacco enhances drought tolerance in transgenic plants[J]. Genomics and Applied Biology, 2015, 34(3): 454-463.
[8]LECHTHALER S, ROBERT E M R, TONN? N, et al. Rhizophoraceae mangrove saplings use hypocotyl and leaf water storage capacity to cope with soil water salinity changes[J]. Frontiers in Plant Science, 2016, 7: 1-13.
[9]吴兆苏.小麦育种学[M].北京:农业出版社,1990:289-296.
WU Z S. Wheat breeding[M]. Beijing: Agriculture Press, 1990: 289-296.
[10]CLARKE J M, Mccaig T N. Excised-leaf water retention capability as an indicator of drought resistance of triticum genotypes[J]. Canadian Journal of Plant Science, 1982, 62(3): 571-578.
[11]CLARKE J M. Phenological variability: effect on determination of leaf water loss in wheat[J]. Crop Science, 1992, 32(6): 1457-1459.
[12]張小全,许志文,阚红赢,等.不同叶位和离体时间对烤烟叶片保水能力的影响[J]. 中国烟草学报,2017,23(4):33-39.
ZHANG X Q, XU Z W, KAN H Y, et al. Effects of different leaf positions and excised leaf dehydration time on water retention capacity of flue-cured tobacco leaves[J]. Acta Tabacaria Sinica, 2017, 23(4): 33-39.
[13]任庆成,陈秀华,张生杰,等.不同烤烟品种抗旱生理特征比较研究[J].西北植物学报,2009,29(10):2019-2025.
REN Q C, CHEN X H, ZHANG S J, et al. Comparison of drought resistance characteristics of different flue-cured tobacco varieties[J]. Acta Botanica Boreali-Occidentalia Sinica. 2009, 29(10): 2019-2025.
[14]LI Q, YU B, GAO Y, et al. Cinnamic acid pretreatment mitigates chilling stress of cucumber leaves through altering antioxidant enzyme activity[J]. Journal of Plant Physiology, 2011, 168(9): 927-934.
[15]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:280-283.
LI H S. Principles and techniques of plant physiological biochemical experiment[M]. Beijing: Higher Education Press, 2000: 280-283.
[16]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(s 1-2): 248-254.
[17]VERSLUES P E, AGARWAL M, KATIYARAGARWAL S, et al. Methods and concepts in quantifying resistance to drought, salt and freezing, abiotic stresses that affect plant water status[J]. Plant Journal, 2006, 45(4): 523-539.
[18]LIVAK K J, SCHMITTGEN T D, et al. Analysis of relative gene expression date using real-time quantitative
PCR and the 2-ΔΔCT method[J]. Method, 2001, 25: 402-408.
[19]FUJITA Y, YOSHIDA T, YAMAGUCHISHINOZAKI K. Pivotal role of the AREB/ABF-SnRK2 pathway in ABRE-mediated transcription in response to osmotic stress in plants[J]. Physiologia Plantarum, 2013, 147(1): 15-27.
[20]HARMON A C, GRIBSKOV M, GUBRIUM E, et al. The CDPK superfamily of protein kinases[J]. New Phytologist, 2010, 151(1): 175-183.
[21]YANG L, LI W, JIANG S, et al. Group 5 LEA protein, ZmLEA5C, enhance tolerance to osmotic and low temperature stresses in transgenic tobacco and yeast[J]. Plant Physiology & Biochemistry, 2014, 84: 22-31.
[22]LIU X, LIU S, WU J, et al. Overexpression of arachis hypogaea NAC3 in tobacco enhances dehydration and drought tolerance by increasing superoxide scavenging[J]. Plant Physiology & Biochemistry, 2013, 70(1): 354-359.
[23]霍勇錦,徐紫薇,王燃,等.干旱胁迫下嫁接对烟草抗氧化酶活性、膜脂过氧化及胁迫响应基因表达的影响[J].烟草科技,2016,49(8):14-20.
HUO Y J, XU Z W, WANG R, et al. Effects of grafting on antioxidant enzyme activities, membrane lipid peroxidation and stress-responsive gene expression in tobacco under drought stress[J]. Tobacco Science&Technology, 2016, 49(8): 14-20.
[24]BATES J W. Book review: desiccation and survival in plants: drying without dying[J]. Quarterly Review of Biology, 2003, 78(4): 79-80.
[25]刘国顺. 烟草栽培学[M].北京:中国农业出版社,2003:221-222.
LIU G S. Tobacco cultivation[M]. Beijing: China Agriculture Press, 2003: 221-222.
[26]李长宁,谢金兰,王维赞,等.水分胁迫下甘蔗差异表达基因筛选及激素相关基因分析[J].作物学报,2015,41(7):1127-1135.
LI C N, XIE J L, WANG W Z, et al. Screening of differentially expressed genes and analysis of plant hormones related genes under water stress in sugarcane[J]. Acta Agronomica Sinica, 2015, 41(7): 1127-1135.
