火炬树枯枝病病原菌鉴定
2018-05-14贾含琪刘忠玄陈洁周仪董爱荣刘雪峰
贾含琪 刘忠玄 陈洁 周仪 董爱荣 刘雪峰
摘 要:【目的】确定引起火炬树枯枝病的病原种类,为针对性地防治枯枝病提供理论依据。【方法】采集发病阶段植物标本,对病原菌进行分离、纯化、致病性测定以及形态特征观测、rDNA-ITS序列分析,对病原菌种类进行鉴定。【结果】经单孢分离后,所获得的菌株对火炬树枝条可致病,并产生典型症状,通过显微观察发现其载孢体生于皮层下,成熟后子座外露,三角形或烧瓶状,分生孢子器暗色,埋生,后突起,有孔;分生孢子单孢、无色, 有两个类型,纺锤形(α分生孢子)和线状、笔直或折曲柄(β 分生孢子)。对比相关资料病原菌的分生孢子及分生孢子器的大小和形态与漆树拟茎点霉(Phomopsis rhois)一致,以本菌株DNA为模板,扩增得到全长为552 bp的DNA 片段,并获得该菌的rDNA-ITS 序列,发现其与拟茎点霉(Phomopsis sp)的相似性高达100%。【结论】通过形态学和分子生物学鉴定结果表明,引起火炬树枯枝病的病原菌为漆树拟茎点霉Phomopsis rhois,火炬树为P. rhois国内新寄主。
關键词:火炬树;枯枝病;病原菌;漆树拟茎点霉
中图分类号:S763.15;S482.2文献标识码:A文章编号:1006-8023(2018)06-0020-05
Pathogen Identification of Rhus typhina Stem Blight Disease
JIA Hanqi, LIU Zhongxuan, CHEN Jie, ZHOU Yi, DONG Airong, LIU Xuefeng*
(College of Forestry, Northeast Forestry University, Harbin 150040)
Abstract: The species of pathogen causing the Rhus typhina stem blight disease were identified to provide a theoretical basis for controlling the disease. Infested branches specimens at developing stages were collected. The pathogens were isolated, purified, pathogenicity tested. After observing morphological characteristics and analyzing rDNA-ITS sequences, the pathogen species were identified. Strains obtained by isolating single spore could cause disease to the Rhus typhina and produce typical symptoms. Microscopic observation revealed that conidiomata was born under the bark layer. When it matured, it would expose out of stroma, showing a triangle of flask shape. At the beginning, pycnidium was dark and immersed, and then it was protuberant and had ostiole. Conidia was one celled and transparent, with two types of fusoid (α conidia) and curved or bent stylospores (β conidia). Comparing the relevant data, the size and morphology of the pycnidium and conidia of the pathogen were consistent with Phomopsis rhois. The DNA of strain was used as a template, and one rDNA-ITS fragment of 552 bp was amplified. Its similarity to Phomopsis sp. was found to be as high as 100%. The results of morphological and molecular identification showed that Phomopsis rhois was the pathogen causing Rhus typhina stem blight disease and the Rhus typhina was the new host of P. rhois.
Keywords: Rhus typhina; stem blight disease; pathogens; Phomopsis rhois
0 引言
火炬树(Rhus typhina L.),又名鹿角漆,为漆树科盐肤木属落叶小乔木[1]。原产于北美,在20世纪50年代,作为观赏植物被中国科学院植物研究所引种到北京,由于火炬树可作为荒山绿化及盐碱荒地风景林树种[2-3]而被人们关注并逐渐推广至全国各地,渐渐地人们发现其广泛的用途。火炬树根蘖能力强,易栽培[4-5],通过根蘖繁殖可以建立种群[6],被认为是水土保持的优良树种[7],成活率高,适应性强,因此具有很好的护坡效果[8]。由于其油脂少不易燃烧,也可以起到防火作用[9-10]。树皮、树叶含有大量单宁[11],叶还可以提取栲胶[12],树皮可入药,种子含油蜡,可以制造蜡烛等工业原料[13]。由于该树种适应能力强,抗病性也较强,为此关于火炬树病害类文章报道的较少,国内韩冰一[14]记载了由变壳孢(Hendersonula sp.)引起的火炬树枯枝病、裂褶菌引起的腐朽病和链格孢(Alternaria sp.)引起的火炬树叶斑病。
拟茎点霉属[Phomopsis(Sacc)Bubak]是半知菌亚门(Deuteromycotina)、腔孢纲(Coelomycetes)、球壳孢目(Sphacropsidales)中的真菌属、有性态是间座壳属(Diaporthe)[15-16]。1882年,P.A.Saccardo首次提出Phomopsis,仅看作是茎点霉(Phoma)属下的非特定分类等级[17]。在1980年,Suton B.C在其专著中确定其属的定界[18],在1988年,Uecker搜集其7 800多个种及亚种的资料汇编成书。在1905年,Bubak将其用于属级水平,作为独立属的属名由此延用至今[18]。近年来,姜子德采用的RAPD以及核糖体RNA基因转录间隔区序列分析这两种技术均可对拟茎点霉属种类进行鉴定[19-20]。其分布广泛,热带及亚热带种类较多,主要为害被子植物及裸子植物,有时侵染苔藓和蕨类植物,引起溃疡、烂茎、果腐、叶枯、枝枯、根腐、树皮坏死等多种症状 [18]。本文则介绍了以Phomopsis rhois为病原菌的火炬树枯枝病,是火炬树生产中最主要的病害之一,可为害枝条,潜伏期较短,爆发性强,造成火炬树树势衰弱及枯死。
为了该病的防治和进一步研究奠定基础,通过病害症状、病原菌的形态学、致病性测定及rDNA-ITS区序列分析,明确火炬树枯枝病病原菌为Phomopsis rhois,国内未有记载,为国内新病害。
1 研究方法
1.1 病样采集
2017年4-5月从东北林业大学林场进行系统调查,观察火炬树枯枝病的症状特点,采集具有典型症状的发病标样,用塑料袋密封并带回实验室及时分离。
1.2 方法
1.2.1 病害症状观察
取火炬树枯枝病病害标本,利用实体解剖镜观察发病部位的症状特征。
1.2.2 病原菌的分离培养
将带有分生孢子器的枝条用75%的酒精消毒2 ~ 3 s,切取病部帶有分生孢子器的组织5 mm×3 mm,在超净工作台下接种于PDA培养基上进行病菌分离,放入培养箱中25 ℃恒温培养,待菌落长到适当大小,分离不同的菌落于PDA 培养基上进行纯化[22],观察各子实体的形态特征,各分离物接种于PDA 斜面培养基上进行保存留以备用。
1.2.3 致病性测定
按照柯赫氏法则,采集健康的火炬树枝条室内水培,进行针刺、烧伤和无伤接种。刺伤接种时,用灭菌针刺伤至木质部,烧伤接种时,用酒精灯烧伤枝条表皮,大约5s听到滋滋的响声。纯菌种接入PDA液体培养基中,放入25 ℃震荡培养箱中培养7 d左右至摇培出菌丝体,用纱布蘸取菌丝体液体2 ml覆盖在刺伤、烧伤、无伤伤口的枝条各15株,用纱布蘸取2 ml的无菌水覆盖在枝条的刺伤、烧伤、无伤伤口处上,各5株设为对照实验组,接种后在覆盖有纱布的接种处套袋保湿48 h。将接种后的枝条室温培养,作好标记,观察发病症状变化情况。发病后从病斑上再分离、纯化菌株。
1.2.4 病原菌形态学鉴定
(1)取野外以及新接种的发病枝条,徒手切片制作水载玻片,在光学显微镜下观察病原菌分生孢子器、分生孢子梗、分生孢子的形态,利用电子显微镜观察、测量数据大小、拍摄显微图片。
(2)病原菌菌落观察:将病原菌接种于PDA培养基上,放于25 ℃培养箱中恒温并黑暗条件下培养,每日观察并记录菌落形态、颜色和生长速率等特征。
1.2.5 r DNA-ITS 的 PCR 扩增与序列分析
(1)病原菌DNA 的提取:将病原菌菌株接种于PDA培养基上活化培养3 d,挑取直径为5 mm大小的菌丝块5块于PD培养液中,在25 ℃、
150 r/min震荡培养箱中培养7 d,收集菌丝体。采用Ezup柱式真菌基因组DNA抽提试剂盒(生工生物工程上海股份有限公司),按照使用说明书提取基因组DNA,置于-20 ℃冰箱保存备用。
(2)rDNA-ITS 序列扩增:选用真菌扩增的通用正向引物ITS1 (5 ′ -TCCGTAGGTGA ACCTGCGG-3 ′)和反向引物ITS4(5 ′ -TCCTCCGCTTATTGATATGC-3 ′)扩增。反应在25μL体系中进行,包括:1μLdNTPs(2.5mmol/L),0.2μLTaq酶(5U/μL),2.5μL10×PCR buffer,0.5μL primer ITS1(10μmol/L),0.5μL primer ITS4(10μmol/L),0.5 μL(约20 mg/L)基因组DNA,加ddH2O至25 μL。扩增程序为:94℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃修复延伸10 min,4 ℃
下保存。反应结束后,取μLL扩增产物,进行琼脂糖凝胶电泳检测。
(3)测序:PCR产物经回收目标DNA片段由生工生物工程(上海)股份有限公司进行测序。
(4)测序结果分析:测序结果用BLAST程序与NCBI中的核酸序列进行同源性分析比较,结合形态学鉴定来确定病原菌的种类和分类地位。
2 结果与分析
2.1 病原菌致病性测定
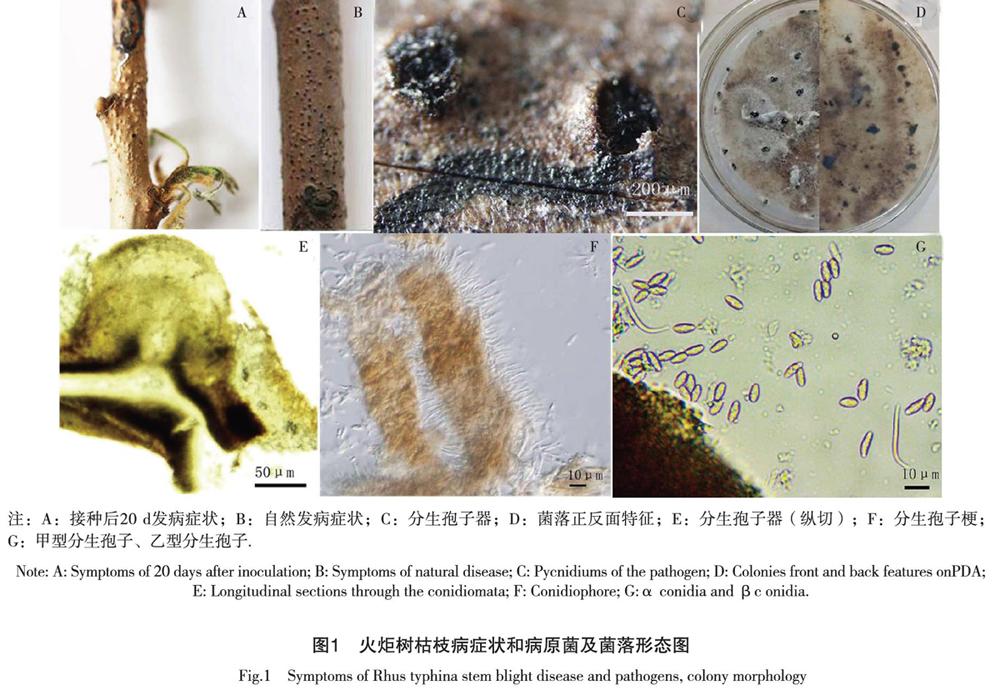
烧伤接种15株,其中13株感染病症,发病率为86%,刺伤接种15株,均无感病。此时的发病状态与自然发病状态相同,对接种枝条发病部位进行病菌再分离,分离的菌株与原枝条分离得到菌株的培养形状和形态特征一致。如图1所示。
2.2 火炬树枯枝病症状
火炬树枯枝病主要发生在枝条上,接种此病害后的枝条上嫩绿的叶片从叶片周边向叶基渐渐转至黄色,直至干枯,脱落,树势整体衰弱。接种20d时可观察到烧伤接种部位周边出现丘状突起,为病原菌的分生孢子器,嫩叶枯黄,当其遇水或空气潮湿的条件时,病枝突起处膨胀不规则开裂,露出埋生黑色的表面不光滑的分生孢子器。后期枝条枯死变为灰褐色。
2.3 病原菌形态特征
载孢体为真子座,生于皮层下,散生,初埋生,成熟后突起,三角形或烧瓶状,有孔口,孔口直径约为96.6 μm、单腔。分生孢子器内壁接有无色的分生孢子梗,分隔,合轴分枝,大小为(10.0 ~ 20)μm×(1.8 ~ 2.4) μm。甲型分生孢子,无色,单孢,纺锤型,孢子两端有两个大油球,(6 ~ 10) μm×(1.8 ~ 2.0) μm。乙型分生孢子无色,单孢,线状、笔直或弯曲或折曲柄,(13 ~ 20)μm×(0.9 ~ 1.2) μm。
2.4 病原菌的菌落形态
在PDA培养基上培养7 d左右菌落为白色绒毛状,从接种点开始逐渐向周边生长,自然光培养15 d左右,接种点周围的菌落产生色素,菌落白色绒毛的背面渐变成墨绿色呈放射型散乱分布在平板周边,自然光培养20d左右,白色菌落背面颜色渐深呈灰褐色的不规则同心环,有黑色分生孢子器出现,多个分生孢子器成簇状生长,周围比较干燥。
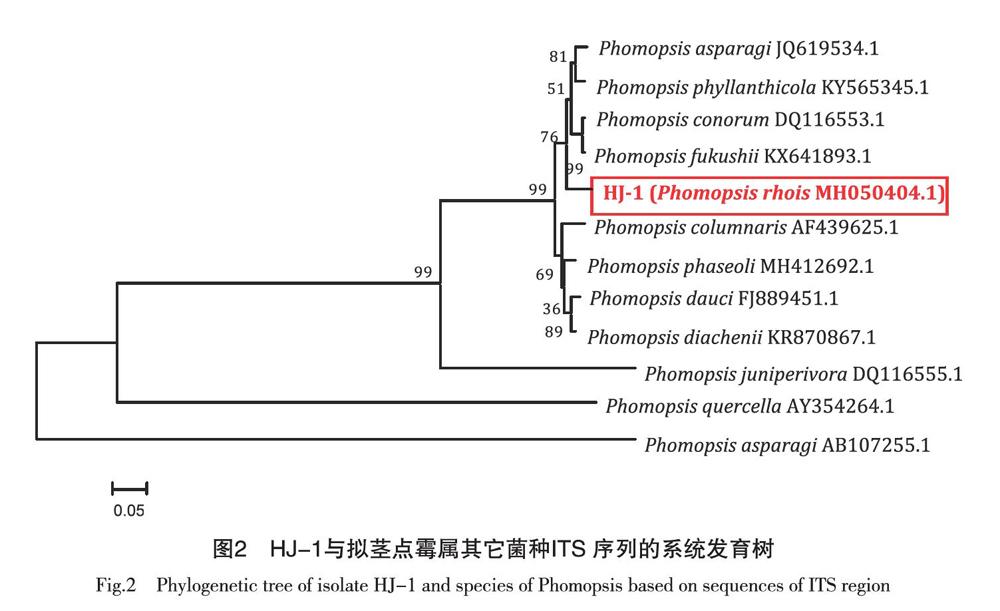
2.5 rDNA-ITS 序列分析
从菌株HJ-1提取DNA基因,通过真菌通用引物ITS1、ITS4进行PCR扩增,得到HJ-1菌株的rDNA-ITS序列,长度为552 bp。将所测得的rDNA-ITS序列在NCBI的BLAST进行比对,菌株HJ-1与拟茎点霉(Phomopsis sp.)相比较覆盖度均为100%、相似度为99%,菌株HJ-1应属于拟茎点霉属真菌。由于本种与Uecker(1988)、马莉(2004),描述的漆树拟茎点霉(Phomopsis rhois)特征基本一致[22-23],因此在NCBI 基因库中对Phomopsis rhois 的rDNA-ITS序列进行搜索,未搜索到本种序列,证明Uecker(1988)、马莉(2004)并未在NCBI基因库中上传本种的rDNA-ITS序列,因此本文将火炬树枯枝病病原菌HJ-1的序列在GenBank上进行注册,获得登记号为 MH050404.1。
3 結果与讨论
本研究通过对火炬树枯枝病枝条进行病原菌的分离、纯化、接种及再分离,确定了致病菌株:根据分生孢子器的基本形态、分生孢子的大小和菌落生长速度、菌落形态、色素产生情况与相关资料[23-24]比对,证明本病原菌属于漆树拟茎点霉(Phomopsis rhois)。分子生物学鉴定该菌种序列与Phomopsis sp.相似度为99%,如图2所示。进一步证明支持了形态学的鉴定结果。据国外文献[22]报道其寄生于漆树科的Rhus toxicodendron、Rhus cotinus、Rhus typhina。据国内文献[23]报道其寄生于野漆树(Rhus succedanea L)的枝条上。根据资料[22] 记载其分生孢子梗为25μm×1μm,甲型分生孢子为10 μm×(2.0 ~ 2.5) μm,并未记录乙型分生孢子,与标本HJ-1稍有差异。根据资料[24]记载其分生孢子梗为(10.0 ~ 20.1)μm×(1.8 ~ 2.4) μm,甲型分生孢子为(6.0~9.9)μm×(1.8 ~ 2.0) μm,同时,马莉(2004)在野漆(Rhus spp .)上记载的漆树拟茎点霉(P. rhois)在标本上未观察到乙型分生孢子[23],仅在苜蓿煎汁+ Czapek培养基(25 ℃)上发现了乙型分生孢子[24],大小为(13 ~ 20)μm×(0.9 ~ 1.2 )μm,与标本HJ-1几近一致。本病原菌不仅在自然发病枝条上,而且在人工接种的发病枝条上以及人工培养基上均发现了这两种分生孢子的存在。推测这些差异与其分布地区及培养条件相关,根据其主要形态特征及分子生物学鉴定为漆树拟茎点霉(Phomopsis rhois),在我国未见火炬树Rhus typhina的本种病原菌相关报道,而火炬树为P. rhois国内新寄主。虽然火炬树用途广泛但是由于其繁殖较快,根系坚定可以穿透水泥,易对市区内地下管网及建筑产生危害,亦属于外来物种,因此一般栽种于荒山等地,并不适宜市区内的绿化,而本病原菌作为火炬树的主要病害之一,可以有效控制火炬树在市区内大规模的繁殖和生长。另外关于该病原菌的流行规律需要深入调查,对防治该病原菌的药剂仍需要进一步研究。
【参 考 文 献】
[1]张川红,郑勇奇,李继磊,等.北京地区火炬树的萌蘖繁殖扩散[J].生态学报,2005,25(5):978-985.
ZHANG C H,ZHENG Y Q, Li J L, et al. Dispersal of staghorn sumac in Beijing areas[J]. Acta Ecologica Sinice, 2005, 25(5): 978-985.
[2]胡耀升,刘艳红.北京引进树种火炬树和水曲柳的光合特征[J]生态科学,2012,31(4):377-383.
HU Y S, LIU Y H. Study on eco-physiological characteristics of Rhus typhina and Fraxinus mandshurica in Beijing[J]. Ecological Science, 2012, 31(4): 377-383.
[3]黄乔乔,许慧,范志伟,等.火炬树入侵黑松幼林过程中对土壤化学性质的影响[J].生态环境学报,2013,22(7):1119-1123.
HUANG Q Q, XU H, FAN Z W, et al. Effects of Rhus typhina invasion into young Pinus thunbergii forests on soil chemical properties[J]. Ecology and Environmental Sciences, 2013, 22(7): 1119-1123.
[4]LUKEN J O. Gradual and episodic changes in the structure of Rhus typhina clones[J]. Bulletin of the Torrey Botanical Club, 1990, 117(3): 221-225.
[5] DOUST J L, DOUST L L. Modules of production and reproduction in a dioecious clonal shrub, Rhus typhina[J]. Ecology, 1988, 69(3): 741-750.
[6]UKEN J O. Interaction between seed production and vegetative growth in staghorn sumac Rhus typhina L[J]. Bulletin of the Torrey Botanical Club, 1987, 114(3): 247-251.
[7]张明如,翟明普,王学勇,等.火炬树克隆植株生长和生物量特征的研究[J].林业科学,2004,40(3):39-45.
ZHANG M R, ZHAI M P, WANG X Y, et al. A study on the characteristics of the growth and the biomass of clonal ramets in Rhus typhina[J]. Scientia Silvae Sinicae, 2004, 40(3):39-45.
[8]袁召良.火炬树护坡[J].公路,1997(12):47-48.
YUAN Z L. Rhustyphina slope protection[J]. High Way, 1997(12):47-48.
[9]戴俊荣.护坡固沙造林的好树种——火炬树[J].园林科技信息, 2003(2):9.
DAI J R. A good tree species for slope protection and sandification afforestation - Rhus typhina[J]. Science & Technology of Landscape Architecture, 2003(2): 9.
[10]吴轶杰, 李如鸿.一种值得推广的防火树种——火炬树[J].森林防火,1997(3):30.
WU Y J, LI R H. A fire tree species worth promoting - Rhus typhina[J]. Forest Fire Prevention, 1997(3): 30.
[11]孙天旭,张川红,王虎,等.火炬树在鲁中南山区防火林带营造中的应用[J].防护林科技,2014(11):40-41. SUN T X, ZHANG C H, WANG H, et al. Application of torch tree in the construction of fire prevention forest belt in the middle mountain area of Luzhong[J]. Protection Forest Science and Technology, 2014(11): 40-41.
[12]于晓光,张德君,滕玉辉,等.火炬树单宁含量研究[J].吉林林学院学报,1994,10(3):180-183.
YU X G, ZHANG D J, TENG Y H, et al. Study on tannin content of Rhus typhina[J]. Journal of Jilin Forestry University, 1994, 10(3):180-183.
[13]王跃邦,杨树生,孙传生,等.火炬树提取栲胶研究[J].中国水土保持,1995(8):8-10.
WANG Y B, YANG S S, SUN C S, et al. Rhus typhina extraction of tannin extract[J]. Soil and Water Conservation in China, 1995(8): 8-10.
[14]马松涛. 中国火炬树研究现状及发展趋势[D].杨凌:西北农林科技大学,2005.
MA S T. Topic of the dissertation: a review of Rhus typhina,s current research situation and it,s trend in China[D]. Yangling: Northwest A & F University, 2005.
[15]韩冰一. 沈阳市棋盘山景区森林病害区系调查研究[D].沈阳:沈阳农业大学,2016.
HAN B Y. Investigation on forest diseases flora in Shenyang Qipanshan scenic spot[D]. Shenyang: Shenyang Agricultural University, 2016.
[16]张华,丛燕,刘奇.大興安岭被松栎柱锈菌侵染的蒙古栎叶上真菌种群的分布与多样性[J].林业科技,2017,42(6):25-26.
ZHANG H, CONG Y, LIU Q. Distribution and diversity of fungal populations on the leaves of Quercus mongolica infected by Pinus sylvestris var[J]. Forestry Science & Technology,2017,42(6):25-26.
[17]劉树蓬.内生真菌多样性及其活性物质研究[D].杭州:浙江大学, 2006.
LIU S P. Study on diversity and bioactive products of endophytic fungi[D]. Hangzhou: Zhejiang University, 2006.
[18]陆家云.植物病原真菌学[M].北京:中国农业出版社.2001.
LU J Y. Plant pathogenic mycology[M]. Beijing: China Agriculture Press, 2001.
[19]劳佳萍.植物内生真菌拟茎点霉生物多样性研究[D].杭州:浙江大学, 2007.
LAO J P. Study on the diversity of endophytic Phomopsis species[D]. Hangzhou: Zhejiang University, 2007.
[20]庞丽杰,范晓旭.樟子松凋落物中可培养真菌多样性的研究[J].林业科技, 2016,41(2):48-50.
PANG L J, FAN X X. Study on diversity of cultured fungi in Pinus sylvestris var. mongolica Litter[J]. Forestry Science & Technology, 2016,41(2):48-50.
[21]李雪光,潘凤娟,宋洁,等.拟茎点霉属及其病害研究进展[J].大豆科技,2012(6):32-37.
LI X G, PAN F J, SONG J, et al. Advance in Phomopsis spp. and Phomopsis diseases[J]. Soybean Technology, 2012(6): 32-37.
[22]薛煜,刘雪峰,项存悌.林病研究方法[M].哈尔滨:东北林业大学出版社,2014:72-77.
XUE Y, LIU X F, XIANG C T. Forest pathology research methods[M]. Harbin: Northeast Forestry University Press, 2014: 72-77.
[23] UECKER F A. Mycol memoir: a world list of Phomopsis names with notes on nomenclature, morphology and biology[M]. Berlin Stuttgart: The New York Botanical Garden, 1988:1-231.
[24] MA L, XIANG M M, QI P K, et al. New species and new records of Phomopsis from Kunming, China[J]. Journal of South China Agricultural University, 2004,25(4):71-73.
