一株山羊源杀鲑气单胞菌的分离、鉴定及药物敏感性检测
2018-05-14闫展燕孔令聪贾博岩刘树明马红霞
王 博,闫展燕,孔令聪,贾博岩,魏 星,刘树明,马红霞,2*
(1.吉林农业大学动物科技学院,长春 130118; 2.吉林农业大学动物生产及产品质量安全教育部重点实验室,长春130118)
杀鲑气单胞菌(A.salmonida)是气单胞菌科气单胞菌属的一员,呈全球性分布,广泛存在于淡水、污水和土壤中,宿主范围较广。该菌属条件性致病菌,可经皮肤、鳃、口及血液等途径传染,多引起水生动物包括鲑鳟鱼类和非鲑科鱼类发病[1-4],给水产养殖业带来了严重的经济损失。1984 年Emmerich和Weibel首次从患病溪鳟中分离到该病原菌[5],近年来相关研究显示,其宿主范围正逐步扩大,除导致水生生物发生疖疮病或溃疡病等[6],还可引起人畜食物中毒,同时,随着临床抗生素不合理使用导致细菌产生耐药性及耐药菌株在不同种群间的传播,给人畜健康和食品安全问题造成巨大威胁[6-8]。2016年夏季吉林省某羊场饲养的山羊陆续产生体温升高,呼吸困难等症状,最终相继死亡。本研究对其送检的病羊肺脏组织进行病原微生物的分离培养,结合分子生物学鉴定方法确定分离菌株为多重耐药的杀鲑气单胞菌,并通过致病性实验和药物敏感性检测确定其致病性及耐药性,以期为临床疾病的防制提供科学的参考依据。
1 材料与方法
1.1 病料来源 采自吉林省某羊场患有呼吸系统疾病病羊的肺脏组织。
1.2 试剂与培养基 Taq DNA聚合酶、10×Buffer、dNTPs、DL2000 DNA Marker、pMD18-T载体均购自Takara公司;DNA抽提试剂盒、胶回收试剂盒、LB培养基均购自生工生物工程(上海)股份有限公司;BHI平板(脑心浸出液琼脂)和脑心浸出液肉汤购自赛奥克生物公司;多黏菌素B、强力霉素、链霉素、环丙沙星、氟苯尼考、头孢噻肟等药品购自中国兽医药品监察所和索莱宝生物科技有限公司。
1.3 实验动物 20 ~ 25 g Balb/c小鼠90只,雌雄各半,购自吉林大学实验动物中心。
1.4 山羊肺脏的病理组织学检查 对采集到的病羊肺脏组织进行初步的病理学变化观察,并取病变严重部位用10%的甲醛溶液固定,然后将固定好的组织修整为大小1 cm2的正方体块,经过对组织洗涤、脱水、透明、浸蜡、包埋、切片、H.E染色和封片等一系列处理,在显微镜下进行病理组织学观察。染色过程参考Fischer等[9]的方法。
1.5 细菌的分离培养 无菌操作下,取患病山羊肺脏组织划线接种于BHI平板上,37 ℃恒温培养24 h。挑取形态大小不同的单一菌落反复划线纯化培养,观察记录菌落的形态、颜色、大小等特征。纯化后的菌液于4 ℃保存待用。
1.6 小鼠致病性试验 菌液制备:将上述纯化后分离菌分别接种于BHI固体培养基,37 ℃恒温培养24 h,挑取单个菌落接种于5 mL LB液体培养基,置于恒温摇床中37 ℃,150 r/min培养至菌液浓度为0.5麦氏比浊度。动物试验:Balb/c小鼠,随机分组,每组10只,实验组小鼠腹腔注射上述培养菌液0.02 mL/g,对照组腹腔注射相同剂量的LB液体培养基,隔离饲养,随时观察小鼠的精神状态并记录。本实验经吉林农业大学伦理委员会批准。
1.7 小鼠肺脏的病理组织学观察 无菌采取试验组死亡小鼠和对照组小鼠的肺脏组织进行H.E染色切片制备及病理组织学检查。
1.8 分离菌株16SrDNA特异性核酸片段的扩增 使用生工生物工程有限公司的细菌基因组DNA快速抽提试剂盒提取分离致病菌基因组,以提取的基因组作为模板,采用16SrDNA通用引物(上游引物:5′-AGAGTTTGATCCTGGCTCAG- 3′;下游引物:5′-AAGGAGGTGATCCAGCCGCA-3′)对分离菌株进行16SrDNA特异性核酸片段的PCR扩增。引物由上海生工生物工程技术服务有限公司合成。
PCR反应体系25 μL:DNA模板4 μL,dNTP 2 μL,10×Buffer 2.5 μL,Ex Taq DNA聚含酶0.3 μL,上下游引物各0.5 μL,dd H2O补至25 μL。PCR扩增条件:95 ℃-5 min;95 ℃-45 s,50 ℃-45 s,72 ℃-1 min 45 s,32个循环;72 ℃延伸10 min。
PCR产物经1%琼脂糖凝胶电泳检测,对目的条带进行回收纯化,纯化产物与pMD18-T克隆载体连接,克隆至大肠杆菌 DH5α感受态细胞中,提取质粒进行 PCR 鉴定。阳性克隆质粒送至生工生物工程(上海)股份有限公司进行基因序列测定。
1.9 系统进化分析 将分离致病菌16SrDNA基因序列与GenBank数据库中的相关核酸序列进行Blast比对分析,并应用MEGA6.0软件构建系统进化树。
1.10 药物敏感性试验 选取庆大霉素、丁胺卡那霉素、氟苯尼考、头孢噻肟、环丙沙星、氧氟沙星等19种兽医临床常用的抗菌药物,采用平皿二倍稀释法测定分离致病菌株对临床常用药物的体外敏感性。药敏试验结果参照美国临床实验室国家标准化管理委员会(CLSI2015)标准判定敏感率、中介率、耐药率。
2 结果与分析
2.1 病羊肺脏组织的病理学检查 对患病山羊的肺脏组织进行病理学观察,可见病变肺脏肺泡轮廓界限不明显,肺间质增宽,细支气管壁脱落和肺水肿的变化(图1 A),并且伴有巨噬细胞和嗜中性粒细胞浸润的现象(图1 B),而健康羊肺组织无病变(图1 C)。
2.2 细菌的分离培养 在超净工作台中,取患病山羊肺脏组织样品划线接种于BHI平板上,37 ℃恒温培养后,可见圆形略微凸起、边缘整齐、光滑、半透明、较湿润的中等大小微白色菌落。
2.3 小鼠致病性试验结果 实验组小白鼠在接种菌液6 h后其中一组出现眼睑肿胀,眼分泌物增多并伴有轻微出血的现象,精神萎靡,表现为对外界刺激反应迟钝,不愿活动。12 h后4只小白鼠死亡,36 h后10只小白鼠全部死亡。而对照组小白鼠完全正常,无任何异状。剖检实验组死亡小白鼠可见明显的肺脏出血,且从病死小白鼠肺脏重新分离得到上述致病菌。对照组小白鼠继续饲养7 d后全部存活,剖检未见相关病变。
2.4 小鼠肺脏组织的病理学检查结果 对病死小白鼠肺脏进行病理组织学检查,结果显示实验组死亡小白鼠的肺脏组织出现了急性间质性肺炎(图2 A)和肺水肿,肺泡膈充满水肿液(图2 B),而对照组小白鼠的肺脏无病理学变化(图2 C)。可见,该分离菌引发小白鼠的病理变化与临床剖检患病羊的病理变化相同,均为急性间质性肺炎。
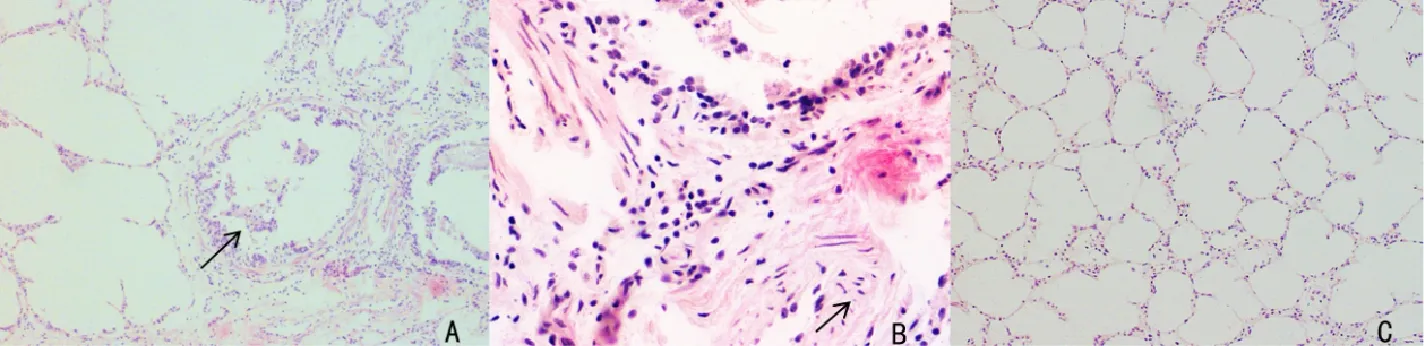
A:患病羊肺间质增宽;B:患病羊肺脏组织嗜中性粒细胞浸润;C:健康羊肺脏A: pulmonary mesenchyme are widened; B: neutrophil infiltration in lung tissue; C: healthy goat lungs
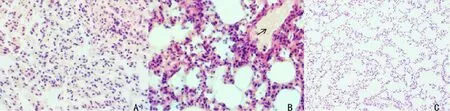
A:死亡小鼠出现急性间质性肺炎;B:死亡小鼠肺泡膈充满水肿液;C:健康小鼠肺脏A: acute interstitial pneumonia in dead mice; B: alveolar septa filled with edema fluid; C: healthy mice lungs
2.5 16SrDNA特异性核酸片段的扩增结果 以提取的分离菌基因组 DNA 为模板,进行16SrDNA特异性核酸片段的 PCR 扩增,其扩增产物进行1%琼脂糖凝胶电泳检测。结果显示,PCR反应成功扩增得到一条大小约为1500 bp 的条带(图3)。对目的片段进行序列测定,测定结果在 GenBank 数据库中经Blast对比分析,结果显示该分离菌16SrDNA序列与杀鲑气单胞菌16SrDNA序列一致性为98%,将其命名为A.sal-1。
2.6 系统进化分析 测序结果在GenBank数据库中进行Blast比对分析, 并应用MEGA7.0软件对分离菌株与气单胞菌属不同种代表菌株进行系统进化树构建,结果显示,分离菌A.sal-1与GeneBank中已登录的杀鲑气单胞菌处于不同分支(图4)。
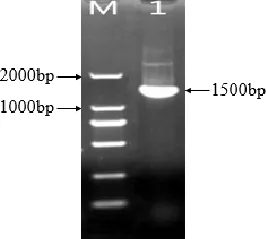
M : DL2000 DNA Marker ;1:A.sal-1 16S rDNA的PCR产物M:DL2000 DNA Marker ;1:PCR-amplified 16S rDNA gene of strain A.sal-1
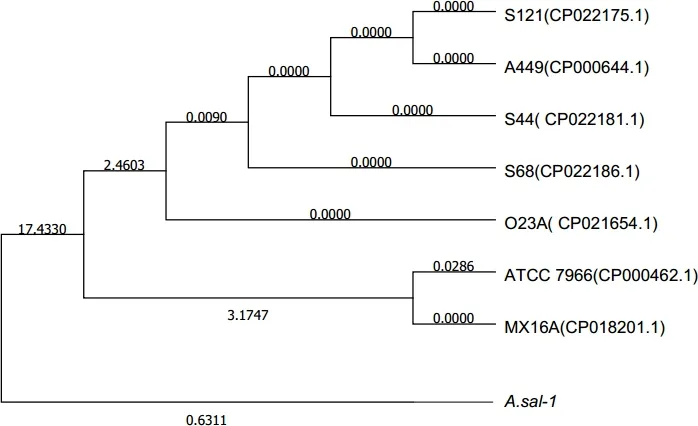
图4 A.sal-1与相关菌株的系统发育树Fig 6 Phylogenetic tree of A.sal-1 and other related strains based on 16S rDNA sequence
2.7 药敏试验结果 药敏试验结果显示(表1),分离菌株A.sal-1对头孢噻肟和强力霉素等药物相对敏感(MIC≤2 μg/mL),对庆大霉素、氟苯尼考、氧氟沙星等药物中度敏感(MIC≤8 μg/mL),对丁胺卡那霉素、链霉素、大观霉素等药物均有不同程度的耐药(MIC≥256 μg/mL)。
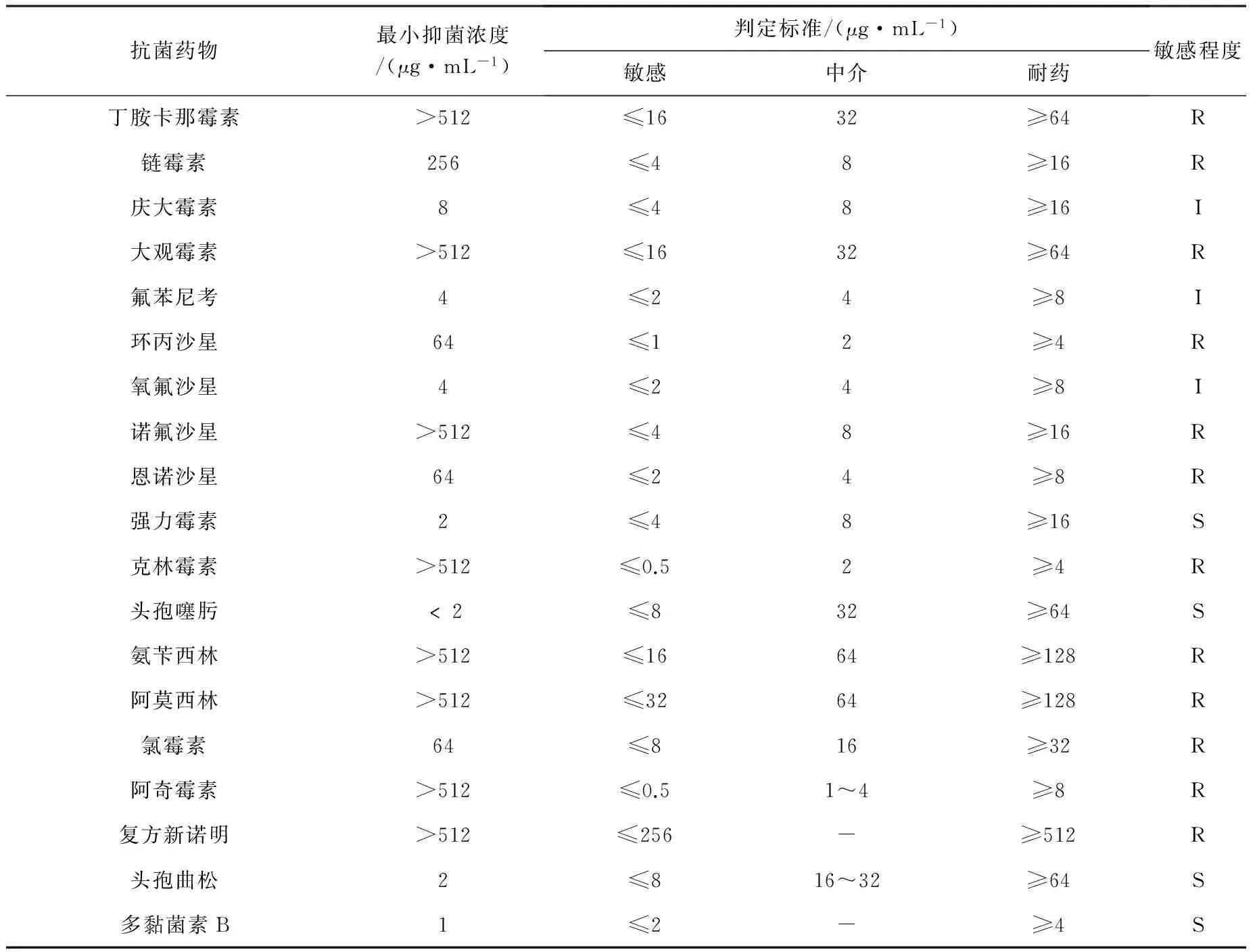
表1 分离菌株A.sal-1 对19种抗菌药物的敏感性试验Tab 1 Sensitivity of the isolated strain A.sal-1 to 19 kinds of antibioties
“S”表示高度敏感;“I”表示中度敏感;;“R”表示不敏感
Note:"S"-Sensitive;"I"-Intermediate;"R"-Resistant
3 讨论与小结
杀鲑气单胞菌宿主广泛,其不仅能引发鲑鳟鱼类的疖疮病,还可导致其他多种水生动物发病,Fernndez-lvarez C[10]等首次从患病鲈鱼体内分离到杀鲑气单胞菌,张晓君[11]等的人工感染试验显示该菌对牙鲆、鲤、鲫、泥鳅等都具有不同程度的致病作用。同时,该菌还可传播给人和动物,引起人畜发生败血症等疾病,国内外均有报道显示,从猪肉[12]、人体血液中[13]分离到了杀鲑气单胞菌。本研究从患有呼吸系统疾病的病羊肺脏组织中分离到1株病原菌,其对健康小鼠具有较强的致病性,且该分离菌引发小鼠的病理变化与临床剖检患病羊的病理变化相同,均为急性间质性肺炎。分子生物学鉴定结果显示该菌为杀鲑气单胞菌。
目前,我国对于感染杀鲑气单胞菌的防治仍以投放抗生素为主要手段,研究表明,在长期的药物压力下杀鲑气单胞菌已对常用药物产生了耐药性。王海娟[2]等2015年对鲤鱼杀鲑气单胞菌的耐药性分析结果显示,其所分离到的杀鲑气单胞菌对氨苄西林、氨苄西林/舒巴坦、甲氧卞胺嘧啶和磺胺异恶唑等抗生素产生了耐药性。本研究对分离菌A.sal-1进行的药物敏感性试验结果显示,该菌对头孢噻肟、强力霉素等药物相对敏感,与王海娟等[2]的研究结果一致;对庆大霉素、氟苯尼考、氧氟沙星等药物中度敏感;对环丙沙星、恩诺沙星、克林霉素等多种药物产生了不同程度的耐药性,该结果与李绍戊等[5]的研究结果相反。药物敏感性实验为山羊源杀鲑气单胞菌引发疾病的预防和治疗提供了理论依据。同时,也应积极进行杀鲑气单胞菌疫苗的研发工作,逐渐减少临床抗生素的使用。
随着杀鲑气单胞菌宿主范围的日益增加,不但对国内外水产养殖业造成了较严重经济损失,也对畜牧养殖业产生了一定的影响,病原菌通过水体、食品等传递给人类,对人类健康及食品安全也造成巨大威胁,尤其是耐药杀鲑气单胞菌的产生和流行,更为该菌引发疾病的治疗增添了困难[14]。为此,在兽医临床治疗过程中,应及时对该菌进行药物敏感性检测,筛选出敏感药物,以最大程度的减少因该菌耐药性产生而造成的抗感染失败。
参考文献:
[1] 曹成易,汪开毓, 王 玲,等. 大西洋鲑杀鲑气单胞菌的分离鉴定[J].淡水渔业,2009, 39(1):54-57.
Cao C Y, Wang K Y, Wang L,etal. Isolation and identification ofAeromonassalmonifrom Atlantic salmon[J]. Freshwater Fisheries, 2009, 39 (1): 54-57.
[2] 王海娟,王 利. 鲤鱼杀鲑气单胞菌的分离鉴定及耐药性分析[J].中国畜牧兽医,2015,42(1):192-196.
Wang H J, Wang L. Isolation, identification and drug resistance analysis ofAeromonassp. Aeruginosa [J]. Journal of Animal Science and Veterinary Medicine, 2015,42 (1): 192-196.
[3] 周冬仁,罗毅志,杭小英,等. 1株乌鳢源杀鲑气单胞菌杀鲑亚种的分离与鉴定[J]. 海洋湖沼通报, 2015,(3):64-70.
Zhou D R, Luo Y Z, Hang X Y,etal. Isolation and identification ofsalmonellasubspecies ofSalmonellaaeruginosafrom Snakehead [J]. Journal of Ocean and Lake Research, 2015,(3): 64-70.
[4] Garrity G M, Bell J A, Lilburn T G. Taxonomic Outline of the Prokaryotic Genera. Bergey's.
[5] 李绍戊, 王 荻, 连浩淼,等. 大西洋鲑杀鲑气单胞菌无色亚种的分离鉴定和致病性研究[J]. 水生生物学报, 2015, 39(1):234-240.
Li S W, Wang D, Lian H M,etal. Isolation, Identification and Pathogenicity of Colorless Subspecies ofAeromonassalmonicain Atlantic Salmon [J]. Journal of Hydrobiology, 2015, 39 (1): 234-240.
[6] Sechi L A, Deriu A, Falchi M P,etal. Distribution of virulence genes inAeromonasspp. isolated from Sardinian waters and from patients with diarrhoea.[J]. Journal of Applied Microbiology, 2002, 92(2):221-227.
[7] Joseph S W, Carnahan A M, Brayton P R,etal. Aeromonas jandaei andAeromonasveroniidual infection of a human wound following aquatic exposure.[J]. Journal of Clinical Microbiology, 1991, 29(3):565-569.
[8] 武 英,任书云. 肝炎后肝硬化合并杀鲑气单胞菌败血症一例[J]. 中华传染病杂志, 1996,(4):210-210.
Wu Y, Ren S Y. Hepatitis cirrhosis combined withsalmonellaaeruginosasepsis [J]. Chinese Journal of Infectious Diseases, 1996,(4): 210-210.
[9] Fischer A H, Jacobson K A, Rose J,etal. Hematoxylin and eosin staining of tissue and cell sections.[J]. Csh Protocols, 2008,(5):pdb.prot4986.
[11] 张晓君, 房 海, 陈翠珍,等. 杀鲑气单胞菌一新亚种的生物学特性及系统发育学分析[J].中国水产科学, 2006, 13(6):917-923.
Zhang X J, Fang H, Chen C Z,etal. Biological characteristics and phylogenetic analysis of a new subspecies ofAeromonassalmonicus[J]. Chinese Journal of Aquaculture, 2006, 13 (6): 917-923.
[12] Fontes M C, Saavedra M J, Monera A,etal. Phylogenetic identification ofAeromonassimiae, from a pig, first isolate since species description[J]. Veterinary Microbiology, 2010, 142(34):313-316.
[13] 王闻卿, 朱林英, 郝莉鹏,等. 气单胞菌研究概况[J]. 疾病监测, 2016, 31(7): 591-597.
Wang W Q, Zhu L Y, Hao L P,etal. Aeromonas research overview [J]. Disease Surveillance, 2016, 31 (7): 591-597.
[14] 王家祯, 耿昕颖, 董文龙,等. 3株杀鲑气单胞菌的分离鉴定及药敏试验[J].中国兽医杂志, 2017,(2):78-80.
Wang J Z, Geng X Y, Dong W L,etal. Isolation and identification and drug susceptibility test of three strains ofAeromonassalmonicus[J]. Chinese Journal of Veterinary Medicine, 2017,(2): 78-80.
