枇杷叶片发育基因EjGRF5与启动子克隆及其在不同倍性枇杷中的表达
2018-05-14刘超王玲利吴頔党江波尚维郭启高梁国鲁
刘超,王玲利,吴頔,党江波,尚维,郭启高,梁国鲁
枇杷叶片发育基因与启动子克隆及其在不同倍性枇杷中的表达
刘超1,王玲利2,吴頔1,党江波1,尚维1,郭启高1,梁国鲁1
(1西南大学园艺园林学院,重庆 400715;2重庆市渝北区农业委员会,重庆 401120)
【目的】克隆并解析枇杷((Thunb.) Lindl.)中参与调控叶片生长发育的及其启动子序列的结构特征,研究其在不同倍性枇杷中的表达特性,为进一步研究该基因调控不同倍性枇杷叶片生长势差异的机理奠定基础。【方法】从转录组测序数据中挖掘枇杷的参考序列,以此序列设计引物,并以‘龙泉1号’四倍体枇杷基因组DNA为模板扩增全长,参照参考序列获得其CDS序列。利用Bioedit7.2及SignalP4.1对的CDS序列及其蛋白的理化性质进行分析;采用Mega7.0软件构建EjGRF5和其他物种GRF5的系统进化树;采用LocTree3及SoftBerry ProtComp9.0在线软件对EjGRF5蛋白进行亚细胞定位预测;采用染色体步移的方法克隆的启动子序列,并利用PlantCARE在线软件对克隆得到的启动子序列进行生物信息学分析;采用RT-PCR技术对在三倍体枇杷及其亲本(4x、2x)中的表达差异进行初步分析。【结果】将测序结果与转录组测序的参考序列进行比对发现,全长为1 386 bp,含有3个外显子,2个内含子,内含子全长399 bp,CDS全长987 bp。进化树分析表明,枇杷与蔷薇科的其他植物高度同源,且与白梨的亲缘关系最近。亚细胞定位预测结果显示,枇杷EjGRF5蛋白定位于细胞核中。启动子分析显示,启动子区域含有多个顺势作用元件,包括脱落酸、乙烯、高温、厌氧诱导、赤霉素和光响应元件,并且光响应元件多达11个。qRT-PCR结果显示,除F1代A-6和B-3外,其余三倍体子代表达量相对于中间亲本值(MPV)都发生了不同程度的上调,其中A-3的表达量是其MPV的20倍,A-5表达量是其MPV的18倍左右。【结论】获得了与枇杷叶片生长发育相关的、CDS序列及其启动子序列,在三倍体枇杷叶片中的表达呈现出上调趋势。
枇杷;;基因克隆;启动子克隆;表达分析
0 引言
【研究意义】枇杷为蔷薇科(Rosaceae)枇杷属()植物,原产中国,别名卢橘。枇杷是亚热带地区的珍惜特产水果,其果实鲜美可口,柔软多汁,营养丰富,有润喉、止咳、健胃、清热等功能,被誉为保健水果,深受国内外消费者的喜爱[1]。三倍体枇杷细胞核内染色体组较二倍体增加一套,致使三倍体枇杷表现出许多二倍体枇杷所不具有的优良性状,如三倍体枇杷的叶片较二倍体变大,变厚,更加浓绿等[2]。而叶片是植物进行光合作用的重要器官,直接影响到糖分的积累,是植物形态建成的一个重要方面,在植物生长发育过程中起重要作用[3]。基因表达与调控是植物接受外界信号进行发育的关键环节,因此,分离调控枇杷叶片发育的相关基因,有助于了解三倍体枇杷旺盛生长势的分子机制,同时也为培育三倍体优质无核枇杷提供参考。【前人研究进展】植物叶片在发育过程中受多种基因调控,()是一类调控叶片发育的转录因子家族,研究人员在拟南芥中共鉴定出9个(—)家族成员[4]。对拟南芥以及水稻的研究发现,转录因子通过结合到DNA链上以抑制或激活目标基因的表达,不但在叶片的形成过程中起重要的调节作用,而且在植物的抗性、花器官发育等过程中也起到重要的调节作用[5]。然而遗传学分析表明,在9个转录因子家族成员中,()对叶片形态发育的调控作用较其他8个转录因子更强,研究的也更加充分[6]。研究发现,拟南芥突变体由于叶片细胞数目的变少而表现出叶片狭窄,而超表达则促进了细胞分裂,进而使得叶片变大[7]。Werner等[8]在对拟南芥细胞分裂素研究时发现,过表达的拟南芥植株随着细胞分裂素的加速降解而表现出叶片大小的回复突变,因此认为,在叶片的发育过程中,GRF5和细胞分裂素共同调控细胞的分裂进而影响叶片的大小。最近在对拟南芥的研究中还指出,过表达不仅可以促进细胞分裂,还可以加速叶绿体分裂,提高光合作用效率,延缓叶片衰老[9]。【本研究切入点】目前对研究主要集中在模式植物拟南芥上,而对木本植物转录因子的相关研究还鲜有报道。【拟解决的关键问题】本研究通过对枇杷转录因子基因及其启动子进行克隆并分析,采用qRT-PCR对在三倍体及其亲本中(4x、2x)的表达量进行分析,以明确及其启动子的序列特征和在不同倍性枇杷中的表达模式,为进一步研究该基因的功能奠定基础。
1 材料与方法
试验于2016年11月至2017年7月在西南大学重庆市果树学重点实验室进行,田间采样于2016年8月到2016年12月在重庆市北碚区歇马镇枇杷园进行。
1.1 材料
供试材料主要包括两个杂交组合所得到的三倍体植株及其相应亲本,杂交组合1:‘龙泉1号’四倍体(母本),‘贵州1号’(父本)以及杂交所获得的9株三倍体枇杷,编号为A-1、A-2.……A-9;杂交组合2:‘龙泉1号’四倍体(母本),‘贵州23号’(父本)以及杂交所获得的3株三倍体枇杷,编号为B-1、B-2、B-3。贵州1号及贵州23号均为二倍体野生枇杷,引自贵州,‘龙泉1号’四倍体为笔者实验室早年通过天然筛选得到的一株天然四倍体枇杷。取供试材料的幼嫩叶片放于液氮中,带回实验室置于-80℃超低温冰箱保存,用于后续克隆及定量分析。
工程菌DH5α及凝胶回收试剂盒购自北京天根公司,反转录试剂盒、克隆载体pMD19-T,Universal GenomeWalkerTM2.0试剂盒购自Takara公司,Taq Plus DNA Polymerase 高保真聚合酶购自南京诺唯赞生物有限公司,EASYspin Plus plant RNA kit购自北京艾德莱生物科技有限公司。
1.2 基因克隆
采用改良的CTAB法提取‘龙泉1号’四倍体枇杷基因组DNA[10]。以转录组测序拼接得到的序列作为参考序列设计一对特异性引物:-F:5′-ATGATGAATGGAAATCCAAGTAG-3′;-R:5′-TTAACCGTCATTAGGACCTCCAG-3′,PCR反应体系为25μL:2.5 μL 10×TaqPlus Buffer (Mg2+Plus),0.5 μL dNTPs, 1 μL DNA,上、下游引物(10 μmol·L-1)各1 μL,TaqPlus DNA聚合酶0.25 μL、用ddH2O补至终体积25 μL。PCR反应条件为:94℃预变性5 min;94℃ 30 s,55℃30 s,72℃ 60 s,35个循环;72℃延伸7 min。回收PCR产物并连接到PMD19-T载体上,构建重组质粒转化DH5α感受态细胞,筛选阳性克隆,送至成都擎科梓熙生物技术有限公司测序。测序结果在NCBI中进行Blast同源性比对,并结合转录组测序得到的参考序列进行分析,得到枇杷的CDS序列,命名为。
1.3 启动子克隆
以‘龙泉1号’四倍体基因组DNA为模板,依据Universal GenomeWalkerTM2.0启动子克隆试剂盒说明书,以1.2中克隆得到的序列及后续测序得到的部分启动子序列为依据,分批设计巢式引物,不断往上游扩增,直到扩增出约 2 000 bp的启动子序列。所用巢式引物如表1所示。
1.4 生物信息学分析
使用ORF finder 软件分析基因的开放阅读框(ORF)和编码氨基酸序列;采用BioEdit7.2对CDS序列及其编码的蛋白理化性质进行分析;采用SignalP 4.1预测EjGRF5蛋白的信号肽;Mega7.0 软件构建EjGRF5和其他物种GRF5的系统进化树;LocTree3(https://rostlab. org/services/loctree3/)和SoftBerry ProtComp9.0(http://linux1.softberry.com/berry. phtml)进行亚细胞定位预测[11-12];采用在线软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/ plantcare/html/)进行启动子序列分析。
1.5 枇杷EjGRF5的荧光定量表达分析
参照EASYspin Plus plant RNA kit试剂盒说明书提取枇杷总RNA,用反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser合成cDNA。采用(笔者实验室前期筛选获得)作为实时荧光定量PCR (qRT-PCR)的内参基因。内参基因的引物序列如表1所示。所用仪器为Stepone Real-Time PCR仪(ABI),所有qRT-PCR反应都设3次重复。PCR反应体系为10 μL:2×ChamQ SYBR qPCR Master Mix 5 μL,上、下游引物各0.2 μL,模板2 μL,50×ROX Refence Dye I0.2 μL,用RNAase Free H2O补至终体积10 μL。PCR反应程序为:95℃预变性10 s,95℃ 5 s,60℃10 s;溶解曲线反应程序:95℃15 s,60℃ 1 min,60—95℃(in 0.3 inc) 15 s。试验结果采用2-ΔΔCt法对数据进行分析。
2 结果
2.1 EjGRF5克隆及序列分析
从枇杷基因组DNA中扩增得到大小约1 500 bp的条带,对该条带回收、克隆、PCR鉴定和测序后,得到片段大小为1 386 bp,将测序得到的基因序列与转录组获得的参考序列比对后发现,枇杷含有3个外显子,2个内含子。内含子全长399 bp,外显子即CDS序列。全长987 bp,其所编码的氨基酸序列与和核苷酸序列相对应,如图1所示。序列及CDS序列已提交至NCBI注册,序列号分别为:MF772342、MF772341。CDS的A+T含量为53.29%,G+C含量为46.71%,编码328个氨基酸,蛋白相对分子质量为36.5 kD,等电点为8.91。其氨基酸残基中含有30个带负电的氨基酸残基,36个带正点的氨基酸残基,76个疏水氨基酸,128个极性氨基酸。通过SignalP 4.1在线软件进行信号肽预测发现,EjGRF5蛋白无信号肽序列,为一种非分泌蛋白。

表1 引物用途及序列

图1 EjGRF5核苷酸序列及其氨基酸序列
2.2 EjGRF5进化分析
利用Mega7.0上的邻接法(neighbour-joining,NJ)对枇杷EjGRF5蛋白、GenBank数据库中有记载的20个GRF5蛋白进行进化树构建(图2),结果表明,枇杷EjGRF5与蔷薇科中的一些植物,如白梨、苹果、甜樱桃、梅花、碧桃等的亲缘关系较近,其中与白梨的亲缘关系最近,由此明确EjGRF5为蔷薇科家族成员。

图2 EjGRF5与其他植物GRF5蛋白的系统进化树分析(邻接法)
2.3 EjGRF5亚细胞定位预测
通过在线预测软件SoftBerry ProtComp9.0对EjGRF5蛋白进行亚细胞定位预测,结果显示,EjGRF5蛋白定位在细胞核的相应预测数值最高,为9.04。采用在线预测软件LocTree3对EjGRF5蛋白亚细胞定位进行进一步预测,结果显示,EjGRF5蛋白同样定位于细胞核。由此判断,EjGRF5蛋白可能为一核蛋白。
2.4 EjGRF5启动子克隆与分析
根据序列设计巢式引物,依据Universal GenomeWalkerTM2.0试剂盒说明书进行巢式PCR扩增,经过5轮巢式PCR、测序以及拼接后得到了一条大小约2 200 bp的序列。采用PlantCARE在线软件对其序列(1 500 bp)进行分析后发现,启动子序列含有3个植物激素相应元件(ABRE、CE3、GARE-motif)、11个光响应元件(AE-box、ATCT-motif、Box4、BoxI、CAG-motif、G-Box、G-box、GA-motif、GT1-motif、MNF1、Sp1)、1个乙烯相应元件(ERE)、1个高温相应元件(HSE)等(表2),说明的转录表达可能受到这些因子的调控,并且对光照的变化十分敏感。
2.5 EjGRF5在亲本(2x,4x)及其三倍体子代中的表达模式
利用qRT-PCR技术,对在亲本(4x、2x)及其三倍体中的表达进行分析。中间亲本值(Middle- Parent-Value,MPV)是衡量杂种优势的一个重要指标,根据亲本基因组在三倍体子代中的贡献率,计算出中间亲本值(MPV),即:MPV=2/3ב龙泉1号’(4x)+1/3ב贵州1号’(2x)(‘贵州23号’(2x))。在分析三倍体表达量变化时,采用MPV值作为对照,将子代及其亲本的表达量与MPV进行比较,计算出2-△△Ct。分析结果显示,‘贵州1号’(2x)和‘贵州23号’2x的表达量要显著低于‘龙泉1号’(4x),如图3中箭头所示。在两个杂交组合中,仅有三倍体A-6和B-3表达相对于MPV发生了下调,其他三倍体的表达量都较MPV发生了不同程度的上调,其中A-3的表达量是MPV的20倍,A-5表达量是MPV的18倍左右,中亲优势明显。且A-2、A-3及A-5的表达量还明显高于‘龙泉1号’(4x),超亲优势明显,如图3所示。这说明在三倍体枇杷叶片中的上调表达可能是导致三倍体枇杷叶片变大的一个重要因素。

表2 EjGRF5基因上游启动子顺式调控元件预测
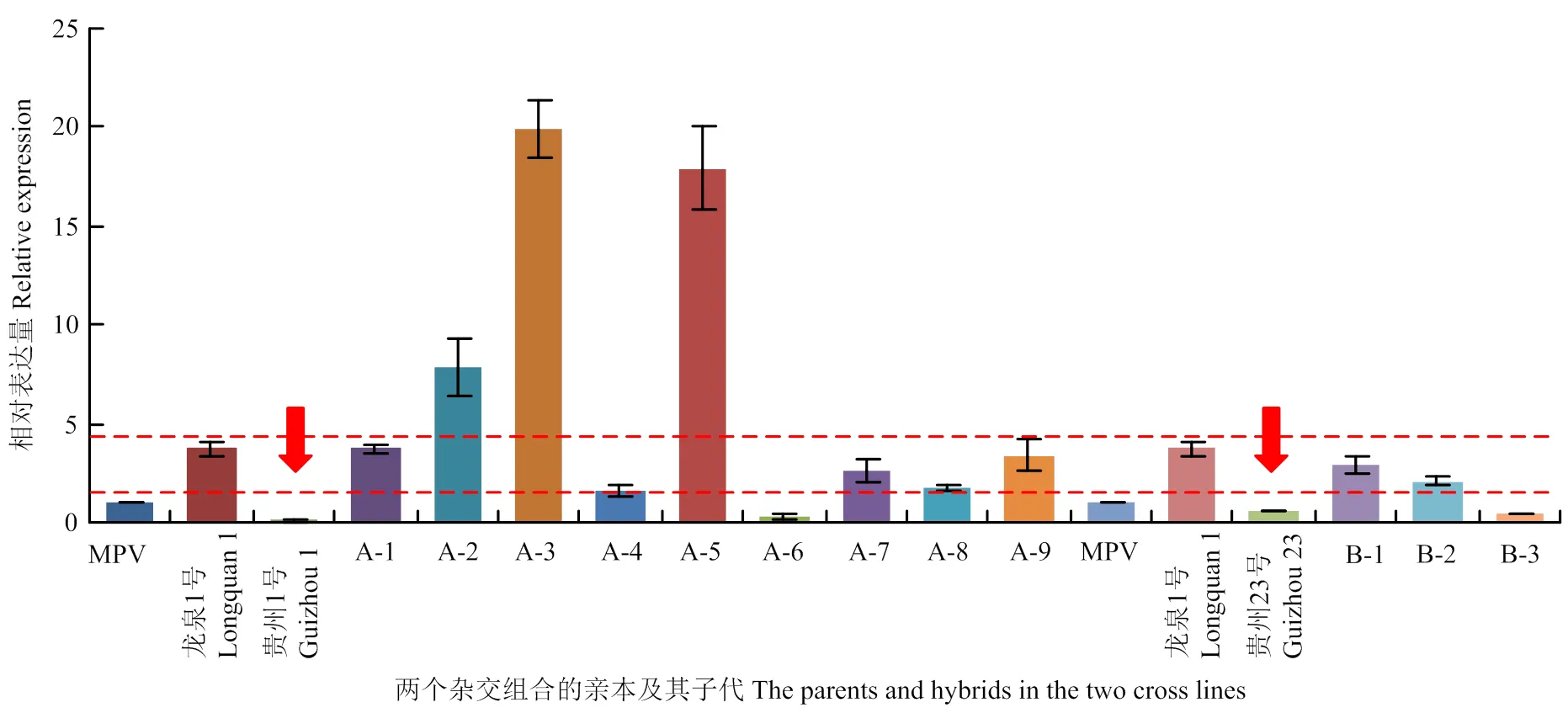
图3 EjGRF5在三倍体子代及其亲本(4x, 2x)中的实时荧光定量表达分析
3 讨论
近年报道的GRFs转录因子家族共有9个成员,其在叶片的生长发育过程中具有重要的调节作用,GRF5转录因子是GRFs转录因子家族中研究的较多且较充分的一个转录因子。研究指出,转录因子参与了叶片各个组织从叶原基分化后直至完全成熟这个阶段的发育调控[13-14]。遗传学分析表明,转录因子需与转录共激活子()相互作用,通过聚集SWI/SNF染色质重塑复合物来调节叶片的大小及性状[15-17]。在拟南芥中,研究人员发现,转录因子在调节叶片生长时,还能够与另外8个GRFs转录因子家族成员中的一个或多个共同调节叶片的生长[18-19]。为此,通过克隆枇杷叶片为进一步探究三倍体枇杷叶片生长发育特点提供理论依据。本研究克隆得到枇杷,同源比对发现其EjGRF5蛋白与蔷薇科中已报道的GRF5序列有较高的同源性,说明他们在进化上是高度保守的。
启动子在调控基因表达中起重要的作用[20],本研究采用染色体步移的方法成功克隆到枇杷起始密码子上游2 200 bp的启动子片段。通过对启动子序列的生物信息学分析发现,其含有3个植物激素相应原件,1个高温相应元件,1个乙烯相应元件,然而,与光响应的元件达到11个,暗示光照对的表达可能具有重要的诱导作用[21-22]。这也为进一步研究在三倍体枇杷中的表达机理奠定了基础。
笔者课题组早期观察发现,三倍体枇杷的叶片较其亲本(4x,2x)表现出不同程度的变大、变厚、变绿[2,23],因此推测,三倍体枇杷的表达发生了上调。利用qRT-PCR对在亲本(2x,4x)及其三倍体中进行表达分析,结果显示,在两个杂交组合中,仅有子代A-6和B-3相对于中间亲本值(MPV)的表达发生了下调,其他三倍体的表达量都较MPV发生了不同程度的上调。然而,在所研究的三倍体中,仅有A-2、A-3及A-5的表达量明显高于‘龙泉1号’(4x),表现出明显的超亲优势,而除B-3外,几乎所有的三倍体表达量都高于二倍体父本。而前人的研究表明,基因的剂量效应可能对基因的表达量产生影响[24-25]。因此,不同倍性枇杷表达量的差异是否受到了基因剂量的影响还有待进一步的研究。除此之外,基因表达还受其他多种因素的调控,如SiRNA[26-29]、DNA甲基化[30-31]等。然而,关于在三倍体及其亲本中的表达差异机理目前还知之甚少,有待进一步研究。
4 结论
本研究分离了控制枇杷叶片生长发育的相关基因全长及其CDS序列,发现EjGRF5蛋白与蔷薇科植物中的GRF5蛋白高度同源。对的启动子区域分析发现,其启动子序列含有多个受光诱导的顺势调控元件。QRT-PCR发现,除A-6和B-3外,在三倍体枇杷中的表达量都较MPV值有不同程度的上调,研究结果为进一步探索三倍体枇杷叶片生长旺盛的相关机理奠定了基础。
[1] 刘小洪, 孙海艳, 陈薇薇, 郭启高, 李晓林, 梁国鲁. 枇杷果实类胡萝卜素研究进展. 果树学报, 2016, 33(7): 874-881.Liu X H, Sun H Y, Chen W W, Guo Q G, Li X L, Liang G L. Advances in studies on carotenoids in loquat fruit., 2016, 33(7): 874-881. (in Chinese)
[2] 汪卫星, 李晔, 李晓林, 向素琼, 郭启高, 何桥, 梁国鲁. 天然三倍体枇杷与其二倍体植株的形态学比较. 果树学报, 2011, 28(6): 1090-1092. WANG W X, LI Y, LI X L, XIANG S Q, GUO Q G, HE Q, LIANG G L. Morphological comparison between natural triploids and diploids in loquat.2011, 28(6): 1090-1092. (in Chinese)
[3] 严松, 严长杰, 顾铭洪. 植物叶发育的分子机理. 遗传, 2008, 30(9): 1127-1135. YAN S, YAN C J, GU M H. Molecular mechanism of leaf development., 2008, 30(9): 1127-1135. (in Chinese)
[4] KIM J H, CHOI D S, KENDE H. Thefamily ofputative transcription factors is involved in leaf andcotyledon growth in., 2003, 36: 94-104.
[5] Kuijt S J, Greco R, Agalou A, Shao J, t Hoen C C, Overnas E, Osnato M, Curiale S, Meynard D, van Gulik R, de Faria Maraschin S, Atallah M, de Kam R J, Lamers G E, Guiderdoni E, Rossini L, Meijer A H, Ouwerkerk P B. Interaction between theandfamilies of transcription factors., 2014, 164: 1952-1966.
[6] HORIGUCHI G, KIM G T, TSUKAYA H. The transcription factorand the transcription coactivatorregulate cell proliferation in leaf primordial of., 2005, 43: 68-78.
[7] MIZUKAMI Y, FISCHER R L. Plant organ size control: AINTEGUMENTA regulates growth and cell numbers during organogenesis.2000,97: 942-947.
[8] WERNER T, MOTYKA V, LAUCOU V, SMETS R, VAN ONCKELEN H, SCHMULLING T. Cytokinin-deficient transgenicplants show multiple developmental alterations indicating opposite functions of cytokinins in the regulation of shoot and root meristem activity., 2003, 15: 2532-2550.
[9] VERCRUYSSEN L, TOGNETTI V B, GONZALEZ N, VAN DINGENEN J, DE MILDE L, BIELACH A, DE RYCKE R, VAN BREUSEGEM F, INZE D.Stimulateschloroplast division, photosynthesis, and leaf longevity., 2015, 174: pp.114.256180.
[10] 梁景霞, 祁建民, 吴为人, 周东新, 陈顺辉, 王涛, 陶爱芬. 烟草DNA的提取与SRAP 反应体系的建立. 中国烟草学报, 2005, 11(4): 33-38. LIANG J X, QI J M, WU W R, ZHOU D X, CHEN S H, WANG T, TAO A F. DNA extraction and the establishment of SRAP reaction system in tobacco.2005, 11(4): 33-38. (in Chinese)
[11] PAENICOVÁ L, DE-FOLTER S, KIEFFER M, HORNER D S, FAVALLI C, BUSSCHER J, COOK H E, INGRAM R M,KATER M M, DAVIES B, ANGENENT G C, COLOMBO L. Molecular and phylogenetic analyses of the complete MADS-box transcription factor family in: New openings to the MADS world., 2003, 15(7): 1538-1551.
[12] ARORA R, AGARWAL P, RAY S, SINGH A K, SINGH V P, TYAGI A K, KAPOOR S. MADS-box gene family in rice: Genome-wide identification, organization and expression profiling during reproductive development and stress., 2007, 8(1): 242.
[13] 赵爽爽. 水稻相关基因的克隆与功能分析[D]. 北京: 中国农业大学, 2016. ZHAO S S. Identification and Characterization ofgene affecting leaf and flower development in rice (L.). Beijing: China Agricultural University, 2016. (in Chinese)
[14] DKHAR J, PAREEK A. What determines a leaf's shape?, 2014, 5: 47.
[15] KIM J H, KENDE H. A transcriptional coactivator,, is involved in regulating leaf growth and morphology in., 2004, 101: 13374-13379.
[16] NARITA NN, MOORE S, HORIGUCHI G, KUBO M, DEMURA T, FUKUDA H, GOODRICH J, TSUKAYA H. Overexpression of a novel small peptide ROTUNDIFOLIA4 decreases cell proliferation and alters leaf shape in., 2004, 38: 699-713.
[17] VERCRUYSSEN L, VERKEST A, GONZALEZ N, HEYNDRICKX K S, EECKHOUT D, HAN S K, JEGUT, ARCHACKI R, VAN LEENE J, ANDRIANKAJA M, DE BODT S, ABEEL T, COPPENS F, DHONDT S, DE MILDE L, VERMEERSCH M, MALEUX K, GEVAERT K, JERZMANOWSKI A, BENHAMED M, WAGNER D, VANDEPOELE K, DE JAEGER G, INZE D.binds to SWI/SNF chromatin remodeling complexes to regulate transcription duringleaf development., 2014, 26: 210-229.
[18] DEBERNARDI J M, MECCHIA M A, VERCRUYSSEN L V, SMACZNIAK C, KAUFMANN K, INZE D, RODRIGUEZ R E, PALATNIK J F. Post-transcriptional control oftranscription factors by microRNA miR396 and GIF co-activator affects leaf size and longevity., 2014, 79: 413-426.
[19] KIM J H, LEE B H.ofis required for development of leaves, cotyledons, and shoot apical meristem., 2006, 49: 463-468.
[20] GARÍ E, PIEDRAFITA L, ALDEA M, HERRERO E. A set of vectors with a tetracycline-regulatable promoter system for modulated gene expression in., 1997, 13(9): 837-848.
[21] PARK S C, KWON H B, SHIH M C.-Acting elements essential for light regulation of the nuclear gene encoding the A subunit of chloroplast glyceraldehyde 3-phosphate dehydrogenase in., 1996, 112: 1563-1571.
[22] 李汉生, 徐永. 光照对叶绿素合成的影响. 现代农业科技, 2014, 21: 161-164.
LI H S, XU Y. Effect of Light on Synthesis of Chlorophylls.2014, 21: 161-164. (in Chinese)
[23] 汪卫星. 天然与人工合成三倍体枇杷基因组变异及其DNA甲基化分析[D]. 重庆: 西南大学, 2008. WANG W X. Genome variation and DNA methylation analysis of natural and artificial triploid loquats [D]. Chongqing: Southwest University, 2008. (in Chinese)
[24] MILLER M, ZHANG C, CHEN Z J. Ploidy and hybridity effects on growth vigor and gene expression inhybrids and their parents.:,,, 2012, 2(4): 505-513.
[25] HARVEY A C, FJELLDAL P G, SOLBERG M F, HANSEN T, GLOVER K A. Ploidy elicits a whole-genome dosage effect: growth of triploid Atlantic salmon is linked to the genetic origin of the second maternal chromosome set., 2017, 18: 34.
[26] SERGEI A, FILICHKIN S P, DIFAZIO A M, BRUNNER J M, DAVIS Z K, YANG U C, KALLURI R S, ARIAS E E, GERALD A T, STEVEN H S. Efficiency of gene silencing in: direct inverted repeats vs. transitive RNAi vectors., 2007, 5: 615-626.
[27] LIU D, YU S, CHEN Z, YU D. Ectopic expression of miR396 suppressestarget gene expression and alters leaf growth in., 2009, 136: 223-236.
[28] ADAMS K L, WENDEL J F. Novel patterns of gene expression in polyploid plants., 2005, 21: 539-543.
[29] RAPP R A, WENDEL J F. Epigenetics and plant evolution., 2005, 168: 81-91.
[30] 史玉杰, 李庆贺, 刘晓辉. DNA甲基化与基因表达调控研究进展. 中国生物工程杂志, 2013, 33(7): 90-96. SHI Y J, LI W H, LIU X H. Progress in studies of DNA methylation and gene expression regulation., 2013, 33(7): 90-96. (in Chinese)
[31] TURCO G M, KAJALA K, KUNDE-RAMAMOORTHY G, NGAN G, OLSON A, DESHPHANDE S, TOLKUNOV D, WARING B, STELPFLUG S, KLEIN P, SCHMUTZ J, KAEPPLER S, WARE D, WEI C L, ETCHELLS J P, BRADY S M. DNA methylation and gene expression regulation associated with vascularization in., 2017, 214: 1213-1229.
Molecular Cloning of Leaf Developmental Gene, Its Promoter and Expression Analysis in Different Ploidy Loquat ((Thunb.) Lindl.)
LIU Chao1, WANG Lingli2, WU Di1, DANG Jiangbo1, SHANG Wei1, GUO Qigao1, LIANG Guolu1
(1College of Horticulture and Landscape Architecture, southwest university, Chongqing 400715;2Technical Advice Station of Economic Crop, Chongqing 401120)
【Objective】 In order to provide more details for further studying the mechanisms ofgene in regulating the growth vigor of different ploidy loquat leaf, the aims of this study are to isolate the code region ofgene which is involved in the regulation of leaf development and its promoter sequence, and illustrate the expression pattern of the【Method】 The primers were designed by using thereference s equence obtained from the RNA-Seq, and the full length ofwas cloned by using the genome DNA of Longquan-1 tetraploid, and then the full length and reference sequences were compared to obtain the targeted sequence. The Bioedit7.2 and SignalP4.1 were used to analyze the structure of theCDS and the physical and chemical properties of EjGRF5; Mega7.0 was used to construct the EjGRF5 phylogenetic tree. The online software of LocTree3 and SoftBerry ProtComp9.0 was adopted to predict the subcellular location of EjGRF5. The genome walking technique was employed to amplify the promoter sequence, and the online software PlantCARE was adopted to analyze the structure of the promoter. The expression patterns of【Result】 When Comparing the sequenced data with the reference sequence of, the results showed that the full length ofis 1368 bp and it contains three extron and two intron sequences. The CDS length ofis 987 bp. The results of phylogenetic analysis revealed that the EjGRF5 protein is highly homologous with some other species in Rosaceae and is closest to. The result of subcellular localization prediction showed that EjGRF5 protein is located in the nucleus. The promoter analysis indicated that there were multiple putative-acting elements involved in the responsive elements, including abscisic acid (ABA), ethylene, heat, anaerobic inductive, gibberellin (GA) and light. Moreover, the number of light responsiveness element has reached 11. QRT-PCR result showed that the expression level ofexhibit varying degrees of up-regulation in almost all of the triploids except the hybrids A-6 and B-3 compared with the middle-parent value (MPV). Among the hybrids, the expression of A-3 was 20 times higher than that of MPV and A-5 was about 18 times higher than that of MPV. 【Conclusion】 The coding region and CDS sequence ofgene which is related to the development of loquat leaves were isolated, and the qRT-PCR results indicated that the expression ofion.
loquat;; gene cloning; promoter cloning; expression analysis
(责任编辑 赵伶俐)
10.3864/j.issn.0578-1752.2018.08.017
2017-09-01;
2018-01-10
‘十二五’国家科技支撑计划(2013BAD02B02-1)、国家星火计划(2015GA811003)、国家林业局项目(渝林科推2016-03)、重庆市林业局项目(渝林科研2016-10)、国家青年科学基金(31701876)、重庆市科委基础科学与前沿技术研究项目(cstc2017jcyjA1154)
刘超,E-mail:liuchao8807@126.com。
郭启高,E-mail:qgguo@126.com。通信作者梁国鲁,E-mail:lianggl@swu.edu.cn
