百合细胞悬浮体系构建及多糖含量测定的探索
2018-05-13陈秋逸尤玉玲马芃锐郑冬超
张 帆,陈秋逸,尤玉玲,马芃锐,赵 凯,郑冬超
(四川大学 生命科学学院,四川 成都 610065)
百合 (LiliumbrowniiF.E.Brownvar.viridulum Baker)多糖是从百合中提取的一类具有多种生物活性的化合物,其粗提物及纯化物具有较为广泛的药理作用,主要包括抗氧化、抗肿瘤、降血糖与免疫调节等作用,因此百合多糖逐渐成为一种新兴的生活保健药品[1-3]。目前大多数的百合多糖从百合鳞茎中提取,这样的获取方法不但成本高而且生产周期长,难以满足日益增长的生产需求[4-6]。同时其来源的缺乏也阻碍了关于百合多糖化学结构的研究[4,6],这也成为百合多糖化学合成的一个瓶颈,使得其各种药理作用机制尚不明确。
植物细胞悬浮体系构建的相关研究近年来已得到了广泛的关注[7-9],其中百合细胞悬浮体系的构建已取得一些进展[10-11],然而利用百合细胞悬浮体系来生产百合多糖的相关报道很少。本项目计划构建起百合的细胞悬浮体系,然后通过激素调节来诱导其产生百合多糖,并对多糖含量进行测定,找出诱导百合多糖生成的最佳激素配比,从而为百合多糖的工业化大规模生产提供新思路和理论指导。
1 实验材料与步骤
1.1 实验材料
本项目采用培育于四川大学生物实验教学中心植物组培室的百合无菌组培苗为实验材料。
百合组培苗的培育步骤如下:1)选取百合盆栽苗的子房、花柱作为外植体,先用流水冲洗30 min,加入少量洗洁精摇动洗涤10 min,再用流水冲洗1 h;2)然后转至超净工作台中用75%酒精消毒30 s,无菌水冲洗3~4次;3)用10%次氯酸钠摇动浸泡10 min,无菌水冲洗3~4次。4)将消毒好的材料用无菌滤纸吸干表面多余水分,用剪刀和解剖刀将子房或花柱剪切成1.5 cm左右的小段,将其接种于相同的分化诱导培养基中,每培养基接种2~3个外植体,然后将其放置于组培室中进行光照培养(分化诱导培养基成分为MS+6-BA 1.0 mg/L+NAA 0.5 mg/L+琼脂糖8 g/L+蔗糖30 g/L,pH=5.8)。5)在分化培养基上培养1月左右,外植体逐渐分化出芽,将其转移至伸长培养基中(伸长培养基成分为MS+6-BA 0.5 mg/L+IBA 0.1 mg/L+琼脂糖8 g/L+蔗糖30 g/L,pH=5.8)。6)待茎芽伸长至2 cm左右时,再转移至生根培养基中 (生根培养基成分为1/2MS+NAA 0.2 mg/L+琼脂糖8 g/L+蔗糖20 g/L,pH=5.8)。7)生根培养1~2月左右,可获得完整的百合组培苗,将其扩繁后以备后续实验所用。
1.2 实验步骤
1.2.1 百合愈伤组织的诱导
选取百合组培苗的叶片、叶柄和鳞茎作为外植体。叶片用剪刀在叶中间部位横切至叶脉处;叶柄切成l~2 cm长的小段;鳞茎竖切成两半。将处理后的材料置于含不同激素配比的愈伤诱导培养基上,如表1所示,避光培养。记录初始愈伤组织产生时间,培育40 d后统计愈伤组织块数,计算愈伤组织诱导率 (愈伤组织诱导率=产生愈伤组织的外植体个数/接种外植体总数 ×100%)[12-13],记录愈伤组织生长状态 (颜色、致密程度、生长速度、褐化程度等)。

表1 百合愈伤组织诱导实验的不同激素配比(mg/L)
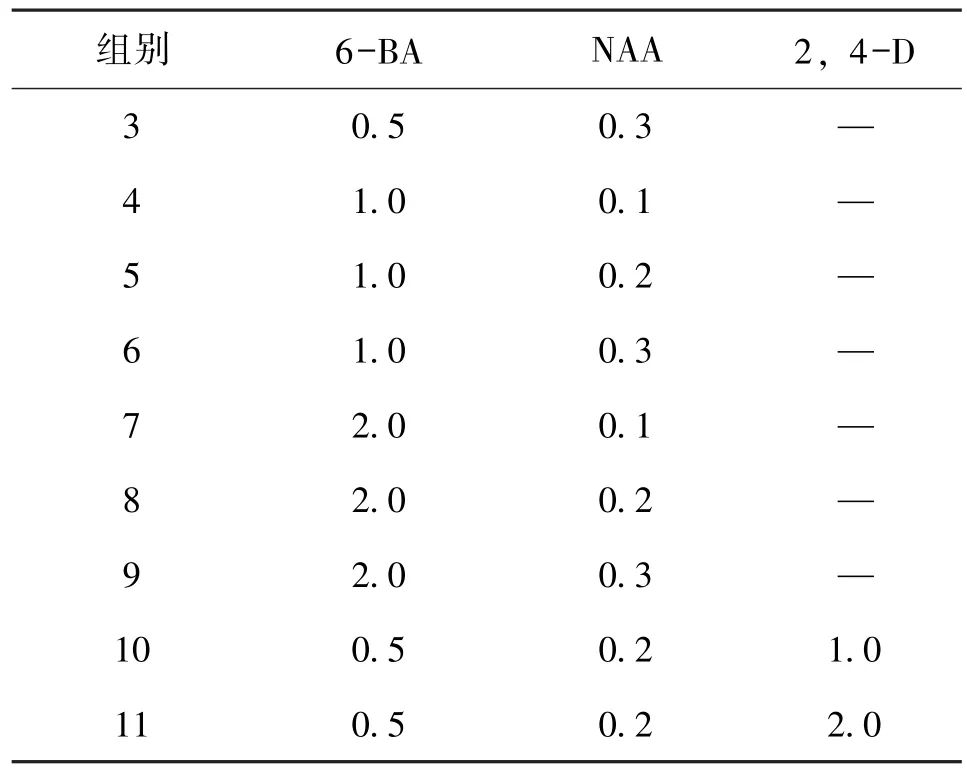
表1 (续表)
1.2.2 百合细胞悬浮体系的构建
选取生长良好的百合愈伤组织,于超净工作台上将其尽量切碎后转移至20 mL液体培养基中,置于150 rpm的摇床上黑暗振荡培养,温度为25℃。定期观察其生长状态,及时清理污染,每隔7~10 d对其进行继代培养。初始悬浮细胞培养液配方为 MS+6-BA 0.5 mg/L+2,4-D 2.0 mg/L+NAA 0.2 mg/L+蔗糖30 g/L,pH=5.8。1.2.3 不同激素处理百合细胞悬浮体系
百合悬浮细胞培育2周左右,待其生长状态良好,浓度适宜时,对其进行不同的激素组合处理如表2所示,每个处理重复4次,每隔7~10 d继代。(mg/L)
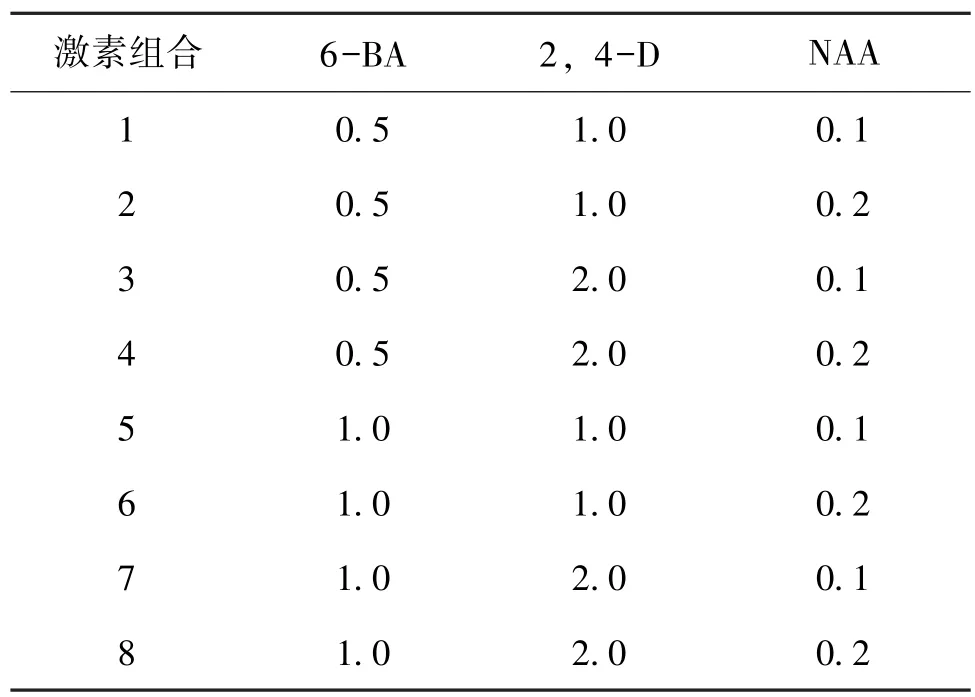
表2 百合细胞悬浮体系激素处理组合
1.2.4 百合多糖的提取
激素处理20 d后,过滤收集各处理下的百合悬浮细胞样品,记录重量,研磨成粉末,置通风处晾干,在水浴80℃下,加入15倍量水 (料液质量比)提取2~3次,每次2 h,过滤,合并滤液和愈伤培养液,加热浓缩,然后加入3倍浓缩液体积的95%(V/V)乙醇,置于4℃冰箱中过夜。待絮状凝胶物和粒状沉淀析出后,以3 000 r/min离心20 min,弃上清,沉淀加适量45℃水溶解,加入3倍量95%乙醇,再经静置、离心、过滤后,依次用无水乙醇、丙酮各洗涤两次,40~60℃干燥得百合多糖粗提物。多糖产品再用适量45℃蒸馏水定容,记录体积、稀释倍数,即为待测样液。
1.2.5 葡萄糖标准曲线的绘制
精密称取干燥至恒重的无水葡萄糖标准品20 mg,蒸馏水溶解并定容至500 mL容量瓶中,即得0.04 mg/mL的葡萄糖标准品溶液。吸取0.04 mg/mL葡萄糖标准品溶液 0.4,0.6,0.8,1.0,1.2,1.4,1.6及1.8 mL,分别置于10 mL带塞试管中,各以蒸馏水补至2.0 mL,再分别加6%苯酚试剂1.0 mL摇匀,迅速滴加浓硫酸5.0 mL,静置10 min,摇匀冷却,室温放置20 min。另以蒸馏水2.0 mL,作为空白对照同上操作。于490 nm处测定吸光度值。同一浓度的标准溶液重复测定3次。以多糖溶液浓度(μg)为横坐标,吸光度值(A)为纵坐标,绘制标准曲线,计算回归方程,如图1所示。

图1 葡萄糖标准曲线
1.2.6 百合多糖含量的测定
精密称取2 mL百合多糖样品溶液,加6%苯酚试剂1.0 mL摇匀,迅速滴加浓硫酸5.0 mL,静置10 min,摇匀冷却,室温放置20 min。取蒸馏水(同1.2.5节处理)作为空白对照液,于490 nm处测吸光度值。从回归方程中求出样品溶液中的多糖浓度,然后再根据以下公式计算其多糖含量[14-16]。
多糖含量(%)=(样品液多糖浓度×样品体积×稀释倍数/样品重)×100%。
2 结果与分析
2.1 不同激素配比及外植体部位对百合愈伤组织诱导效果的影响
为研究不同激素处理对百合愈伤组织诱导效果的影响,统一采用百合组培苗的叶片为材料,设立了11个激素组合来进行实验 (见表1)。结果发现,在只添加NAA和6-BA的前9个激素组合里,激素组合2(6-BA 0.5 mg/L+NAA 0.2 mg/L)相比其他8组愈伤组织形成最早,诱导效率最高,达到了35%,但总体来说这9个组合的诱导效率都不理想,且玻璃化及褐化现象较为严重。通过查阅资料,我们又增设了两个激素组合,来探索采用3种植物激素2,4-D、NAA、6-BA协同处理对百合愈伤组织诱导的影响。结果发现,在3种激素协同处理的组合10和组合11里,百合愈伤组织诱导效率均高于前9个组合,组合11(6-BA 0.5 mg/L+2,4-D 2.0 mg/L+NAA 0.2 mg/L) 的愈伤组织诱导效率要高于组合10,达到了60%,其愈伤组织形成较早,褐化及玻璃化程度也大大下降,愈伤组织呈淡黄或黄色,较疏松且生长速度快,如表3所示。因此,在本实验所设条件下,6-BA 0.5 mg/L+2,4-D 2.0 mg/L+NAA 0.2 mg/L是诱导百合愈伤组织形成与生长的最佳激素组合。

表3 不同激素浓度对百合愈伤组织诱导的影响

表3 (续表)
为了研究不同外植体对百合愈伤组织诱导效果的影响,选取百合组培苗的叶片、叶柄、鳞茎3个部位来进行愈伤诱导,选用统一的激素组合(6-BA 0.5 mg/L+2,4-D 2.0 mg/L+NAA 0.2 mg/L)进行处理。培育40 d后观察诱导效果,结果发现采用鳞茎作为外植体愈伤组织形成时间最短,生长也较快,但是鳞茎愈伤组织极易分化形成气生根,导致愈伤诱导率大幅下降;叶片的愈伤组织形成时间较长,且褐化情况严重,也易于玻璃化;叶柄的愈伤诱导率相对较高,愈伤组织成黄色或淡黄色,较疏松且生长快,其玻璃化及褐化程度也低于叶片和鳞茎,如图2和表4所示。因此,综合考虑下,百合组培苗的叶柄可以作为其愈伤组织诱导的一种较为理想的材料。

图2 不同百合外植体取材部位的愈伤组织诱导效果
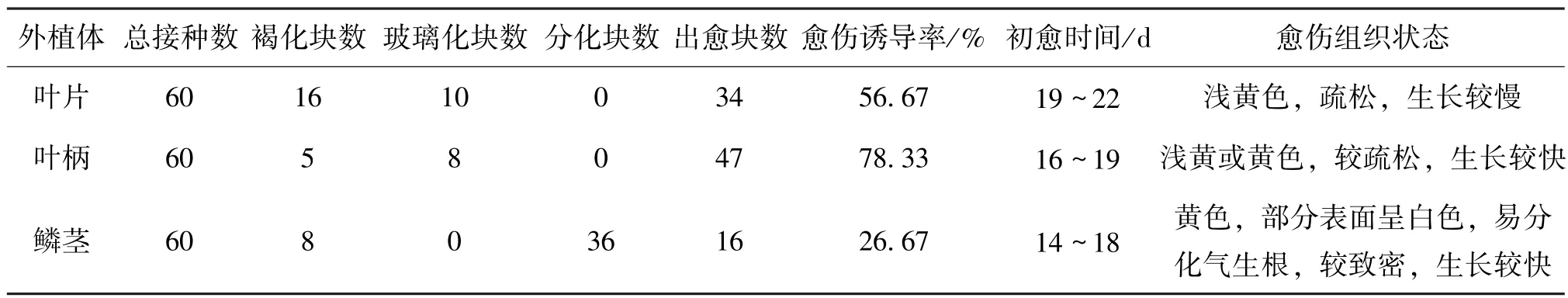
表4 不同百合外植体取材部位对愈伤组织诱导的影响
2.2 不同激素处理对百合多糖含量的影响
百合悬浮细胞利用统一的激素组合 (6-BA 0.5 mg/L+2,4-D 2.0 mg/L+NAA 0.2 mg/L) 处理14 d后,其悬浮溶液中的细胞呈现出健康的淡黄色,颗粒均匀饱满,生长状态良好,细胞悬浮溶液浓度适中。再经不同的激素配比处理20 d(见表2),然后采用苯酚硫酸法测定各处理下悬浮细胞的百合多糖含量。结果显示:在激素组合8的处理下,百合悬浮细胞生长速度较快,长势良好,且百合多糖含量最高,达到了3.8%。因此,在本实验所设的条件下,用于百合细胞悬浮体系构建及诱导百合多糖生成的最佳激素组合为6-BA 1.0 mg/L+2,4-D 2.0 mg/L+NAA 0.2 mg/L,如表5所示。
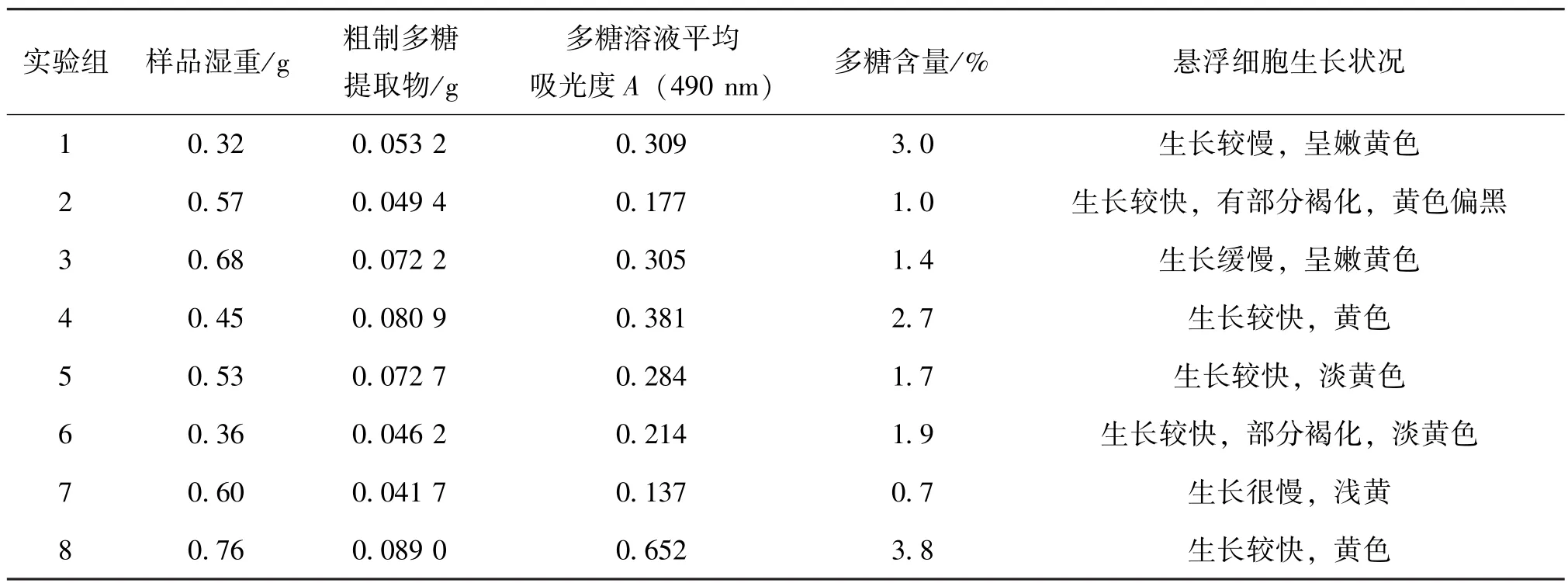
表5 不同激素处理下百合愈伤组织的多糖含量
3 结束语
为了研究百合细胞悬浮体系构建及诱导百合多糖生成的最佳培养条件,我们以百合组培苗为材料,诱导其愈伤组织形成,进而构建起其细胞悬浮培养体系,然后通过不同激素处理,诱导百合细胞悬浮体系产生百合多糖,并对各处理下的多糖含量进行测定。
在百合愈伤组织诱导方面,我们发现相比只用6-BA和NAA处理,采用3种植物激素2,4-D、NAA、 6-BA协同处理 (6-BA 1.0 mg/L+2,4-D 2.0 mg/L+NAA 0.2 mg/L)可使得百合愈伤组织诱导率大大提高,褐化及玻璃化现象也得到大大缓解。这与前人的一些研究成果一致:2000年在文献[17]的研究中证明3种植物激素2,4-D、NAA、6-BA协同处理要高于单种激素处理;2009年在文献 [18]研究中报道,只采用6-BA、NAA激素处理最适于百合的分化培养,而适当添加高浓度2,4-D有利于愈伤组织的形成。另外发现,以百合组培苗的叶柄作为外植体,愈伤组织的生长状态最好,诱导率最高。
在百合悬浮细胞培养及诱导百合多糖生产方面,发现在激素组合6-BA 1.0 mg/L+2,4-D 2.0 mg/L+NAA 0.2 mg/L的处理下,百合悬浮细胞生长速度较快,长势良好,且百合多糖含量最高,达到了3.8%。百合多糖的提取从传统的水提法、溶剂提取法,发展到超声波辅助法、微波辅助法,其提取率得到了大大的提升。文献[19]以新鲜兰州百合为材料,采用优化的水提法提取百合多糖,其百合粗多糖提取率为0.92%。文献 [20]以超声波辅助法提取药用百合干片中的百合多糖,提取率可达1.37%。文献[21]以微波辅助法提取百合多糖,其提取率可达3.14%。文献[22]以优化条件的超声波辅助法提取百合多糖,提取率可达7.92%。虽然本实验所用样品重量为湿重而非干重,这会影响数据结果,但总体来说本实验百合多糖的提取率仍然不够理想,还需要我们后期再采用更为先进的提取工艺,设立更多的激素处理,找出更适宜诱导百合多糖生成的激素配比。
本研究从百合组培苗的培育、愈伤组织的诱导、细胞悬浮体系的构建,到百合多糖的提取和含量测定,做出了一条完整的生产百合多糖的路线,找出了在实验所设条件下,百合悬浮细胞体系构建及诱导百合多糖产生的最适宜培养条件,在实验室阶段验证了该实验方案的可行性。本研究对实现百合多糖的大规模工业生产具有一定的指导意义。
[1]苗明三.百合多糖抗氧化作用研究[J].中药药理与临床,2001,17(2):12-13.
[2]刘成梅,付桂明,涂宗财,等.百合多糖降血糖功能研究[J].食品科学,2002,23(6):113-114.
[3]李利华.百合多糖的含量测定及抗氧化活性研究[J].湖北农业科学,2011,50(14):2954-2957.
[4]赵国华,李志孝,陈宗道,等.百合多糖的化学结构及抗肿瘤活性[J].无锡轻工大学学报,2002,21(1):62-66.
[5]马君义,赵小亮,张继,等.兰州百合的研究进展[J].塔里木大学学报,2005,17(4):53-56.
[6]任利君,刘俊田,弥曼,等.百合多糖的研究进展[J].西北药学杂志,2005,20(6):284-285.
[7]王艳红,龚束芳,车代弟,等.丰花月季愈伤组织的诱导及细胞悬浮培养[J].东北农业大学学报,2007,38(2):161-165.
[8]陈文源,吕一婷.药用植物细胞悬浮培养与新药研发进展(综述)[J].亚热带植物科学,2009,38(4):85-88.
[9]冯玥,习洋,陈串,等.刺槐胚性细胞悬浮体系的建立[J].东北林业大学学报,2014,42(12):80-84.
[10]姜新超.百合悬浮细胞体系的建立及植株再生[D].北京:中国农业科学院,2010.
[11]权永辉.百合体细胞胚的诱导及悬浮培养的研究[D].陕西:西北农林科技大学,2013.
[12]王纪,谢寅峰,方升佐.青钱柳愈伤组织诱导与增殖的初步研究[J].安徽农业科学,2012,40(3):1309-1312.
[13]胡选萍.不同因素对魔芋愈伤组织诱导及增殖分化的影响[J].湖北农业科学,2014,53(21):5288-5291.
[14]杨林莎,李玉贤,李明丽,等.苯酚-硫酸比色法测定百合多糖的含量[J].中国中医药信息杂志,2004,11(8):704-705.
[15]杨林莎,李玉贤,李秋杰,等.百合多糖提取、纯化工艺优选[J].中医研究,2005,18(1):25-27.
[16]李霞,张峰,李永才,等.兰州百合不同部位多糖含量及抗氧化活性的比较[J].食品工业科技,2012,33(24):88-91.
[17]孙君社,方晓华.植物激素对百合鳞片愈伤组织生长的影响[J].中国农业大学学报,2000,6(6):58-61.
[18]李筱帆.几种百合组织培养及体细胞胚发生技术的研究[D].北京:北京林业大学,2009.
[19]熊明郁,牛世全.水提法提取百合多糖优选工艺的研究[J].安徽农业科学,2014,42(36):13047-13049,13065.
[20]禹文峰,任凤莲,吴晓斌.百合多糖的超声波提取工艺研究[J].广州化学,2007,32(2):36-40.
[21]罗金花.微波辅助萃取百合多糖的工艺研究[J].宜春学院学报,2008,30(4):25-26.
[22]杨朝霞,段美香,佘高照,等.响应面分析法优化百合多糖超声提取工艺研究[J].广州化工,2013,41(18):52-55.
