一株铬还原菌的分离鉴定及铬还原特性研究
2018-05-11杨宇高宇程潜朱振宇胡婷婷徐全李爱民
杨宇 ,高宇,程潜,朱振宇,胡婷婷,徐全,李爱民
1.中南大学资源加工与生物工程学院,湖南 长沙 410083;2.中南大学教育部生物冶金重点实验室,湖南 长沙 410083;3.湖南省煤炭科学研究院,湖南 长沙 410004
铬是一种被广泛使用的有毒重金属,在电镀、皮革鞣制、木材保护、纺织染色和金属加工等工艺中都有大量应用(Zahoor et al.,2009)。铬在自然条件下以 Cr(Ⅱ)到 Cr(Ⅵ)9种氧化态存在,但在大气、土壤和水中最常见的铬化合物是以 Cr(Ⅵ)或Cr(Ⅲ)形式存在(Thacker et al.,2006)。Cr(Ⅲ)是生物所必需的微量营养元素,相对难溶于水,无致癌性;而Cr(Ⅵ)主要以Cr2O72-和CrO42-形式存在,相比于Cr(Ⅲ),其具有高迁移性、高水溶性和对所有生物体有毒等特性。Cr(Ⅵ)对人体产生毒害的主要表现形式是出现皮炎、肺和鼻中隔侵袭性反应(Shih et al.,2015)。
根据EPA与EU等规定,水体中的最大总铬浓度限值为 0.1 mg·L-1,Cr(Ⅵ)浓度限值为 0.05 mg·L-1(Graham et al.,2010)。目前由于不合理的处理方式,造成了严重的环境铬污染,在普通废水残渣中Cr(Ⅵ)含量超出背景值数千倍(Zhong et al.,2016)。在这种情况下,如果工业含铬废水废物无法被有效解决,可能导致天然水源的污染,并最终威胁人类健康。
常规的Cr(Ⅵ) 修复方式包括化学还原(Chen et al.,2015;Graham et al.,2010)、离子交换(Alvarado et al.,2013;Hamdi et al.,2013)、吸附(Alothman et al.,2012;Wang et al.,2013;Jung et al.,2012)、电化学(Xafenias et al.,2015;Dharnaik et al.,2014)等方法,而这些方法成本昂贵,并会消耗大量的化学物质且易造成二次污染。为了克服这些常规方法的缺陷,学者们将关注点集中于利用微生物来吸附或还原Cr(Ⅵ),相比于化学材料吸附和电化学修复等技术,微生物修复技术更为环保高效,且反应温和,成本低廉,操作简单,不易对环境造成危害(Khorramabadi et al.,2012),可为中国环保高效修复铬污染开辟一条崭新的途径。因而,本研究从长沙铬污染场地分离出一株对Cr(Ⅵ)还原及耐受能力较强的菌株G-12,并进一步探寻该菌种在不同培养条件下的铬还原特性,以期实现该菌株在实践修复铬污染场地中的工程应用。
1 材料与方法
1.1 材料
1.1.1 土样
供试土样采集于湖南某铬盐厂,随机取样,经过自然风干,研磨,过200目筛所得。
1.1.2 培养基
用改良的LB培养基筛选、培养G12菌。培养基成分(He et al.,2014)为:蛋白胨 10 g·L-1,氯化钠5 g·L-1,酵母提取物5 g·L-1,磷酸氢二钾0.05 g·L-1,七水硫酸镁0.2 g·L-1;若为固体 LB 培养基,则加琼脂1.5%~2.0%,pH 8.5~9.0,121 ℃,20 min高温高压蒸汽灭菌。
1.1.3 铬标准液
10 g·L-1Cr(Ⅵ)标准液(Viti et al.,2003):称取烘干的(120 ℃,2 h)重铬酸钾2.84 g溶于100 mL去离子水中,过滤除菌,置于4 ℃冰箱中备用。
1.2 方法
1.2.1 菌株的富集分离纯化
取土样10 g加入到90 mL改良的灭菌液体LB培养基中,170 r·min-1、30 ℃振荡60 min进行富集培养,之后以10倍梯度稀释,各吸取0.2 mL涂布在含200 mg·L-1Cr(Ⅵ)的固体改良LB培养基上,在30 ℃恒温培养箱中培养24 h(杨文玲等,2013),观察记录不同单菌落特征,之后挑取不同形态的单菌落进行划线纯化,即可得到具Cr(Ⅵ)抗性的纯菌株。反复纯培养之后将筛选出的Cr(Ⅵ)抗性菌株接种于含50 mg·L-1Cr(Ⅵ)的改良液体LB培养基中,隔一定时间后取样,利用原子吸收分光光度计测定总铬浓度,用紫外分光光度计测定Cr(Ⅵ)浓度,即可筛选出六价铬还原菌株(Zhang et al.,2016)。
1.2.2 菌株鉴定
菌株的个体形态观察以及菌株的生理生化特征参照郝宇(2015)进行操作分析。
16S rRNA的扩增测序和系统发育树的构建:菌株G12的基因组DNA提取参照《TIANGEN细菌基因组DNA提取试剂盒》,以菌株G12的基因组 DNA 为模板,利用正向引物 27F:5’-AGAGTTTGATCCTGGCTGGCTCAG-3’和反向引物 1492R:5’-GGTTACCTTGTTACGACTT-3’进行PCR扩增。PCR产物由上海铂尚测序有限公司完成16S rRNA的测序。测序所得序列利用NCBI数据库进行比对。根据 G-12及其相近种属的 16S rRNA基因序列,采用Mega 7.0软件构建系统发育树,进行系统发育分析。
1.2.3 菌株G12最适温度及pH测定
为了研究不同温度对菌株G12生长的影响,将对数期菌株G12种子液以5%的接种量接种于相同规格的改良液体LB培养基中[含50 mg·L-1Cr(Ⅵ)],分别置于25 ℃、30 ℃、35 ℃、40 ℃和45 ℃温度下(Zhao et al.,2010)进行振荡培养,空白对照为接种5%的无菌水LB培养基,隔不同时间取样,检测培养液在600 nm处的吸光值OD600,每个实验重复3次;另外,分别配制一组相同规格的液体LB培养基,其中pH值分别设置为3.0、5.0、7.0、8.0、9.0、10.0 和 11.0(Poornima et al.,2010),再以5%的接种量接种到已灭菌的上述改良液体LB培养基中,置于30 ℃、170 r·min-1恒温摇床中振荡培养,隔不同时间观测培养液的OD600值,每个实验重复3次。
1.2.4 菌株G12对不同浓度的Cr(Ⅵ)的耐受性及还原性研究
将对数期菌株G12的种子液以5%的接种量分别接种到含 50、100、200、400 和 600 mg·L-1Cr(Ⅵ)已灭菌的改良液体LB培养基中进行恒温振荡培养(Dhal et al.,2013),隔不同时间取样检测培养液的OD600值来观测菌株的生长状况,同时采用DPCI比色法(陈育翔,2008)测定 OD540处 Cr(Ⅵ)的浓度,进而检测菌株对Cr(Ⅵ)的还原效果,每个实验重复3次。
1.2.5 以不同碳源为电子供体对菌株 G12生长及Cr(Ⅵ)还原性的影响
将对数期菌株G12的种子液以5 %的接种量分别接种到含一定浓度葡萄糖、蔗糖、乳酸钠、甘油已灭菌的改良液LB培养基中[含50 mg·L-1Cr(Ⅵ)]进行恒温振荡培养(Lin et al.,2011),利用OD600值来检测菌株的生长状况,同时利用比色法测定菌株对Cr(Ⅵ)的还原效果,每个实验重复3次。
1.2.6 不同盐浓度对菌株G12生长及Cr(Ⅵ)还原性的影响
将对数期菌株G12以5%的接种量分别接种到含 5、10、15、20 和 25 g·L-1NaCl浓度的改良液体LB 培养基中[含 50 mg·L-1Cr(Ⅵ)]进行恒温振荡培养(Terahara et al.,2015),隔不同时间取样检测培养液的OD600值来观测菌株的生长状况,同时利用 DPCI比色法测定 OD540值检测菌株对 Cr(Ⅵ)的还原效果,每个实验重复3次。
1.2.7 不同重金属离子对菌株G12生长及Cr(Ⅵ)还原性的影响
将对数期菌株G12以5%的接种量分别接种到含 50 mg·L-1Ni2+、50 mg·L-1Zn2+、50 mg·L-1Cd2+、50 mg·L-1Mn2+、50 mg·L-1Cu2+的改良 LB 培养基中[含 50 mg·L Cr(Ⅵ)]进行恒温振荡培养(Narayani et al.,2013),隔不同时间取样检测培养液的 OD600值来观测菌株的生长状况,同时利用DPCI比色法测定OD540值检测菌株对Cr(Ⅵ)的还原效果,每个实验重复3次。
2 结果与分析
2.1 菌株G12鉴定
2.1.1 菌株G12的形态特征及生理生化特征
在光学显微镜下,菌株 G12呈圆杆状,可游动,但游动缓慢,革兰氏染色呈阳性;G12在固体改良LB培养基上培养24 h后,菌落呈乳白色啮齿状,边缘不规则,不透明,粗糙,中心褶皱、干巴,不易挑取,专性好氧,菌株的具体菌落形态如图1所示。
菌株G12所对应的生理生化反应结果如表1所示。吲哚试验、V-P试验、甲基红试验均呈现阳性,且可利用单糖、二糖,但不能利用多糖类物质。
图1 菌株G12的菌落形态图Fig.1 Colony morphology of strain G12
2.1.2 16S rRNA基因测序和系统发育分析
以菌株G12的DNA为模板,以27F、1492R为引物进行 PCR扩增,并测定了其序列。经 16S rRNA基因测序及同源性比较,结合生理生化鉴定,结果显示该菌株 G12的 16S rRNA基因序列与Bacillus pumilusATCC 7061(NR 043242.1)序列的相似性可达到99%,确定分离的菌株G12为短小芽孢杆菌(B.pumilus),暂命名为B.pumilusG12。将该菌株与同源性高的细菌进行系统发育分析,得到系统进化发育树(图2)。
2.2 温度及pH对菌株G12生长的影响
将菌株G12置于改良后的LB液体培养基中培养,在25~45 ℃的温度范围内都可以较好地生长,其中在 25 ℃和 30 ℃的培养条件下,菌株生长得最好(图3A);在高于40 ℃的培养条件下,菌株生长状况较差,说明该菌株适宜于在中温环境下生长。菌株G12在pH值为5.0~10.0的改良LB液体培养基中均可生长,最适生长pH为9.0(图3B),而在pH 3.0和pH 11.0这种极酸和极碱的培养条件下,菌株G12的生长受到抑制,几乎不能生长。说明菌株G12适宜在中性及偏碱性的环境中生长。
2.3 菌株G12对不同浓度Cr(Ⅵ)的耐受性及还原性研究
在细菌生长过程中,Cr(Ⅵ)浓度会影响细菌生长及其对Cr(Ⅵ)的去除效率。随着Cr(Ⅵ)浓度的升高,菌体对 Cr(Ⅵ)的还原时间延长,Cr(Ⅵ)的还原效率降低(Gutiérrez et al.,2010)。由图4A可知,菌株G12在50 mg·L-1Cr(Ⅵ)浓度下生长趋势最好,在 50~200 mg·L-1Cr(Ⅵ)培养液中,菌株的生长几乎没有受到抑制,均可快速生长。当 Cr(Ⅵ)浓度达到400 mg·L-1时,菌株的生长出现延滞期,另外,培养液中Cr(Ⅵ)浓度达到600 mg·L-1时,菌株的生长受到严重抑制,不能生长。说明随着培养液中 Cr(Ⅵ)浓度倍增,菌株的耐受性也逐级递减,可能是随着Cr(Ⅵ)浓度的升高,Cr对菌体的致毒性增强,因而出现抑制菌体生长的现象,而400 mg·L-1Cr(Ⅵ)溶液对菌体生长是一个阈值。同时,菌株G12在不同浓度 Cr(Ⅵ)下的还原趋势如图 4B所示,随着初始Cr(Ⅵ)浓度的升高而下降,在50、100、200、400和600 mg·L-1的初始 Cr(Ⅵ)浓度条件下,菌株在 96 h时的铬还原率分别为66.2%,35.7%,26.1%,16.0%和6.0%。这可能是初始Cr(Ⅵ)浓度的升高,使得菌体G12的生长受到抑制,进而抑制了G12体内铬还原酶的能力,表现出还原率递减趋势。

表1 G12菌株的生理生化特征Table1 Physiological and biochemical characteristics of G-12 strain

图2 基于16S rRNA序列同源性构建菌株G12的系统发育树Fig.2 Phylogenetic tree based on 16S rRNA sequence of strain G12
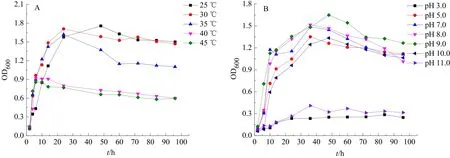
图3 不同温度及pH条件下菌株G12的生长曲线Fig.3 Growth curves of strain G12 at different temperatures and pH

图4 不同初始Cr(Ⅵ)浓度下菌株G12的生长曲线及还原特性Fig.4 Growth curve and reduction characteristics of strain G12 at different initial concentrations of Cr ()Ⅵ
2.4 以不同碳源为电子供体对菌株 G12生长及Cr(Ⅵ)还原性的影响
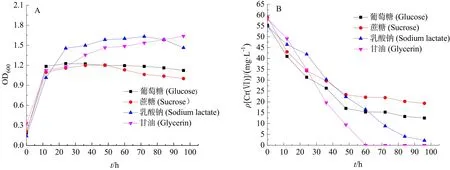
图5 不同电子供体条件下菌株G12的生长曲线及还原特性Fig.5 Growth curve and reduction characteristics of strain G12 under different electron donor conditions
碳源的类型包括糖类、有机酸、脂类、醇类这4种类型,而这4类碳源可在氧化还原过程中作为电子供体参与微生物生长过程中体内电子的传递,且不同电子供体对菌株的作用也存在较大差异(Ge et al.,2015)。由于微生物可优先利用更有利于生长的电子供体,因而选择合适的电子供体对提高Cr(Ⅵ)的还原能力极其重要。本实验选取乳酸钠、蔗糖、甘油、葡萄糖4种不同碳源,研究其对菌株G12的生长及还原特性(图5)。如图5A所示,菌株G12在12 h内在4种类型的碳源条件下均以指数形式增长,但随着时间延长,菌体在不同碳源类型的培养液中的生长均受到影响,具体生长速度表现为:乳酸钠>甘油>葡萄糖>蔗糖。说明菌株可较好地利用脂类及有机酸类碳源,而对糖类的利用效果不佳。图5B所示为菌株G12在以不同碳源作外加电子供体时对Cr(Ⅵ)的还原趋势图。由图可知,以 4种类型的碳源作外加电子供体条件下,菌株G12对Cr(Ⅵ)的还原能力表现为:甘油>乳酸钠>葡萄糖>蔗糖。在以甘油为电子供体时,菌株G12对Cr(Ⅵ)的还原受到显著促进,在 60 h内,菌株对Cr(Ⅵ)的还原效果明显,可将培养液中 50 mg·L-1Cr(Ⅵ)还原至0,还原率达100%;乳酸钠对Cr(Ⅵ)的还原虽有促进作用,但效果略低于甘油,而在以葡萄糖和蔗糖为电子供体时,菌株对Cr(Ⅵ)的还原效果较差,这说明菌株在以脂类及有机酸类碳源为电子供体时,可显著促进菌株G12对Cr(Ⅵ)的还原,而以糖类为电子供体时,菌株生长受到抑制,进而抑制了菌株对Cr(Ⅵ)的还原能力。
2.5 不同盐浓度对菌株G12生长及Cr(Ⅵ)还原性的影响

图6 不同NaCl盐浓度条件下菌株G12的生长曲线及还原特性Fig.6 Growth curve and reduction characteristics of strain G12 under different NaCl concentrations
NaCl浓度反映了菌株对环境渗透压的耐受,且NaCl浓度可影响细菌生存(Terahara et al.,2015)。在稳定渗透压溶液中细菌细胞内含水量稳定,细菌生长最好(Ciacci et al.,2012)。在盐浓度过低或过高的情况下,菌体会因失水或水分过多胀破而导致菌量下降。在实践中偶尔会出现高盐铬污染废水,因此本实验考察了菌株G12对NaCl浓度的耐受性及其对Cr(Ⅵ)的还原特性。图6A所示为不同NaCl浓度条件下菌株G12的生长曲线。由图可知,随着NaCl浓度的增加,菌株G-12的生长相应受到抑制,但菌株G12也可耐受高盐环境。图6B所示为菌株G12在不同NaCl浓度下对50 mg·L-1Cr(Ⅵ)的还原趋势图。由图可知,在10 g·L-1NaCl浓度下,菌株的生长状况较好,相对应的Cr(Ⅵ)去除能力较强,在48 h时,菌株可还原50%的Cr(Ⅵ),在96 h时菌株还原率达到85%;在15 g·L-1和20 g·L-1NaCl浓度下,菌株的还原能力较强,可将 50 mg·L-1Cr(Ⅵ)还原至20 mg·L-1,还原率可达60%;而在25 g·L-1NaCl浓度下,相对5 g·L-1而言,菌株对Cr()Ⅵ的还原率受到明显抑制,还原率仅为40%。说明高盐浓度会抑制菌株对 Cr(Ⅵ)的还原能力,在 10~20 g·L-1NaCl浓度下,菌株还原能力较强,故菌株G12可应用于盐浓度偏高的铬污染废水处理。
2.6 不同重金属离子对菌株G12生长及Cr(Ⅵ)还原性的影响
在自然环境及工业污染场地,通常存在多种金属离子,不同金属离子会对微生物的生理生化特性产生不同的影响(Narayani et al.,2013)。在多种金属离子共存的条件下,不同的金属离子可能对细菌Cr(Ⅵ)还原产生一定的促进或抑制作用(Alam et al.,2011)。因此,本实验考察了菌株与Cd2+、Ni2+等5种重金属离子的协同与拮抗作用。由图7A可知,在培养液中加入其他重金属离子对菌株G12生长均具有一定的抑制作用,尤其是Cd2+,几乎完全抑制了菌株生长;其次是Zn2+,对菌株生长的抑制作用也较强;培养液中Ni2+、Cu2+、Mn2+虽对菌株生长有抑制作用,但抑制作用不显著,可使菌株正常生长。图7B所示为菌株G12在含50 mg·L-1不同重金属离子浓度下对Cr(Ⅵ)的还原趋势图。由图可知,含不同重金属离子的培养液均对菌株G12还原Cr(Ⅵ)具有一定抑制作用,尤其是当培养液中存在时,菌株G12对Cr(Ⅵ)还原率最低,说明一定浓度的Cd2+对菌株还原Cr(Ⅵ)的抑制强烈。而培养液在含有 Mn2+时,对细菌还原 Cr(Ⅵ)的抑制作用小,几乎不影响其对Cr(Ⅵ)的还原。具体抑制作用表现为 Cd2+>Ni2+>Zn2+>Cu2+>Mn2+。这说明环境中存在的混合重金属会对菌株G12细胞产生毒性,进而抑制其对Cr(Ⅵ)的还原能力。
3 结论
(1)本研究从湖南省某铬盐厂筛选出一株对Cr(Ⅵ)具有还原能力的适宜于偏碱性、中温环境中生长的异养菌G12。经过对菌株与菌落的形态学特征观察、生理生化实验和16S rRNA序列分析,鉴定该菌株G12为短小芽孢杆菌(Bacilluspumilus),暂命名为BacilluspumilusG12。
(2)短小芽孢杆菌G12的生长条件试验结果表明,该菌株具有较宽泛的 pH生长范围,在 pH 7.0~9.0范围内,尤其是pH=9.0条件下生长良好,但不能耐受极酸极碱的环境;短小芽孢杆菌G12生长的最佳温度是30 ℃,并可略耐受中高温。
(3)测试不同初始铬浓度、碳源、盐浓度、金属离子条件对G12菌株对Cr(Ⅵ)还原能力的影响,发现该菌株具备较好的Cr(Ⅵ)耐受及还原能力,在低浓度时,菌株Cr(Ⅵ)还原能力较强,随着铬浓度倍增,还原能力递减;在以乳酸钠、蔗糖、甘油、葡萄糖 4种不同碳源为外加电子供体时,菌株对Cr(Ⅵ)的还原率表现为:甘油>乳酸钠>葡萄糖>蔗糖;菌株G12可耐受较高盐浓度,在10 g·L-1NaCl浓度下,其相对应的Cr(Ⅵ)去除能力较强,在48 h时,菌株可还原50%的Cr(Ⅵ);含50 mg·L-1不同重金属离子培养液对菌株G12还原Cr(Ⅵ)的能力均具有一定抑制作用,具体抑制作用表现为:菌株在高毒性的重金属环境中仍存在一定还原能力,说明菌株G12在铬污染修复中具有良好的应用潜力。

图7 不同重金属离子条件下菌株G12的生长曲线及还原特性Fig.7 Growth curve and reduction characteristics of strain G12 under different heavy metal ions
参考文献:
ALAM M Z, AHMAD S. 2011. Chromium Removal through Biosorption and Bioaccumulation by Bacteria from Tannery Effluents Contaminated Soil [J]. Clean–Soil Air Water, 39(3): 226-237.
ALOTHMAN Z A, ALI R, NAUSHAD M. 2012. Hexavalent chromium removal from aqueous medium by activated carbon prepared from peanut shell: Adsorption kinetics, equilibrium and thermodynamic studies [J]. Chemical Engineering Journal, 184(2): 238-247.
ALVARADO L, TORRES I R, CHEN A. 2013. Integration of ion exchange and electrodeionization as a new approach for the continuous treatment of hexavalent chromium wastewater [J]. Separation & Purification Technology, 105(105): 55-62.
CHEN J, CHEN R, HONG M. 2015. Influence of pH on hexavalent chromium reduction by Fe (II) and sulfide compounds [J]. Water Science & Technology A Journal of the International Association on Water Pollution Research, 72(1): 22-8.
CIACCI C, BARMO C, GALLO G, et al. 2012. Effects of sublethal,environmentally relevant concentrations of hexavalent chromium in the gills of Mytilus galloprovincialis [J]. Aquatic Toxicology, 120-121:109-118.
DEVECI H, KAR Y. 2013. Adsorption of hexavalent chromium from aqueous solutions by bio-chars obtained during biomass pyrolysis [J].Journal of Industrial & Engineering Chemistry, 19(1): 190-196.
DHAL B, ABHILASH, PANDEY B D. 2013. Process optimization for bio-beneficiation of a chromite concentrate by a Cr (Ⅵ) reducing native microbe (Bacillus sp.) [J]. International Journal of Mineral Processing, 123(36): 129-136.
DHARNAIK A S, GHOSH P K. 2014. Hexavalent chromium [Cr (Ⅵ)]removal by the electrochemical ion-exchange process [J].EnⅥronmental Technology, 35(18): 2272-2279.
GE S M, GE S C, ZHOU M H, et al. 2015. Bioremediation of hexavalent chromate using permeabilizedBrevibacteriumsp.andStenotrophomonassp. Cells [J]. Journal of Environmental Management, 157: 54-59.
GRAHAM A M, BOUWER E J. 2010. Rates of Hexavalent Chromium Reduction in Anoxic Estuarine Sediments: pH Effects and the Role of Acid Volatile Sulfides [J]. Environmental Science & Technology,44(1): 136-142.
GUTIÉRREZ A M, PEÑA CABRIALES J J, VEGA M M. 2010. Isolation and characterization of hexavalent chromium-reducingrhizosphericbacteria from a wetland [J]. International Journal of Phytoremediation,12(4): 317-334.
HAMDI M, İBRAHIM P. 2013. Batch study and kinetics of hexavalent chromium removal from aqueous solutions by anion exchange resin(Dowex 21 KCl) [J]. Desalination & Water Treatment, 51(10-12):2116-2120.
HE Z, LI S, WANG L, et al. 2014. Characterization of Five Chromium-Removing Bacteria Isolated from Chromium-Contaminated Soil [J]. Water Air & Soil Pollution, 225(3): 1-10.
JUNG C, HEO J Y, HAN H J, et al. 2013. Hexavalent chromium removal by various adsorbents: Powdered activated carbon, chitosan, and single/multi-walled carbon nanotubes [J]. Separation & Purification Technology, 106(6): 63-71.
KHORRAMABADI G S, SOLTANI R D C, REZAEE A, et al. 2012.Utilisation of immobilised activated sludge for the biosorption of chromium (Ⅵ) [J]. Canadian Journal of Chemical Engineering, 90(6):1539-1546.
LIN X, LUO M, LI W, et al. 2011. Reduction of hexavalent chromium by pannonibacter phragmitetus, LSSE-09 stimulated with external electron donors under alkaline conditions [J]. Journal of Hazardous Materials,185(2-3): 1169-1176.
NARAYANI M, VIDYA SHETTY K. 2013. Chromium-resistant bacteria and their environmental condition for hexavalent chromium removal: A review [J]. Critical Reviews in Environmental Science & Technology,43(9): 955-1009.
POORNIMA K, KARTHIK L, SWADHINI S P, et al. 2010. Degradation of chromium by using a novel strains of Pseudomonas species [J]. Journal of Microbial & Biochemical Technology, (4): 95-99.
QIU L, MAO Y, GONG A, et al. 2016. Inhibition effect ofBdellovibrio bacteriovoruson the corrosion of X70 pipeline steel induced by sulfate-reducing bacteria [J]. Anti-Corrosion Methods and Materials,63(4): 269-274.
SHIH Y J, CHEN C W, HSIA K F, et al. 2015. Granulation for extended-release of nanoscale zero-valent iron exemplified by hexavalent chromium reduction in aqueous solution [J]. Separation &Purification Technology, 56(Part 3): 1073-1081.
TERAHARA T, XU X, KOBAYASHI T, et al. 2015. Isolation and Characterization of Cr (Ⅵ)-Reducing Actinomycetes from Estuarine Sediments [J]. Applied Biochemistry & Biotechnology, 175(7):3297-309.
THACKER U, SHOUCHE P Y, MADAMWAR D. 2006. Hexavalent chromium reduction byProvidenciasp[J]. Process Biochemistry,41(6): 1332-1337.
VITI C, PACE A, GIOVANNETTI L. 2003. Characterization of Cr(Ⅵ)-resistant bacteria isolated from chromium-contaminated soil by tannery activity [J]. Current Microbiology, 46(1): 1-5.
WANG J, PAN K, HE Q, et al. 2013. Polyacrylonitrile/polypyrrole core/shell nanofiber mat for the removal of hexavalent chromium from aqueous solution [J]. Journal of Hazardous Materials, 244-245(9):121-129.
XAFENIAS N, ZHANG Y, BANKS C J. 2015. Evaluating hexavalent chromium reduction and electricity production in microbial fuel cells with alkaline cathodes [J]. International Journal of Environmental Science & Technology, 12(8): 2435-2446.
ZAHOOR A, REHMAN A. 2009. Isolation of Cr (Ⅵ) reducing bacteria from industrial effluents and their potential use in bioremediation of chromium containing wastewater [J]. Journal of Environmental Sciences, 21(6): 814-820.
ZHANG J K, WANG Z H, YE Y. 2016. Heavy Metal Resistances and Chromium Removal of a Novel Cr (Ⅵ)-ReducingPseudomonadStrain Isolated from Circulating Cooling Water of Iron and Steel Plant [J].Applied Biochemistry & Biotechnology, 180(7): 1328-1344.
ZHAO Q, LIU H, YING Z, et al. 2010. Engineering of protease-resistant phytase fromPenicilliumsp.: High thermal stability, low optimal temperature and pH [J]. Journal of Bioscience & Bioengineering,110(6): 638-645.
ZHONG Y L, QIU X, CHEN D Y, et al. 2016. Fabrication of Unique Magnetic Bionanocomposite for Highly Efficient Removal of Hexavalent Chromium from Water [J]. Scientific Reports, 6: 31090.
陈育翔. 2008. 二苯碳酰二肼分光光度法测定电镀废水中六价铬的改进研究[J]. 化学工程与装备, (6): 121-123.
郝宇. 2015. 湿地土壤重金属含量与理化性质相关性研究及生物修复策略[D]. 齐齐哈尔: 齐齐哈尔大学生命科学与农林学院: 24-36.
杨文玲, 王继雯, 慕琦, 等. 2013. 耐 Cr(Ⅵ)菌株的筛选及条件优化[J].河南科学, 31(8): 1175-1179.
