筛选降尿酸肽的体外测定方法的建立与优化
2018-05-11杨柳康小燕梁明张婷任娇艳
杨柳,康小燕,梁明,张婷,任娇艳
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.无限极(中国)有限公司,广东广州 510000)
高尿酸血症是一种严重威胁人类健康的代谢类疾病。治疗高尿酸血症的手段主要有:抑制尿酸的生成,促进尿酸的排泄,加速尿酸的分解。其中,抑制尿酸的生成主要通过抑制黄嘌呤氧化酶(XO)的催化活性来实现。XO是嘌呤分解代谢过程中的一种关键酶。在人体的新陈代谢过程中,从食物中摄取的嘌呤类物质以及体内的核酸和ATP(adenosine triphosphate)会生成次黄嘌呤,然后由黄嘌呤氧化酶作用而转化生成尿酸[1]。因此,XO是抗高尿酸血症药物研究的关键靶点。研究表明氨基酸及多肽类物质具有良好的抑制XO的活性[2~4],能够有效的降低血尿酸水平。
文献中报道了多种测定黄嘌呤氧化酶抑制活性的方法,包括紫外分光光度法[2,5~7]、NBT/PMS 显色法[8]、双酶偶联法[9]、荧光分析法[8],MTS/PMS还原法[10],邻二氮菲法[1],高效液相色谱法[11~13]等。每种方法均有各自的局限性,对同一物质的检测结果也会有较大的差异,因此亟需建立一种稳定性精确度高的黄嘌呤氧化酶抑制活性方法。其次,对于多肽类样品,目前报道的大多数检测方法是直接或间接测定黄嘌呤氧化酶的催化产物尿酸的含量,检测原理是测定 290 nm(尿酸的最大吸收波长)左右尿酸的吸收值,或者是尿酸与染料络合得到的显色物质的含量,然而多肽类样品在290 nm下也具有较强的吸收,对紫外检测会产生较大的干扰,同时部分多肽类物质具有较好的还原性易与显色物质发生氧化还原反应,从而使检测结果呈现假阳性或者假阴性。基于XO的另一催化产物H2O2建立的检测方法是多肽类物质XO抑制活性检测的较好的选择。
本文建立了快速筛选多肽类物质对XO抑制活性的检测方法。首先选择双酶偶联法确定酶反应体系的最适条件,包括底物浓度、反应时间、酶浓度、缓冲液pH及反应温度等,初步筛选具有降尿酸功效的多肽类物质。然后采用高效液相色谱法定量分析多肽类物质对XO的抑制活性。最后,在优化后的酶反应条件下对比两种方法的精密度和准确度,探讨双酶偶联分光光度法干扰因素,确立双酶偶联法联合高效液相色谱法进行多肽类物质降尿酸活性测定的可行性。
1 材料与方法
1.1 材料与试剂
辣根过氧化物酶、黄嘌呤氧化酶购、黄嘌呤、别嘌呤醇(色谱纯)、非布司他(色谱纯)、氧化型谷胱甘肽(色谱纯)、还原性谷胱甘肽(色谱纯)均购于美国Sigma公司;4-氨基安替比林购于国药集团化学试剂有限公司;三羟甲基氨基甲烷购于上海伯奥生物科技有限公司;多肽由上海吉尔生化有限公司合成。其他化学试剂均为分析纯。
1.2 仪器与设备
FA2104N分析天平购于上海民桥精密科学仪器有限公司;PHS-3C精密pH计购于上海仪电科学仪器股份有限公司;UV754N紫外可见分光光度计购于上海仪电分析仪器有限公司;0.22 μm PES注射器用微孔滤膜购于上海珂淮仪器有限公司;一次性2.5 mL针头过滤器购于湖南平安医械科技有限公司;液相色谱仪购于日本Shimadzu公司;ZORBAX Eclipse Plus C18色谱柱购于美国 Agilent公司;涡旋混合仪 XW-80A购于上海精科实业有限公司;SHA-C水浴恒温振荡器购于常州澳华仪器有限公司;HH-4电热恒温水浴锅购于常州澳华仪器有限公司。
1.3 试验方法
1.3.1 双酶偶联法测定XO活性
溶液配制:1 mmol 4-氨基安替比林、12 mmol苯酚,7500 U/L HRP及50 mmol/L Tris-HCl配置显色液。黄嘌呤用 50 mmol/L的 Tris-HCl缓冲液定容至 100 mL。催化反应在50 mmol/L的Tris-HCl缓冲液体系中完成。研究单因素条件下,不同底物浓度、酶浓度、温度、pH、时间对酶活性的影响。双酶偶联法测定XO活性:在10 mL离心管中依次加入3150 μL显色液,50 μL XO 酶液和 400 μL 黄嘌呤溶液,混匀,30 ℃下保温20 min,煮沸5 min终止反应,冷却至室温后测定508 nm处的吸光值。以不加酶液反应体系作为参比,测定吸光值。样品反应条件:在10 mL离心管中依次加入 100 μL 样品,50 μL XO 酶液,混匀,30 ℃下温浴10 min。加入400 μL黄嘌呤溶液,3050 μL显色液启动反应,30 ℃下温浴20 min,煮沸5 min终止反应,待冷却至室温后测定508 nm处的吸光值。
1.3.2 高效液相色谱法测定尿酸含量
色谱条件:ZORBAX Eclipse Plus C18柱(4.6×250 mm,5 μm);流速为1 mL/min;柱温为25 ℃;进样量为20 µL。样品反应条件(总体积3600 μL):10 mL离心管中依次加入100 μL样品,50 μL XO酶液,混匀,30 ℃下温浴10 min。加入400 μL黄嘌呤溶液,2900 μL缓冲液启动反应,30 ℃下保温20 min,加150 μL 1 mol/L HCl终止反应。0.22 μm PES滤膜过滤反应液后进行高相液相检测,检测波长为290 nm。优化单一流动相条件如下:
流动相1:85% 15 mmol/L的NH4H2PO4+ 15%色谱级甲醇(pH 6.5);
流动相2:90% 15 mmol/L的NH4H2PO4+ 10%色谱级甲醇(pH 6.5);
流动相3:85% 15 mmol/L的NH4H2PO4+ 15%色谱级甲醇(pH 7.5);
流动相4:90% 15 mmol/L的NH4H2PO4+ 10%色谱级甲醇(pH 7.5);
流动相5:95% 15 mmol/L的NH4H2PO4+ 5%色谱级甲醇(pH 6.5)。
1.3.3 数据分析
每组实验重复测定 3次,结果表示为平均值±标准偏差(means±SD),采用SPSS 19.0、origin 8.5软件进行处理分析。
2 结果与讨论
2.1 双酶偶联分光光度法测定XO活性
2.1.1 底物浓度优化
本文选择黄嘌呤作为黄嘌呤氧化酶的反应底物。底物浓度对酶促反应的影响如图1所示。用酶促反应速率表示酶的催化活性。由图1(a)可知底物黄嘌呤的浓度与酶促反应速率呈现抛物线的关系,一定范围内,底物浓度越大,酶促反应速率越大,当底物将酶饱和时,酶促反应速率不随底物浓度增大而增大,反应达到平衡,符合米氏方程的特点。由图1(c)可知底物黄嘌呤的浓度倒数与酶促反应速率倒数呈线性关系,即:

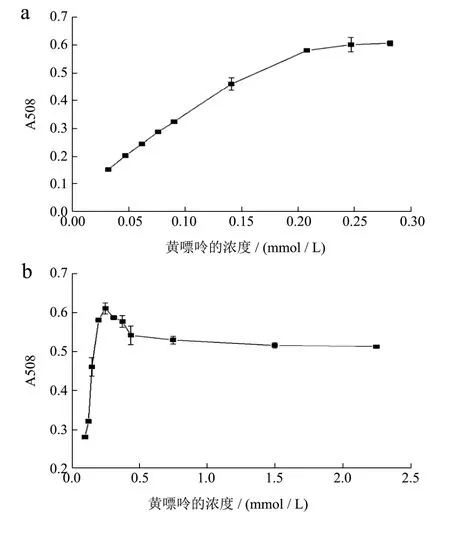
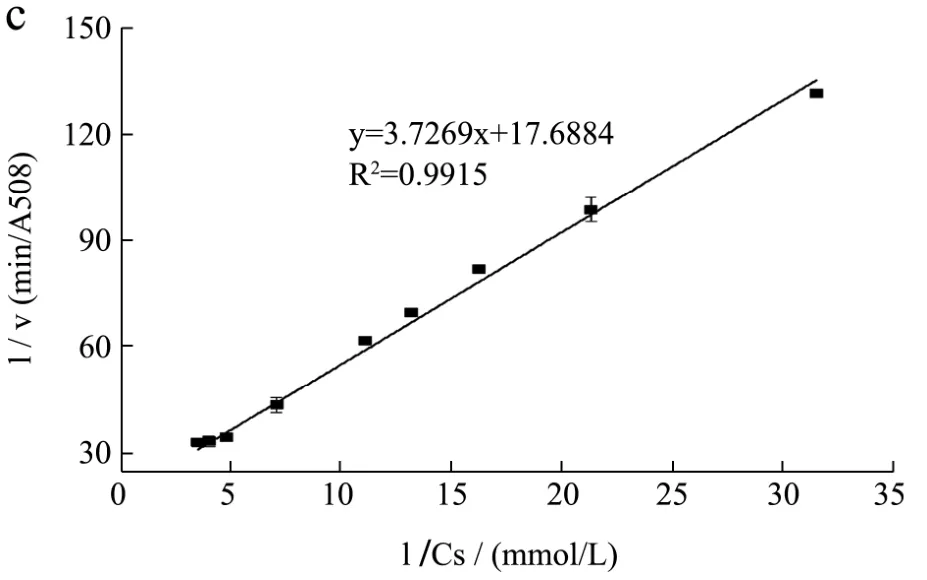
图1 黄嘌呤浓度对酶活的影响(a)、(b)双倒数作图(c)Fig.1 Effects of xanthine concentration on the activity of XO (a),(b) and Lineweaver-Burk plot (c)
2.1.2 反应条件优化
在双酶偶联法的酶促反应体系中,底物和辣根过氧化物酶过量、反应时间一定的情况下,黄嘌呤氧化酶的浓度决定了该体系的酶促反应速率。
算得黄嘌呤氧化酶酶的Km值为0.21 mmol/L。由图1(b)可知,黄嘌呤浓度过大会降低黄嘌呤氧化酶的活性,造成底物抑制,因此在双酶偶联反应体系中不宜以10Km作为反应的底物浓度,根据底物浓度选择区间1/10 Km~10 Km,选择本实验的底物浓度为0.22 mmol/L。
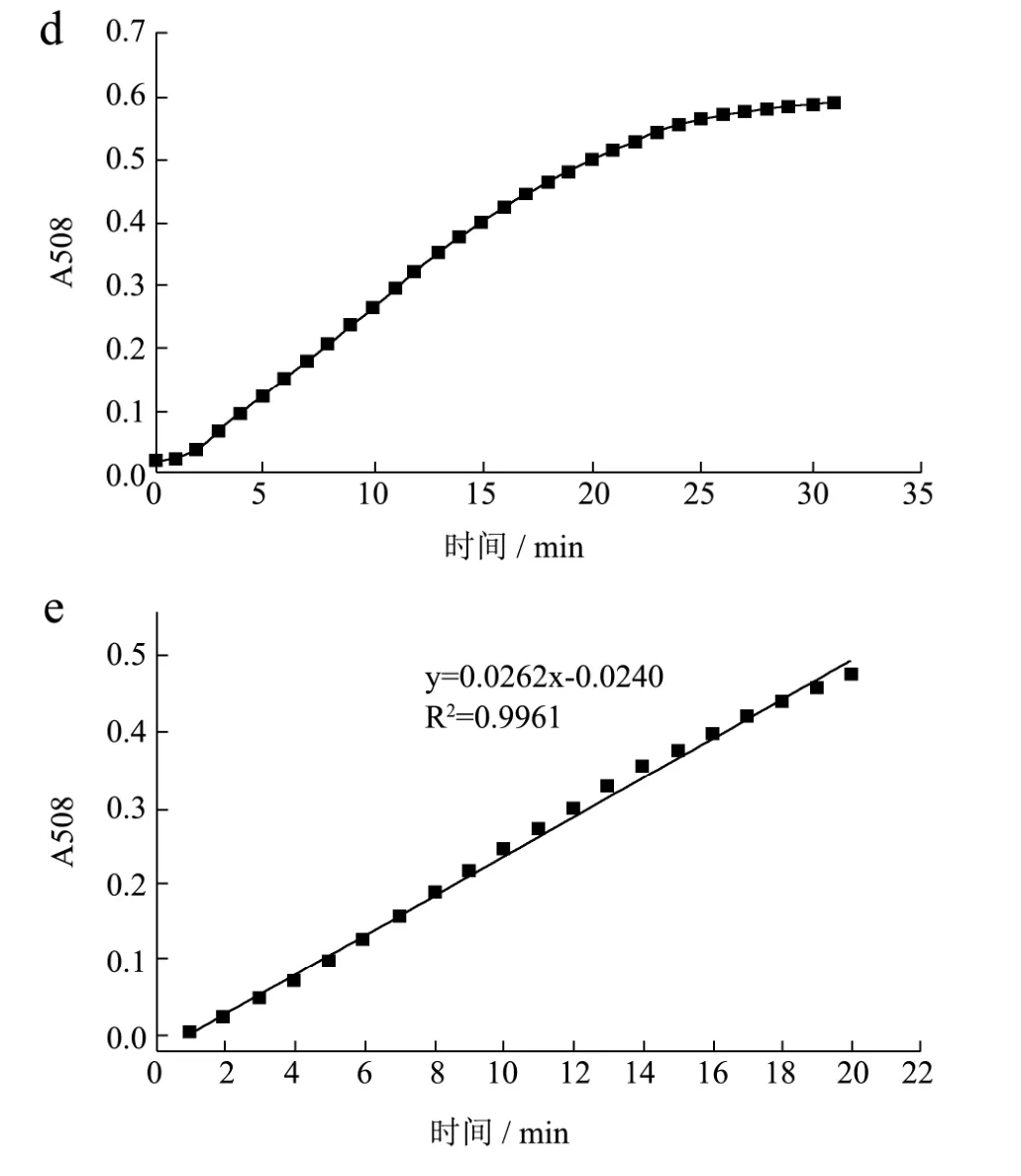
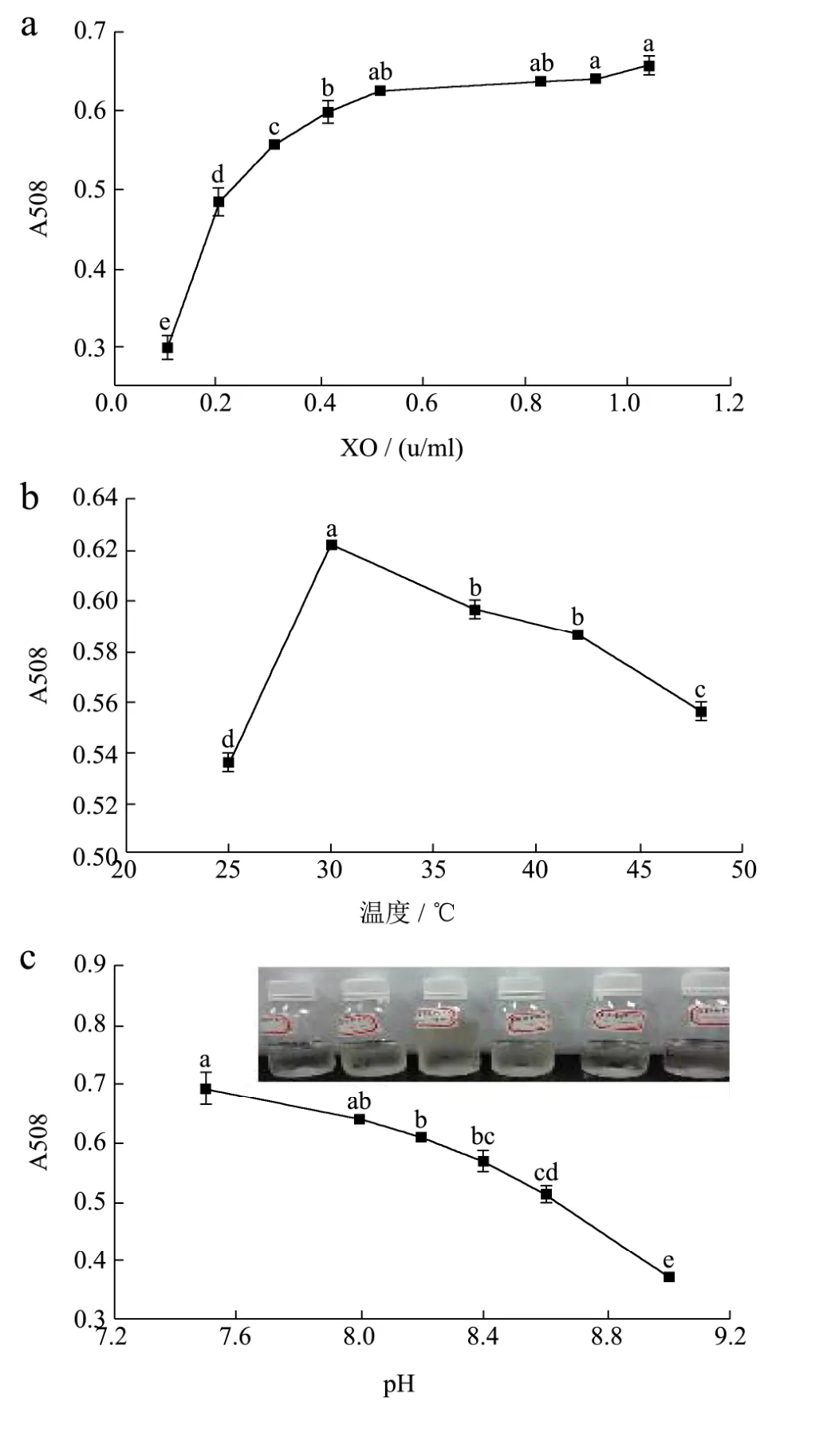
图2 各因素对XO酶活的影响Fig.2 Effects of various factors on the activity of XO
由图2 (a)可知,检测的吸光值随酶浓度的增大而增大,当酶浓度达到0.52 u/mL时,趋势趋于平缓,故本实验采用0.52 u/mL作为最适酶浓度。
温度条件的优化结果如图2(b)所示。随着温度的上升,A508值先增大后减少,符合温度对酶促反应速率影响的一般规律,温度较低时,酶促反应的速率随温度的升高而加快,超过一定范围后,酶随温度的升高而失活,酶促反应速率下降。故在该反应体系下,酶的最适反应温度为30 ℃。
pH 条件的优化结果如图 2(c)所示。在碱性范围内,酶活随pH的增大而减小。其中pH 7.5时,吸光值最大,达到0.7以上,但与其他pH的显色液相比,其呈现浅红色,与双酶体系的产物颜色相近,对检测有一定的干扰,因此本实验选择pH 8.0的碱性环境作为最适pH。
在此基础上,继续优化反应时间,结果由图2(d)所示,可知反应产物吸光值随反应时间的延长而增大,25 min后其增大趋势趋于平缓,反应达到动态平衡。最后定量描述此双酶偶联体系吸光值与反应时间之间关系的一级反应动力学方程,结果如图2(e)所示:该体系线性拟合良好,较好地符合一级反应动力学规律,动力学方程为y=0.0262x-0.0240,判定系数R2=0.9961。在双酶体系中,影响该反应速率的主要是第一步酶反应,该体系的综合反应是准一级反应。
2.1.3 双酶偶联法稳定性实验
反应终止后,将溶液于4 ℃冰箱静置24 h,分析检测显色液的稳定性。0、24 h测定其A508值见表1。
如表1所示,0、24 h测定体系吸光值的结果相比,其差别均在标准偏差范围内,并没有发生明显的变化,说明显色体系在24 h内具有良好的稳定性。
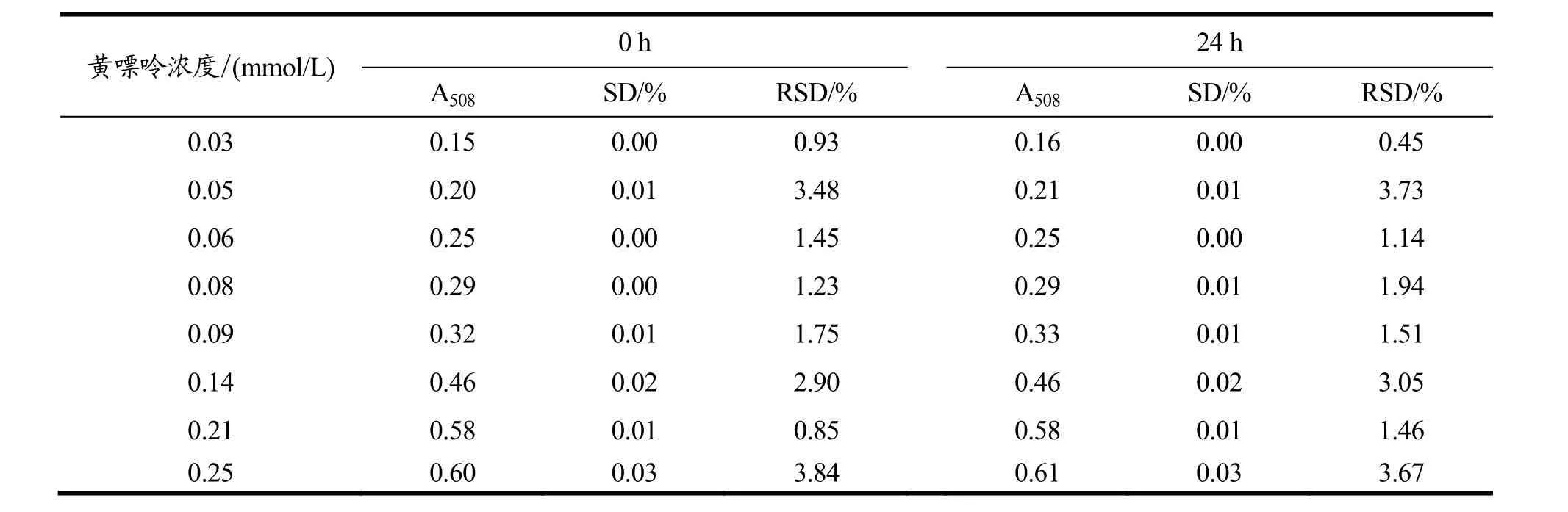
表1 稳定性比较Table 1 Comparison of stability
2.2 HPLC法测定XO酶活
2.2.1 流动相优化
选择四种水溶性极好且抗氧化性强的多肽Glu-Cys-His、还原型谷胱甘肽(GSH)、Tyr-Glu-Cys-Gly和Tyr-Glu-Gly作为标准多肽类物质,用于优化流动相条件。
因本实验采用极性流动相,以上多肽的亲疏水性,预测混合溶液中各物质的出峰时间先后如下:Glu-Cys-His>GSH>Tyr-Glu-Cys-Gly> 尿 酸 >Tyr-Glu-Gly>黄嘌呤>别嘌呤醇。五种流动相对单一样品的分离效果如图3所示。UA表示尿酸,X表示黄嘌呤。
将流动相1和流动相2,流动相3和流动相4两两对比发现:其他条件一定,有机相比例不同,有机相比例低的各组分出峰时间延长,但分离度提高。
图3a中所有物质的出峰时间在5 min内,图3b中所有物质的出峰时间在8 min内,两种流动相条件GSH的峰与尿酸峰重叠。将流动相1和流动相3,流动相2和流动相4两两对比发现:其他条件一定,流动相的pH不同,Tyr-Glu-Gly的出峰时间发生改变。Tyr-Glu-Gly出峰时间位于尿酸和黄嘌呤之间。
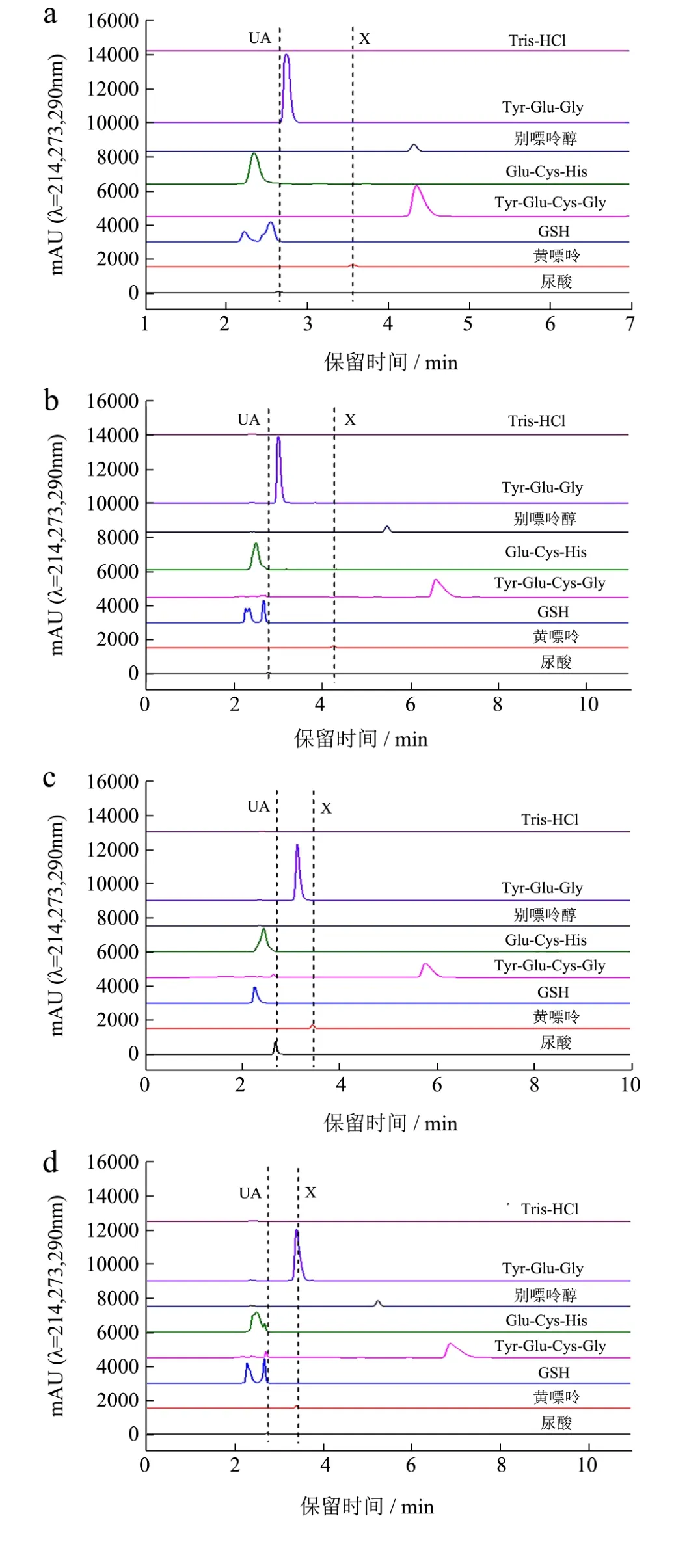
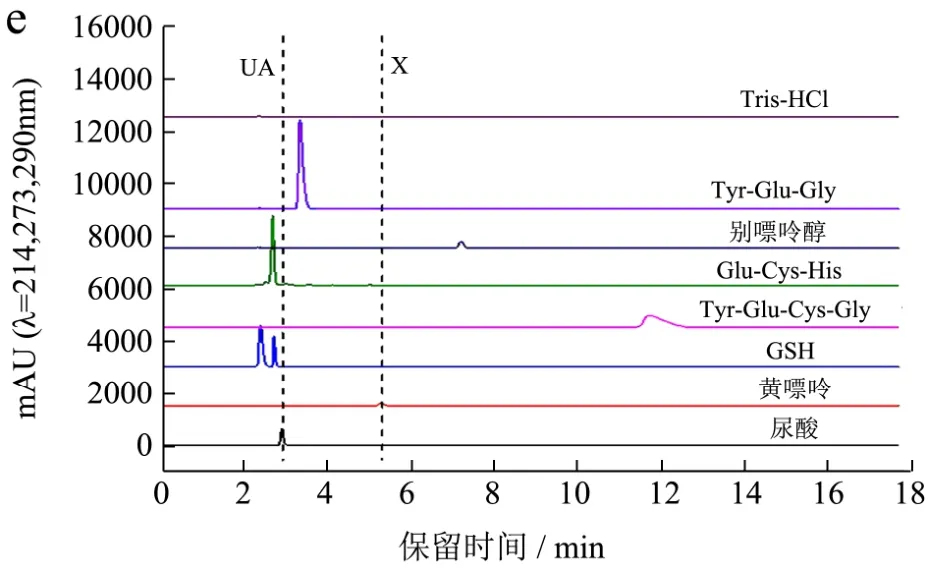
图3 流动相对单一样品的分离效果Fig.3 Separation of single sample by mobile phase
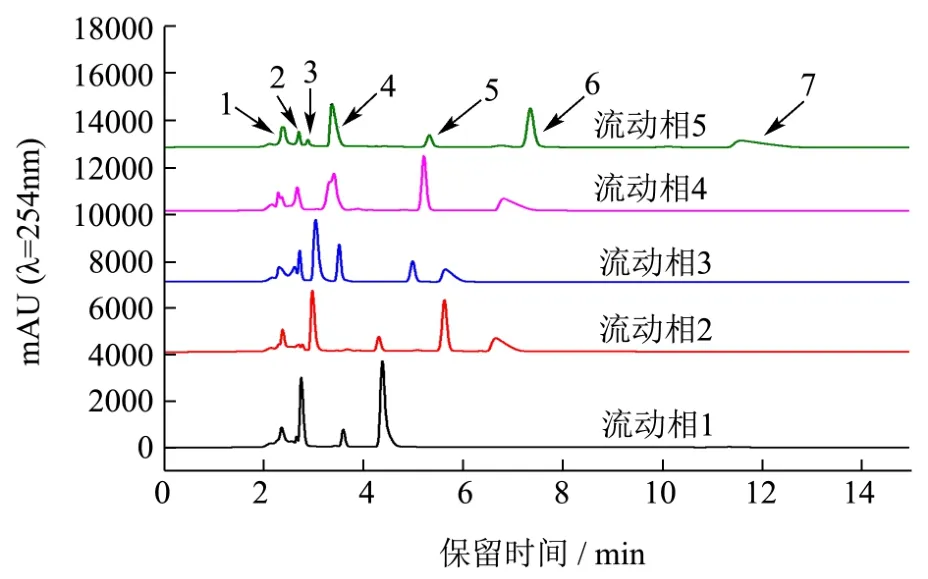
图4 不同流动相对混和样品溶液的分离效果Fig.4 Separation effects of different mobile phases on the mixed samples
图3a和图3b中Tyr-Glu-Gly的峰偏向于尿酸峰(pH 6.5),而图3c和图3d中Tyr-Glu-Gly的峰偏向于黄嘌呤峰(pH 7.5)。两种流动相条件 Glu-Cys-His的峰均与尿酸峰重叠。图 3e显示各物质出峰时间如下:Glu-Cys-His>GSH>尿酸>Tyr-Glu-Gly>黄嘌呤>别嘌呤醇>Tyr-Glu-Cys-Gly。出峰时间非常靠近。
混合样品在不同流动相的洗脱效果如图4。图3e和图4结果显示,(1)流动相5在流动相2的基础上减少了有机相甲醇的比例(5%),延长了整体出峰时间。(2)流动相5能够将样品中所有的物质分离出单峰,其出峰顺序如下:Glu-Cys-His>GSH>尿酸>Tyr-Glu-Gly>黄嘌呤>别嘌呤醇>Tyr-Glu-Cys-Gly,与预测出峰顺序基本吻合。(3)尿酸和黄嘌呤的峰均是单峰,且其分离度R=13.15>1.5,分离效果良好。
相比之下,图4中其他4种流动相均有多肽样品峰与尿酸峰重叠,干扰尿酸的检测,流动相5中更适合混合样品溶液的分离,因此选择流动相5作为后续实验的流动相。
2.2.2 HPLC法测定别嘌呤醇、非布司他及多肽的黄嘌呤氧化酶抑制活性

图5 反应液峰面积曲线Fig.5 Peak area curves of reaction solution of allopurinol (a),febuxostat (b), GSH (c) and GSSG (d)
别嘌呤醇和非布司他是目前临床上用于治疗痛风和高尿酸血症的药物[15,16]。别嘌呤醇和非布司他能够直接作用于黄嘌呤氧化酶的催化中心钼蝶岭位点,有效地抑制黄嘌呤氧化酶的活性。还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)是在实验中被证实具有良好的抑制黄嘌呤氧化酶的活性。
由图5结果显示,随着抑制剂别嘌呤醇、非布司他、GSH、Tyr-Glu-Gly浓度的增大,黄嘌呤氧化酶的产物尿酸含量不断减少,而底物黄嘌呤的含量不断增加,充分证实了黄嘌呤氧化酶的活性被抑制。相对于别嘌呤醇来说,非布司他对黄嘌呤氧化酶具有更强的抑制活性,实验结果与文献报道[17]一致,说明该液相条件对于黄嘌呤氧化酶抑制活性的检测具有较高的准确度。GSH和GSSG同样对黄嘌呤氧化酶存在一定的抑制活性,抑制机理有待进一步研究。
2.2.3 HPLC法与双酶偶联法精密度比较
本实验通过比较同一天、同一批样品的的相对标准偏差(RSD)来研究双酶偶联法和HPLC法的精密度。每个样品选取 5~6个浓度梯度,以抑制率区间10%~100%为指标,通过预实验确定最终样品浓度范围。
结果如表2所示,两种方法测定降尿酸药物别嘌呤醇和非布司他的抑制率时,结果无明显差异,RSD值均在 5%以下,都具有较高的精密度,其中双酶偶联法的RSD值在0.40%~1.46%之间,HPLC法的RSD值在0.55%~4.72%之间,表明双酶偶联法测定结果的一致性更好。
对于多肽GSH和GSSG黄嘌呤氧化酶抑制活性的测定结果,两种方法呈现较大的差异。两种方法对于GSSG的测定结果表现出一致性,同时其RSD值均在5%以下,都具有较高的精密度。而对于GSH抑制活性的测定,双酶法无法显示准确的结果,分析为由于GSH[18]具有较强的自由基清除活性,双酶偶联法中第二步酶反应的底物H2O2被GSH清除掉,无法形成红色络合物,导致实验结果不准确。
此设想经过进一步实验验证:直接将第一步酶反应的产物H2O2与GSH混合,再加显色液保温20 min,结果未形成红色络合物。两种方法测定 GSH抑制活性的结果差异说明:测定具有较强自由基清除能力物质的黄嘌呤氧化酶抑制活性时双酶偶联法检测失效,需要结合更有效的方法。而HPLC法检测其抑制活性时,抑制率随 GSH浓度的增大而升高,与别嘌呤醇和非布司他的变化规律一致,说明HPLC法对于多肽黄嘌呤氧化酶抑制活性的检测具有一定的可信度。经多次反复实验,HPLC法测定GSH抑制率的RSD值在0.21%~4.72%之间,具有较高的精密度。
双酶偶联法快速高效,可以同时测定大量的样品,但不适于具有较强超氧自由基清除能力的多肽的测定,而HPLC法测定一个样品需要8~15 min,测试时长,因此,在实际测定多肽类黄嘌呤氧化酶抑制活性的过程中,出于对效率和准确性的要求,需要双酶偶联法结合HPLC法。
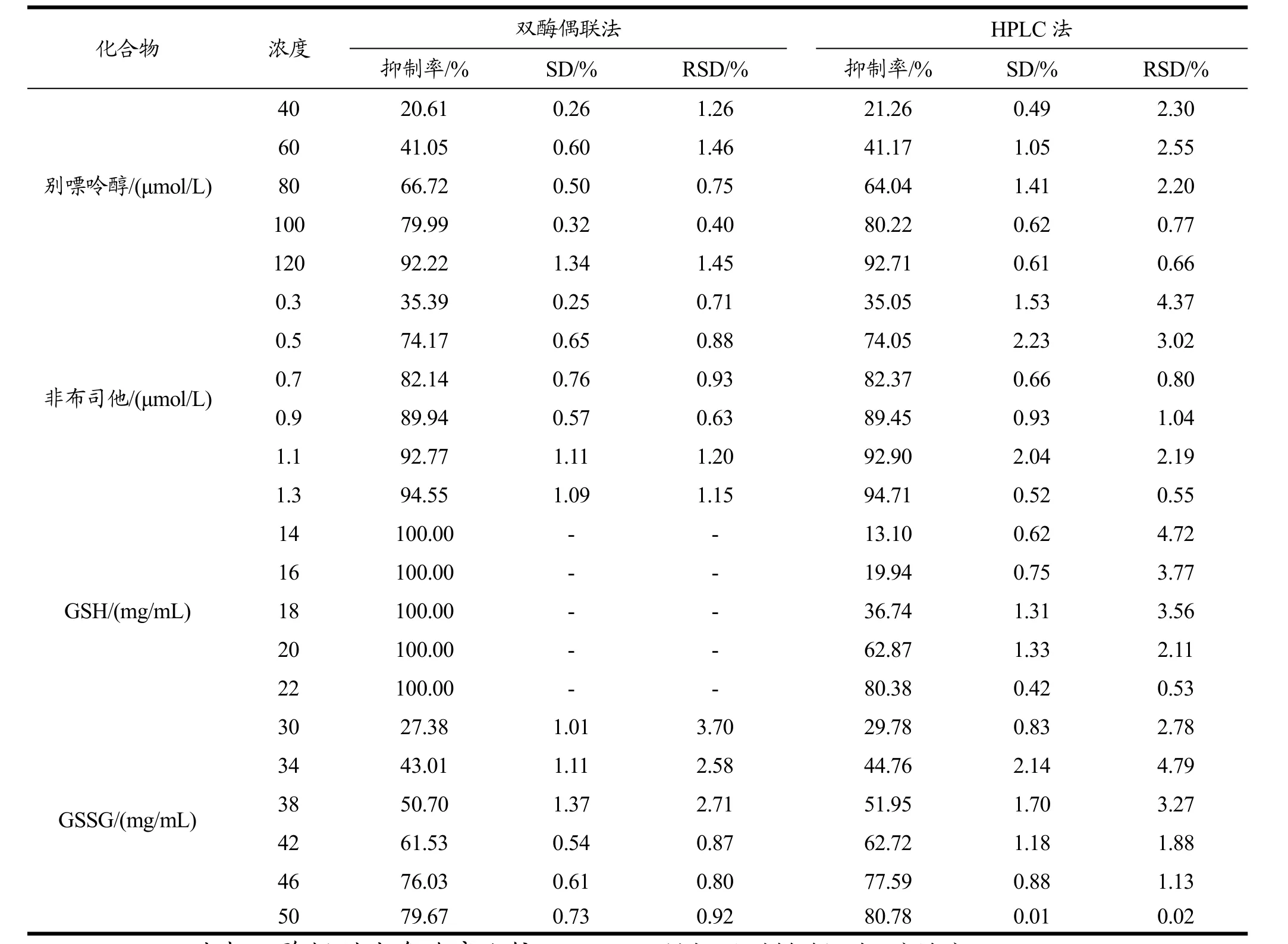
表2 HPLC法与双酶偶联法精密度比较Table 2 Precision comparison of the HPLC method and the double-enzyme coupling method
2.2.4 HPLC法与双酶偶联法准确度比较
方法的准确度是指用该方法测定的结果与真实值的接近程度,一般用加标回收率表示。双酶偶联法加标回收率实验设计如下:制备低、中、高浓度的黄嘌呤溶液,并测定其完全反应后的吸光值 A508,将 20µmol/L的标准H2O2加入到低、中、高浓度(40 µmol/L,120 µmol/L,200 µmol/L)的黄嘌呤溶液中,测定加标后的完全反应液的吸光值A508,每个浓度分别测定3次,计算加标回收率。HPLC法加标回收率实验设计如下:制备低、中、高浓度(40 µmol/L,120 µmol/L,200 µmol/L)的黄嘌呤溶液,并测定其完全反应后的尿酸含量,将20 µmol/L的标准尿酸加入到低、中、高浓度的黄嘌呤溶液中,测定加标后的完全反应液的尿酸含量,每个浓度分别测定3次,计算加标回收率。
由表3可知,双酶偶联法和HPLC法测定低、中、高浓度底物的加标回收率均在97%以上,接近100%,说明两种方法对于样品的测定均具有比较高的准确性。

表3 HPLC法与双酶偶联法准确度比较Table 3 Accuracy comparison of the HPLC method and the double-enzyme coupling method
3 结论
3.1 本文主要建立了多肽对黄嘌呤氧化酶抑制活性的检测方法。通过对反应体系条件优化后,双酶偶联法测定黄嘌呤氧化酶抑制活性的反应条件为:黄嘌呤浓度0.22 mmol/L,酶浓度0.52 u/mL,缓冲液pH 8.0,反应温度30 ℃,反应时间20 min。
3.2 通过优化流动相条件后,HPLC法测定黄嘌呤氧化酶抑制活性的条件为:流动相为 95% 15 mmol/L NH4H2PO4+5%甲醇,pH 6.5,流速 1 mL/min,柱温25 ℃,检测波长290 nm。双酶偶联法快速高效,可以同时测定大量的样品,24 h内检测稳定性良好,精密度检测RSD值低于HPLC,具有更高的精密度。但是双酶偶联法不适于具有较强超氧自由基清除能力的多肽的测定。而HPLC法可精确检测较强超氧自由基清除能力的多肽抑制XO活性,但测定一个样品需要8~15 min。
3.3 因此,在实际测定多肽类黄嘌呤氧化酶抑制活性的过程中,出于对效率和准确性的要求,建立双酶偶联法结合 HPLC法。本文建立了以双酶偶联法联合HPLC法体外测定多肽类化合物对XO抑制活性的检测方法,对比单酶法(常见的紫外分光光度法)等检测方法,具有较高的准确性和精密性,为多肽类物质XO体外抑制活性的检测提供了行之有效的检测工具。
[1]冯晓晶.嘌呤及其代谢产物尿酸检测方法研究和应用[D].太原:山西医科大学,2011 FENG Xiao-jing. Methods study for determination andapplication of purine and uric acid [D]. Taiyuan: Shanxi Medical University, 2011
[2]Nongonierma A B, Mooney C, Shields D C, et al. Inhibition of dipeptidyl peptidase IV and xanthine oxidase by amino acids and dipeptides [J]. Food Chemistry, 2013, 141(1):644-653
[3]Murota I, Taguchi S, Sato N, et al. Identification of antihyperuricemic peptides in the proteolytic digest of shark cartilage water extract using in vivo activity-guided fractionation [J]. Journal of Agricultural and Food Chemistry,2014, 62(11): 2392-2397
[4]Nongonierma A B, FitzGerald R J. Tryptophan-containing milk protein-derived dipeptides inhibit xanthine oxidase [J].Peptides, 2012, 37(2): 263-272
[5]Masuda T, Shingai Y, Takahashi C, et al. Identification of a potent xanthine oxidase inhibitor from oxidation of caffeic acid [J]. Free Radical Biology and Medicine, 2014, 69: 300-307
[6]Beedkar S D, Khobragade C N, Chobe S S, et al. Novel thiazolo-pyrazolyl derivatives as xanthine oxidase inhibitors and free radical scavengers [J]. International Journal of Biological Macromolecules, 2012, 50(4): 947-956
[7]Sreejith M, Kannappan N, Santhiagu A, et al. In vitro xanthine oxidase inhibitory and antioxidant activities of aerial parts of Flacourtia sepiaria Roxb [J]. Oriental Pharmacy and Experimental Medicine, 2013, 13(2): 113-120
[8]Nile S H, Park S W. Chromatographic analysis, antioxidant,anti-inflammatory, and xanthine oxidase inhibitory activities of ginger extracts and its reference compounds [J]. Industrial Crops and Products, 2015, 70: 238-244
[9]李忠琴,王武.酶偶联分光光度法测定胞内黄嘌呤氧化酶活性[J].化学与生物工程,2008,25(11):75-78 LI Zhong-qin, WANG Wu. Spectrophotometric assay of xanthine oxidase activity in cell extracts applying horseradish peroxidase [J]. Chemistry & Bioengineering, 2008, 25(11):75-78
[10]闻平.MTS/PMS比色法测定血清黄嘌呤氧化酶[J].陕西医学检验,2000,15(1):10-11 WEN Ping. Colormetric Assay of serum xanthine oxidase using the tetrazol ium salt MTS/PMS [J]. Shannxi Journal of Medical Laboratory Sciences, 2000, 15(1): 10-11
[11]Rashidinejad A, Birch E J, Everett D W. Green tea catechins suppress xanthine oxidase activity in dairy products: An improved HPLC analysis [J]. Journal of Food Composition and Analysis, 2016, 48: 120-127
[12]Honda S, Masuda T. Identification of pyrogallol in the ethyl acetate-soluble part of coffee as the main contributor to its xanthine oxidase inhibitory activity [J]. Journal of Agricultural and Food Chemistry, 2016, 64(41): 7743-7749
[13]Zhao M, Zhu D, Sun-Waterhouse D, et al. In vitro and in vivo studies on adlay-derived seed extracts: phenolic profiles,antioxidant activities, serum uric acid suppression, and xanthine oxidase inhibitory effects [J]. Journal of Agricultural and Food Chemistry, 2014, 62(31): 7771-7778
[14]Longjian Gu, Mouming Zhao, Wenzhi Li, et al. Chemical and cellular antioxidant activity of two novel peptides designed based on glutathione structure [J]. Food and Chemical Toxicology, 2012, 50(11): 4085-4091
[15]丁奇峰.非布司他片对比别嘌醇片降低痛风患者血尿酸水平的有效性和安全性临床研究[D].杭州:浙江大学,2016 DING Qi-feng. A comparison of the efficacy and safety of febuxostat and allopurinol in the treatment of patients with gout [D]. Hangzhou: Zhejiang University, 2016
[16]郑少玲,邓伟明,郭欣,等.非布司他与别嘌醇治疗痛风患者的疗效与安全性比较[J].临床医学工程,2015, 22(8):1069-1070 ZHENG Shao-ling, DENG Wei-ming, GUO Xin, et al. A comparison of the efficacy and safety of febuxostat and allopurinol in the treatment of patients with gout [J]. Cinical Medical and Engineering, 2015, 22(8): 1069-1070
[17]Nakamura T, Murase T, Nampei M, et al. Effects of topiroxostat and febuxostat on urinary albumin excretion and plasma xanthine oxidoreductase activity in db/db mice [J].European Journal of Pharmacology, 2016, 780: 224-231
[18]顾龙建.基于谷胱甘肽设计的抗氧化肽活性研究[D].广州:华南理工大学,2013 GU Long-jian. The activity study of anti-oxidant peptide designed on the basic of Glutathione [D]. Guangzhou: South China University of Technology, 2013
