肾血管性高血压大鼠血管和肾脏组织中RSA组分蛋白表达的性别差异性研究
2018-05-11邬利娅伊明凯萨尔力瓦依丁阿布来提阿布力孜阿迪力阿不都热合曼阿迪拉迪里夏提阿瓦古丽达吾提周文婷艾尼瓦尔吾买尔
邬利娅·伊明, 凯萨尔·力瓦依丁, 阿布来提·阿布力孜, 阿迪力·阿不都热合曼,阿迪拉·迪里夏提, 刘 丹, 阿瓦古丽·达吾提, 周文婷, 艾尼瓦尔·吾买尔
(1新疆医科大学药学院药理学教研室, 乌鲁木齐 830011; 2新疆维吾尔自治区维吾尔医医院, 乌鲁木齐 830049)
近年来,血压和心血管疾病调节的性别差异性问题逐渐受到了关注[1]。已有研究表明,女性平均血压水平明显低于同龄的男性[2],且具有较低的高血压及心血管系统疾病发展发展的风险。这种性别差异不仅见于人类,一些动物模型也显示血压的性别差异性[3-4]。提示性激素参与血压的调节及与心血管疾病的发生发展过程[5-6]。性激素参与心血管功能及血压调节的确切机制仍在研究中,但大量的研究结果表明,局部组织如主动脉及肾脏中肾素-紧张素系统(RAS)的激活参与了心血管系统疾病尤其是高血压的性别差异性[7]。
肾血管性高血压是由单侧或双侧肾动脉狭窄引起的肾实质缺血所致的高血压,二肾一夹(2K1C)肾血管性高血压大鼠是该疾病常用的动物模型[8-9],形成高血压的因素与其他动物模型相比,影响因素比较单一,即RAS的激活是该模型形成的关键病理生理学机制。早期血压的升高是因为肾素释放增加导致循环中血管紧张素Ⅱ(AngⅡ)生成增多,中晚期高血压状态的维持则是局部RAS的激活[10]。高血压发展到一定阶段会引起会引起靶器官损伤,尤其是动脉血管及肾脏。
本研究选用10周龄清洁级(SPF) SD大鼠制备2K1C肾血管性高血压模型,切除双侧卵巢造成雌激素水平低下,再制备2K1C肾血管性高血压模型,研究肾血管性高血压大鼠血管及肾脏组织中肾素血管紧张素系统(RAS)蛋白表达的性别差异性,以探讨局部RAS在高血压靶器官损伤中的作用。
1 材料与方法
1.1实验动物80只10周龄健康无特定病原级(SPF)SD大鼠,雌雄各半,体质量(200±20)g,购自新疆医科大学实验动物中心。实验在新疆医科大学实验动物中心SPF级实验室进行,手术后的大鼠常规喂养。SD大鼠的使用得到新疆医科大学实验动物中心的同意,所有的操作符合动物伦理学的管理准则。
1.2实验仪器与试剂大鼠血压监测仪(上海奥尔科特生物技术有限公司),三通管及四通管(法国Plastimed公司),血压换能器(复旦大学电子工程系PT14M),A/D采样板(中科院声学所科声公司),JA2003型电子天平(上海天平仪器厂),超高速低温离心机(Eppendorf公司),UV-2802紫外可见分光光度计(上海尤尼柯仪器有限公司),戊巴比妥钠购自Sigma公司,总蛋白抽提试剂盒和蛋白定量试剂盒购自上海天根生物有限公司, AT1抗体、AT2抗体、血管紧张素转化酶(ACE)抗体,ACE2抗体,均购自美国SantaCruz 公司。二抗HRP标记的抗兔、抗山羊、硝酸纤维素薄膜、免疫印迹增强化学发光试剂盒购自尚柏生物医学技术(北京)有限公司,其余与实验相关的生化试剂和耗材购自上海生工生物工程技术服务公司。
1.3实验方法
1.3.1 肾血管性高血压及雌激素低下模型的制作 取80只SD大鼠雌雄各半,随机分为雄性假手术组(2K1C-sham-M组)、雄性手术组(2K1C-M组)、雌性手术组(2K1C-F组)和雌性去势手术组(2K1C-VOX组),每组20只。所有实验动物适应性饲养一周后,腹腔注射3%戊巴比妥钠(45 mg/kg)麻醉,按文献[11]所述,分离右侧肾动脉并套以U型银夹(内径为0.25 mm),完成一侧肾动脉狭窄手术,缝合切口,假手术组所有的操作同手术组,分离肾动脉不套U型银夹。按文献[12]所述,40只雌性SD大鼠完成右侧肾动脉狭窄手术后,用镊子移开腹内组织,分离卵巢,结扎卵巢动脉及脂肪组织并切除双侧卵巢,逐层关腹缝合消毒切口,术后肌内注射青霉素(8万单位/只)。术后动物保温,清醒后每笼5只动物,置实验动物中心SPF级实验室常规喂养至实验结束。
1.3.2 大鼠血压的测定 大鼠用3%的戊巴比妥钠(45 mg/kg)腹腔注射麻醉,准确称重后,行股动脉插管,连接于大鼠血压监测系统,连续测定血压10 min,记录收缩压(SBP)和舒张压(DBP),高血压的成模标准为SBP>150 mmHg,麻醉状态下的成模标准为>135 mmHg[13],血压高于此标准入选,低者剔除。
1.3.3 胸主动脉与肾脏组织蛋白的提取及测定 经血压测定符合入选标准的大鼠,开胸及腹腔,迅速摘除胸主动脉及未狭窄的肾脏,用预冷的磷酸盐缓冲液(PBS)冲洗后置液氮速冻后储存于-80℃保存。准确称取50 mg胸主动脉组织及50 mg肾皮质组织,剪碎组织加入0.25 mL组织裂解液制备匀浆;组织匀浆液以4℃、12 000 g离心10 min,取上清液分装,用Bradford 法测定蛋白浓度,将样品置微量恒温加热器95℃变性10 min,冷却后-20℃冻存。
1.3.4 蛋白质印迹法(Western blot法)测定ACE1、ACE2、 AT1和AT2蛋白的表达 配制10%SDS-PAGE 分离胶及基层胶,每个样品(50 μg)及生物素结合的蛋白标准各10 μL加样电泳分离,转移到硝酸纤维素膜上。以封闭液(5%脱脂奶粉)室温封闭膜1 h,TBS/T缓冲液洗膜3次,以稀释后的一抗室温温孵过夜,ACE一抗的稀释浓度为1∶2 000,ACE2一抗的稀释浓度为1∶1 000,AT1一抗的稀释浓度为1∶1000,AT2一抗的稀释浓度为1∶500。TBS/T洗膜3次,用HRP(horseradish peroxidase)结合的二抗体在室温孵育膜1h,TBS/T洗膜3次。SuperSignal West Pico化学发光试剂盒中A、B两种试剂等比例混合为反应液;将膜置于此反应液中室温孵育5 min,以X光胶片曝光5~10 min,依次将胶片置显影液与定影液;蛋白质印迹荧光被检测并显示于X光胶片上。采用Imagetool凝胶图像分析软件对X胶片扫描分析,以每组目的蛋白表达的面积灰度值与β-actin表达的面积灰度值的比值而作为半定量分析值。
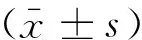
2 结果
2.1性别对2K1C大鼠血管组织中RAS蛋白表达的影响
2.1.1 对2K1C大鼠血管组织中ACE1和ACE2蛋白表达的影响 与2K1C-sham-M组比较,2K1C-M组和2K1C-F组血管组织中ACE1的蛋白表达升高(P<0.05);2K1C-OVX组血管组织中ACE1的蛋白表达低于2K1C-M组和2K1C-F组(P<0.05);与2K1C-M组比较,2K1C-F组血管组织中ACE1的蛋白表达升高(P<0.05)。与2K1C-sham-M组比较,2K1C-OVX组和2K1C-F组血管组织中ACE2蛋白表达升高(P<0.05),2K1C-M组血管组织中ACE2蛋白表达差异无统计学意义,见图1。
2.1.2 对2K1C大鼠血管组织中AT1和AT2受体蛋白表达的影响 与2K1C-sham-M组比较,各手术组胸主动脉血管组织中AT1受体的蛋白表达差异无统计学意义;与2K1C-M组比较,2K1C-F组和2K1C-OVX组血管组织中AT1受体的蛋白表达则减少(P<0.05)。与2K1C-sham-M组比较,各手术组胸主动脉血管组织中AT2受体的蛋白表增加(P<0.05),其中在2K1C-F组血管组织中AT2受体的蛋白表达增加最为明显,见图2。

注:1为2K1C-sham-M组; 2为2K1C-M组; 3为2K1C-OVX组; 4为2K1C-F组; 与2K1C-male-sham组比较,*P<0.05,**P<0.01;与2K1C-M组比较,#P<0.05,##P<0.01; 与2K1C-OVX组比较,◆◆P<0.01。
图12K1C大鼠胸主动脉组织中ACE1和ACE2的蛋白表达

注:1为2K1C-sham-M组; 2为2K1C-M组; 3为2K1C-OVX组; 4为2K1C-F组; 与2K1C-male-sham组比较,**P<0.01; 与2K1C-M组比较,#P<0.05,##P<0.01; 与2K1C-OVX组比较,◆◆P<0.01。
图22K1C大鼠主动脉组织中AT1和AT2受体的蛋白表达
2.2性别对2K1C大鼠肾脏组织中RAS蛋白表达的影响
2.2.1 对2K1C大鼠肾脏组织中ACE1和ACE2蛋白表达的影响 与2K1C-sham-M组比较,2K1C-F组肾组织中ACE1蛋白的表达则升高(P<0.05);各组肾组织中ACE2蛋白的表达差异无统计学意义,见图3。
2.2.2 对2K1C大鼠肾脏组织中AT1和AT2受体蛋白表达的影响 与2K1C-sham-M组比较,2K1C-F组肾组织中AT1受体的蛋白表达减少(P<0.05);2K1C-M组和2K1C-OVX组肾组织中AT2受体的蛋白表达差异无统计学意义,而2K1C-F组肾组织中AT2受体的蛋白表达则减少(P<0.05),见图4。
3 讨论
已有研究显示,2K1C大鼠因一侧肾动脉狭窄,肾血流量减少而引起肾入球小动脉的近球小球细胞释放肾素,肾素催化血浆中由肝细胞产生的血管紧张素原生成无活性的十肽血管紧张素Ⅰ(AngⅠ)[13],Ang Ⅰ随血液流经肺循环时,由存在于肺循环中内皮细胞表面的ACE[14]和局部组织中组织蛋白酶G、糜酶、糜蛋白酶抑制素敏感的血管紧张素Ⅱ(AngⅡ)生成酶等的作用下[15],在循环系统和局部组织中生成活性极强的八肽AngⅡ,导致RAS系统的激活。

注:1为2K1C-sham-M组; 2为2K1C-M组; 3为2K1C-OVX组; 4为2K1C-F组; 与2K1C-male-sham组比较,**P<0.01; 与2K1C-M组比较,##P<0.01; 与2K1C-OVX组比较,◆P<0.05。
图32K1C大鼠肾脏组织中ACE和ACE2的蛋白表达

注:1为2K1C-sham-M组; 2为2K1C-M组; 3为2K1C-OVX组; 4为2K1C-F组; 与2K1C-male-sham组比较,*P<0.05,**P<0.01; 与2K1C-M组比较,#P<0.05; 与2K1C-OVX组比较,◆P<0.05。
图42K1C大鼠肾脏组织中AT1和AT2的蛋白表达
RAS在血压调节和各种心血管系统疾病中发挥着重要的作用。随着细胞、分子生物学实验技术的发展与进步,人们发现除了经典的循环RAS外,还存在局部组织RAS[16-18],尤其是存在于心脏、血管、肾脏等最重要器官局部组织中[19]。局部产生的AngⅡ可通过自分泌、旁分泌等方式,在细胞生长、增生和代谢等方面发挥重要的作用[16]。
雌激素缺乏时会增加肾素和ACE的水平,并上调AT1受体表达[19],而这些效应可通过雌激素治疗而逆转[20-21]。雌激素可以激活肾素-血管紧张素系统(RAS),肾皮质AT1受体的蛋白和mRNA的表达增加,升高体循环中AngⅡ水平和肾脏内AngⅡ的活性,而引起肾血流量的减少引起心脏及肾脏损伤[22-24]。
本研究选用10周龄雌性和雄性的SD大鼠制备2K1C肾血管性高血压模型。为了进一步了解雌激素的作用,切除双侧卵巢造成雌激素水平低下,再行2K1C手术,常规喂养32 w后,测定血管及肾脏组织中肾素血管紧张素系统的蛋白表达。本研究结果表明:与2K1C-sham-M组比较,2K1C-M组和2K1C-F组主动脉血管组织中ACE的蛋白表达明显升高,提示可使AngⅡ的生成增多;2K1C-OVX组和2K1C-F组血管组织中ACE2蛋白表达明显升高,原因可能是ACE2与ACE1同源的羧胎酶,可将AngⅡ降解为Ang(1-7),Ang(1-7)作用于其受体而拮抗AngⅡ的作用,可扩张血管,抗血管平滑肌增殖等作用[25];与2K1C-M组比较,2K1C-F组和2K1C-OVX组血管组织中AT1受体则明显减少,各手术组胸主动脉血管组织中AT2受体的蛋白表明显增加,其中在2K1C-F组中升高作用最为明显。
本研究显示:与2K1C-sham-M组比较,2K1C-F组肾组织中ACE1蛋白的表达则明显升高;各组肾组织中ACE2蛋白的表达差异无统计学差异;2K1C-F组肾组织中AT1受体的蛋白表达明显减少;2K1C-M组和2K1C-OVX组肾组织中AT2受体的蛋白表达差异无统计学意义,而2K1C-F组肾组织中AT2受体的蛋白表达则明显减少。提示血管是过高血压损伤最为严重的器官之一,伤害性刺激增强时会激活集体的防御系统,故在动脉血压最高的2K1C-F组,在ACE1蛋白表达升高的同时ACE2和AT2受体的蛋白表达也明显增加。
综上所述,局部RAS系统的激活是导致高血压靶器官损伤的重要原因。雌性2K1C组大鼠的血管及肾脏组织中ACE蛋白表达明显高于雄性组,AT1受体蛋白表达明显低于于雄性组。
参考文献:
[1] MARANON R I, RECKELHOFF J F. Sex and gender differences in control of blood pressure[J]. Clin Sci (Lond),2013,125(7):311-318.
[2] YANES L L, RECKELHOFF J F. Postmenopausal hypertension[J]. Am J Hypertens,2011,24(7):740-749.
[3] HINOJOSA-LABORDE C, LANGE D L, HAYWOOD J R. Role of female sex hormones in the development and reversal of dahl hypertension[J]. Hypertension,2000,35(2):484-489.
[4] RECKELHOFF J F, ZHANG H, GRANGER J P. Testosterone exacerbates hypertension and reduces pressure-natriuresis in male spontaneously hypertensive rats[J]. Hypertension,1998,31(2):435-439.
[5] CADEDDU C, FRANCONI F, CASSISA L, et al. Arterial hypertension in the female world: pathophysiology and therapy[J]. J Cardiovasc Med,2016,17(4):229-236.
化学防治。防治灰霉病和早疫病,使用75%百菌清可湿性粉剂500倍液喷雾处理,或80%代森锰锌可湿性粉剂600倍液防治,降低番茄上病虫害发生程度,有效提高番茄产量和品质。茎基腐病预防,应该在番茄定植一周后使用68.75%左右的银法利,与1.5-2.0 kg左右的水充分混合搅拌,形成糊状后,使用毛笔将其涂抹在根茎上,间隔20天后再次涂抹,可以有效提升茎基腐病防治效果,将病害消灭在萌芽状态。
[6] JOYNER M J,WALLIN B G, CHARKOUDIAN N. Sex differences and blood pressure regulation in humans[J]. Exp physiol,2016,101(3):349-355.
[7] MARIC-BILKAN C, MANIGRASSO M B. Sex differences in hypertension: contribution of the renin-angiotensin system[J]. Gend Med,2012,9(4):287-291.
[8] GOLDBLATT H, LYNCH J, HANZAL R F, et al. Study on experimental hypertension: Production of persistent elevation of systolic pressure by means of renal ischemia [J]. J Exp Med,1934, 59(3):347-380.
[9] NAVAR L G I, ZOU L, VON THUN A, et al. Unraveling the Mystery of Goldblatt Hypertension[J]. News Physiol Sci,1998,13(8):170-176.
[10] MAIA R C A, SOUSA L E, SANTOS R A S, et al. Time-course effects of aerobic exercise training on cardiovascular and renal parameters in 2K1Crenovascular hypertensive rats[J]. Braz J med Biol Res,2015,48(11):1010-1022.
[11] 古孜力努尔·依马木, 邬利娅·伊明, 依巴代提·托合提, 等. 罗勒提取物对肾性高血压大鼠的影响[J]. 新疆医科大学学报,2009,32(3):259-264.
[12] 马虎, 阿迪力·阿不都热合曼, 秦浩, 等. 雌激素对肾血管性高血压大鼠心脏功能及氧化应激的影响[J]. 新疆医科大学学报, 2016, 39(4):441-448.
[13] YI-MING W, SHU H, MIAO C Y, et al. Asynchronism of the recovery of baroreflex sensitivity, blood pressure, and consciousness from anesthesia in rats[J]. J Cardiovasc Pharmacol,2004,43(1):1-7.
[14] HALL J E. Historical perspective of the renin-angiotensin system[J]. Mol Biotechnol,2003, 24:27-39.
[16] ARAKAWA K, URATA H. Hypothesis regarding the pathophysiological role of alternative pathways of angiotensin Ⅱ formation in atherosclerosis[J]. Hypertension,2000, 36(4):638-641.
[17] PAUL M, MEHR A P, KREVTZ R, et al. Physiology of local renin-angiotensin systems[J]. Physiol Rev,2006, 86(3):747-803.
[18] CRACKOWER M A, SARAO R, OUDIT G Y, et al. Angiotensin-converting enzyme 2 is an essential regulator of heart function[J]. Nature,2002, 417(6891):822-828.
[19] HALL J E. Historical perspective of the renin-angiotensin system[J]. Mol Biotechnol,2003, 24(1):27-39.
[20] LI L, YI-MING W, LI Z Z, et al. Local RAS and inflammatory factors are involved in cardiovascular hypertrophy in spontaneously hypertensive rats[J]. Pharmacol Res,2008,58(3/4):196-201.
[21] XU J W, IKEDA K, YAMORI Y. Genistein inhibits expressions of NADPH oxidase p22phox and angiotensin Ⅱ type 1 receptor in aortic endothelial cells from stroke-prone spontaneously hypertensive rats[J]. Hypertens Res,2004,27(9):675-683.
[22] GRAGASIN F S, XU Y, ARENAS I A, et al. Estrogen reduces angiotensin II-induced nitric oxide synthase and NAD(P)H oxidase expression in endothelial cells[J]. Arterioscler Thromb Vasc Biol,2003,23(1):38-44.
[23] SEELY E W, BROSNIHAN K B, JEUNEMAITRE X, et al. Effects of conjugated oestrogen and droloxifene on the renin-angiotensin system, blood pressure and renal blood flow in postmenopausal women[J]. Clinical Endocrinology,2004, 60(3):315-321.
[24] STIER C T J R, CHANDER P N, ROSENFELD L, et al. Estrogen promotes microvascular pathology in female stroke-prone spontaneously hypertensive rats[J]. Am J Physiol Endocrinol Metabol,2003,285(1):232-239.
[25] 袁永杰, 王安全. 肾素血管紧张素系统与高血压血管重构的研究进展[J]. 中国临床药理学, 2010, 15(4):477-480.
