丙种球蛋白联合亚低温对病毒性脑炎患儿血清sVCAM-1、MBP、PCT及神经功能的影响
2018-05-11,,,,
,,, ,
病毒性脑炎是临床上常见的中枢神经疾病,发病人群多为小儿,起病较急[1]。临床表现为头痛剧烈、呕吐、发热,且伴有全身不适、眩晕、畏光、咽痛,部分患儿还会出现视力模糊、咽峡炎等症状。临床表明,脑实质病原体感染是导致病毒性脑炎发生的主要因素[2],对于该病的治疗目前仍未有确切疗法,多以对症治疗、抗病毒及促进病毒代谢为主,但基础研究表明,病毒性脑炎的病情轻重缓急与治疗时间有密切的关系[3]。若未及时得到有效的治疗,可影响其生理机能及神经系统发育,临床症状进入中晚期后可对治疗疗效造成影响,容易遗留神经系统症状,不利于预后,严重可导致患儿死亡。因此,早期改善患儿病情有利于延缓疾病的进展。临床上常规治疗方法多为抗感染和对症治疗,虽可在一定程度上改善患儿的神经功能及临床症状,但达不到预期的效果。研究显示丙种球蛋白联合亚低温在病毒性脑炎中具有显著的疗效[4]。近年来,国内外学者研究发现,血清血管细胞黏附分子-1(sVCAM-1)、降钙素原(PCT)、髓磷脂碱性蛋白(MBP)在病毒性脑炎的发生、发展中发挥重要作用。因此,本研究探讨丙种球蛋白联合亚低温对病毒性脑炎患儿血清sVCAM-1、MBP、PCT及神经功能的影响。
1 资料与方法
1.1 一般资料 选取2015年3月—2016年3月汉川市人民医院收治的病毒性脑炎患儿80例,均符合病毒性脑炎诊断标准[5]:意识障碍、出现频繁抽搐,经病理学检查显示大脑实质受损,持续存在惊厥状态。纳入标准:肝肾功能正常者;无其他严重疾病;无免疫系统疾病;无生长发育异常;配合研究者。排除标准:先天性心脏病;颅脑病变;结核性脑膜炎;精神疾病;化脓性脑膜炎;家长中途不支持研究者。本研究家属及患儿均签署知情同意书,且经医院伦理委员会许可。随机分为两组,每组40例。对照组男21例,女19例;年龄4岁~15岁(7.36岁±3.10岁);病程2 d~10 d(3.27 d±2.63 d);病情程度:中度23例,重度17例。观察组男22例,女18例;年龄3岁~15岁(7.04岁±3.13岁);病程3 d~10 d(3.48 d±2.72 d);病情程度:中度24例,重度16例。两组性别、年龄、病程等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法 对照组给予退热、营养支持、抗病毒、维持水电解质平衡、免疫调节、保护神经功能等常规治疗,地塞米松(规格:0.2 mg/kg;生产厂家:广东三才石岐制药有限公司;批号:20141207),每次0.2 mg/kg,每天1次。观察组在常规治疗基础上给予丙种球蛋白联合亚低温治疗,采用HGT-200亚低温治疗仪(南京三德医疗器械有限公司)控制体温在33 ℃~35 ℃,连续治疗5 d,期间给予丙种球蛋白(规格:1.0 g/kg;生产厂家:四川蜀阳制药厂;批号:20141130)每次1.0 g/kg,每天1次。两组治疗疗程均为6个月。
1.3 检测指标 分别于治疗前后采集静脉血,离心分离血清后待检,采用双抗体夹心ELISA法检测sVCAM-1,试剂盒购自深圳晶美生物工程有限公司;采用酶联免疫吸附法检测PCT,试剂盒购自上海生物科技有限公司;采用免疫荧光法检测MBP,试剂盒购自上海华大基因科技有限公司。对病人心电图、肝肾功能、血尿常规等进行定期检测,并记录不良反应发生情况。
1.4 疗效评定标准 临床症状体征完全消失,肌力提升2个等级以上为治愈;临床症状体征有所改善,肌力有所提升为有效[6];临床症状体征及肌力无变化为无效。

2 结 果
2.1 两组体征恢复时间比较 观察组体温恢复、惊厥消失、肢体功能恢复、昏迷至清醒时间显著短于对照组(P<0.05)。详见表1。

表1 两组体征恢复时间比较(±s) d
2.2 两组血清sVCAM-1、MBP、PCT水平比较 两组治疗前血清sVCAM-1、MBP、PCT水平比较差异无统计学意义(P>0.05);治疗后,两组sVCAM-1、MBP、PCT水平均显著降低,且观察组降低程度更显著(P<0.05)。详见表2。

表2 两组血清sVCAM-1、MBP、PCT水平比较(±s)
2.3 两组不良反应发生率比较 观察组不良反应发生率为5.00%,对照组不良反应发生率为27.50%,观察组不良反应发生率显著低于对照组(P<0.05)。详见表3。
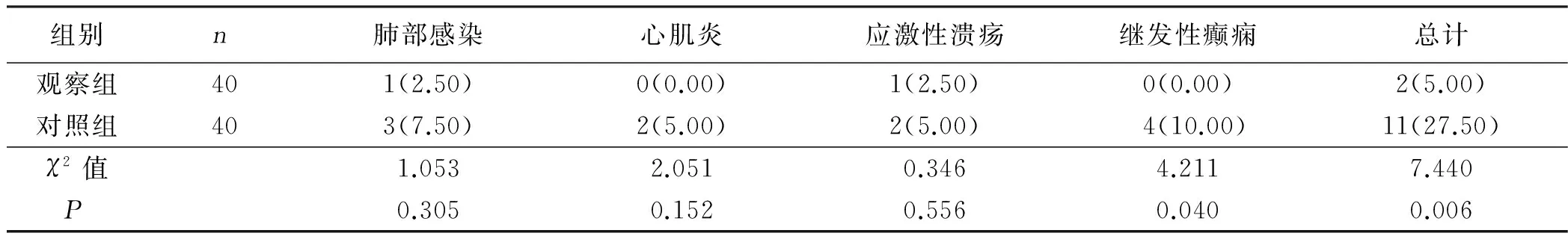
表3 两组不良反应发生率比较 例(%)
2.4 两组临床疗效比较(见表4)
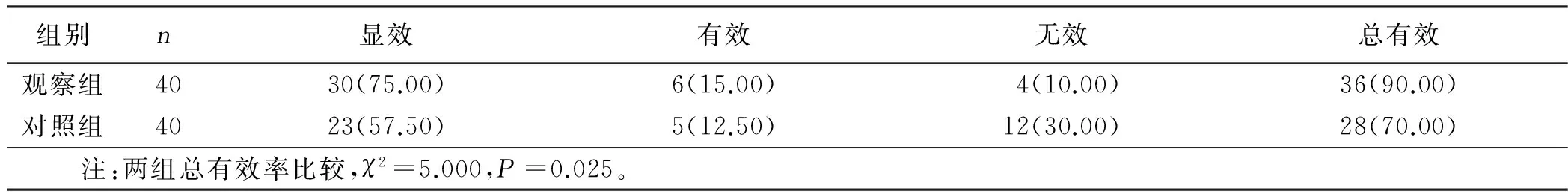
表4 两组临床疗效比较 例(%)
3 讨 论
脑组织器质性受损机制可分为直接损害和间接损害,直接损害是由病毒释放大量毒素,从而影响脑组织及细胞;间接损害是由病毒将颅内免疫应答反应进行激活,与抗病毒组织对抗,若病毒未得到控制,可释放大量炎性细胞对脑组织进行损害[7]。Nosadini等[8]研究表明,间接损害的预后情况更差,可出现一系列严重的不良反应。据统计,病毒性脑炎死亡率为20%左右,且随着时间的变化,病情的加重,病毒性脑炎死亡率也越来越高[9]。因此,及时诊断和积极治疗病毒性脑炎具有非常重要的意义。本研究显示,两组患儿采用常规治疗后临床症状及神经功能得到改善,但效果不显著。
丙种球蛋白是一种常见的免疫球蛋白,其治疗病毒性脑炎的机制还尚不明确,可能与以下因素有关:丙种球蛋白能够迅速提高患儿机体内的免疫抗体,可与病毒直接作用,且不会对主动抗体造成干扰或抑制;具有增强免疫功能作用,可减轻病毒对机体造成的损害[10]。丙种球蛋白可抑制惊厥,减少感染合并症,能够阻断对神经细胞损伤,抑制炎性细胞的释放,有利于脑细胞保护,从而改善脑功能[11]。亚低温联合药物治疗是目前临床公认的治疗病毒性脑炎的有效方法,亚低温是一种物理方法,可降低患儿体温,使其保持在30 ℃~35 ℃[12]。其作用机制为:低温能够有效地改善患儿的细胞能量代谢,使脑内氧及葡萄糖代谢率降低,从而减少氧自由基生成,保护神经元细胞[13]。目前亚低温已广泛应用于脑部炎症性损伤疾病,且效果显著。本研究结果显示,治疗后丙种球蛋白联合亚低温治疗患儿临床体征恢复时间以及总有效率显著优于采用常规治疗患儿。提示丙种球蛋白联合亚低温能够有效缓解患儿的临床症状,显著提高治疗疗效。观察组治疗期间不良反应发生率显著低于对照组。说明丙种球蛋白联合亚低温能够有效减少不良反应发生,这可能与亚低温可抑制炎性因子的释放,抑制神经细胞凋亡,减少对脑细胞损伤有关。
国内外研究表明,脑组织是人体重要的中枢神经器官,血脑屏障系统可使病菌无法侵袭,但若血脑屏障的通透性出现异常,病毒则可透过血脑屏障对脑组织、细胞等造成损害,导致严重并发症[14]。若要改变血脑屏障的通透性,则需损害血管内皮细胞或胶质蛋白。
基础研究表明,病毒性脑炎患儿血清sVCAM-1、MBP、PCT水平显著高于正常儿童[15]。sVCAM-1主要在血管内皮细胞表达,在正常情况下是以低水平表达,但炎症反应可促进其大量表达,从而使白细胞与内皮细胞结合,促使T淋巴细胞游走至炎性组织,同时还可释放大量的氧自由基,对血管内皮造成损伤,可将其作为诊断内皮细胞损伤的指标[16]。以往研究表明,sVCAM-1可促进炎症因子表达,对病情的发展起促进作用[17]。sVCAM-1与中枢神经系统感染存在密切的关系,参与了破坏脑组织损伤的过程。MBP由膜蛋白组成,是中枢神经髓鞘膜中的重要成分,当受到病毒感染后,可导致髓鞘细胞受损,MBP水平可异常升高,随着病情的变化其含量也升高[18]。以往研究也发现,MBP与病情的发展成正比,可将其作为判断脑神经元损害的指标[19]。PCT是病毒感染的敏感因子,在正常情况下其含量较低,当受到感染时,适量的含量可刺激免疫蛋白发挥抗感染作用,但过量表达时,则可形成炎性反应,对机体造成损伤[20]。本研究结果显示,治疗后观察组患儿血清sVCAM-1、MBP、PCT水平显著低于对照组。提示丙种球蛋白联合亚低温能够降低sVCAM-1、MBP、PCT的表达。
综上所述,丙种球蛋白联合亚低温治疗病毒性脑炎疗效显著,能够有效缓解临床症状,缓解病情,可显著降低血清sVCAM-1、MBP、PCT的表达,保护神经元细胞,促进神经功能恢复,抑制炎性因子表达,减少并发症。
参考文献:
[1] 王团美,查文婷.丙种球蛋白联合阿昔洛韦/更昔洛韦治疗小儿病毒性脑炎的meta分析[J].中南药学,2015,13(1):99-102.
[2] Lind L,Studahl M,Persson Berg L,et al.CXCL11 production in cerebrospinal fluid distinguishes herpes simplex meningitis from herpes simplex encephalitis[J].J Neuroinflammation,2017,14(1): 134.
[3] 余诗倩,姚宝珍,庹虎,等.丙种球蛋白对重症病毒性脑炎疗效的Meta分析[J].武汉大学学报(医学版),2015,36(2):321-324.
[4] Huang L,Yu D,Luo R,et al.Risk factors and prognosis of secondary epilepsy in children with viral encephalitis[J].Journal of Sichuan University(Medical Science Edition),2017,48(2):257-262.
[5] 刘林波,宋金霞,陈宗波.小儿病毒性脑炎诊治现状[J].实用医药杂志,2016,33(2):185-187.
[6] Taskin BD,Tanji K,Feldstein NA,et al.Epilepsy surgery for epileptic encephalopathy as a sequela of herpes simplex encephalitis: case report[J].J Neurosurg Pediatr,2017,20(1): 56-63.
[7] 林涛.丙种球蛋白及干扰素治疗手足口病合并病毒性脑炎临床疗效观察[J].中国全科医学,2013,16(3):323-325.
[8] Nosadini M,Mohammad SS,Corazza F,et al.Herpes simplex virus-induced anti-N-methyl-d-aspartate receptor encephalitis: a systematic literature review with analysis of 43 cases[J].Dev Med Child Neurol,2017,59(8): 796-805.
[9] 侯燕.病毒性脑膜炎患儿血清及脑脊液PCT、VEGF、S100B蛋白、NSE、MMP及CGRP变化研究[J].海南医学院学报,2013,19(3):300-303.
[10] Sironi M,Peri AM,Cagliani R,et al.TLR3 mutations in adult patients with herpes simplex virus and varicella-zoster virus encephalitis[J].J Infect Dis,2017,215(9):1430-1434.
[11] 朱明.甲基泼尼松与丙种球蛋白对病毒性脑炎儿童神经及免疫影响[J].海南医学院学报,2013,19(6):839-841.
[12] Zhang Y,Wang Y,Chen S,et al.Expression of human cytomegalovirus components in the brain tissues of patients with Rasmussen’s encephalitis[J].Virol Sin,2017,32(2):115-121.
[13] 吴春梅.纳洛酮联合丙种球蛋白治疗小儿重症病毒性脑炎患儿的临床疗效及安全性[J].中国民康医学,2017,29(5):40;66.
[14] Deng M,Du G,Zhao J,et al.miR-146a negatively regulates the induction of proinflammatory cytokines in response to Japanese encephalitis virus infection in microglial cells[J].Arch Virol,2017,162(6): 1495-1505.
[15] 杨晓碧,李莉,郭如丽.血清神经功能指标及心肌酶谱在病毒性脑炎患儿中的变化研究[J].实用临床医药杂志,2016,20(15):76-78.
[16] Zhang XH,Zhang JM,Han W,et al.Viral encephalitis after haplo-identical hematopoietic stem cell transplantation:causative viral spectrum,characteristics,and risk factors[J].Eur J Haematol,2017,98(5): 450-458.
[17] 熊峰.亚低温联合咪达唑仑对重症病毒性脑炎疗效及NSE水平的影响[J].深圳中西医结合杂志,2017,27(2):14-16.
[18] Rocheleau JP,Arsenault J,Ogden NH,et al.Characterizing areas of potential human exposure to eastern equine encephalitis virus using serological and clinical data from horses[J].Epidemiol Infect,2017,145(4): 667-677.
[19] 殷卫兵,严鸣光.病毒性脑炎患儿脑脊液和血清中NSE、MBP和S-100的变化及临床意义[J].中国卫生检验杂志,2015,25(22):3899-3902.
[20] Menasria R,Canivet C,Piret J,et al.Protective role of CX3CR1 signalling in resident cells of the central nervous system during experimental herpes simplex virus encephalitis[J].J Gen Virol,2017,98(3): 447-460.
