抗TNF-α药物对炎性肠病患者营养状况和膳食摄入量的影响
2018-05-10宋慧东黄素军聂丽芬张彩虹
宋慧东,黄素军,聂丽芬,张彩虹
(1.暨南大学医学院附属广州红十字会医院 消化内科,广东 广州 510220;2.深圳市人民医院 消化内科,广东 深圳 518067)
炎性肠病(inflammatory bowel disease,IBD)是自身免疫引起的消化道慢性炎症疾病,主要包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD),目前该病病因仍不明确,但据报道其发病和多种细胞因子相关[1]。肿瘤坏死因子α(tumor necrosis factor α,TNF-α)是目前研究最为广泛的IBD相关细胞因子,对调节体内营养平衡有至关重要的作用。和健康人相比,炎性肠病患者肠壁、血液和大便内TNF-α水平升高[2]。TNF-α信号通路的阻断可作为炎性肠病的治疗靶点,其抑制剂如英夫利昔单抗和阿达木单抗已被证实对CD和UC治疗有效。IBD患者极易发生营养不良,主要表现为肌肉减少,严重影响患者的生活质量[3-4]。TNF-α能激活NF-κB,对代谢途径起重要的调节作用;其抑制剂可阻止NF-κB激活[5],从而影响患者的营养状况和身体组分。但目前关于TNF-α抑制剂对患者营养状况的研究少见报道。因此笔者设计了本实验,利用生物电阻抗分析法测量患者身体组分,评价抗TNF-α药物治疗对炎性肠病患者的营养状况和膳食摄入量的影响。
1 资料与方法
1.1 研究对象
本研究经广州市红十字会医院和深圳市人民医院伦理委员会批准同意,所有患者均签署纸质版知情同意书。纳入标准:①经Lennard-Jones标准确诊为IBD;②病情为中重度,即经消化道内镜检查,UC的活动度Mayo评分≥2分[6],CD活跃指数>250或肛周疾病活动指数>6;③入组前12周内一直坚持采用联合药物治疗(5-氨基水杨酸制剂+免疫调节药物)。排除标准:①1年内曾接受过抗TNF治疗或者其他细胞因子治疗;②对研究药物过敏;③合并内分泌或代谢疾病;④合并恶性肿瘤;⑤妊娠期患者;⑥生物电阻抗法测量禁忌者,例如装有植入式除颤或心脏起搏器;⑦合并精神疾病,依从性差。
选取2013年10月-2014年10月广州红十字会医院和深圳市人民医院收治40例采用抗TNF-α治疗的IBD患者,其中CD 33例,UC 7例。24例患者接受阿达木单抗治疗(德国Vetter Pharma-Fertigung GmbH&Co.KG公司,S20130115),具体用量为初始160 mg,第2周80 mg,之后每周40 mg,共12周;16例患者接受英夫利昔单抗治疗(瑞士Cilag AG公司,S20120012),具体用量为初始、第2周、第6周5 mg/kg,随后每8周5 mg/kg,共12周。
1.2 身体成分分析
采用720 INBody人体成分分析仪对身体成分进行生物电阻抗分析,接受生物治疗前测试1次,治疗3个月后再次测试。检测时患者需空腹,排尿并脱下内衣,摘掉身上所有的饰品和手表。为了最大限度减小测量误差,所有检测由同一专业人员完成和并在同一设备下进行。720 INBody人体成分分析仪在5、20、250、500和1 000 kHz下分别测量身体5个部位(四肢和躯干)的复阻抗特性[7]。测试中身体成分参数会自动被记录,即体重、体重指数(body mass index,BMI)、去脂体重指数(fat free mass index,FFMI)、脂肪体重指数(body fat mass index,BFMI)、体脂百分含量、内脏脂肪面积、骨骼肌质量指数(skeletal mass index,SMI)和体细胞质量。
1.3 营养评估
采用Nutricomp DietCad®软件计算平均营养摄入量,该软件会根据代入数值自动计算出能量(kcal),主要营养成分(蛋白质,碳水化合物,脂肪,纤维摄入)以及矿物质、微量元素和维生素的消耗量,同时还可以计算出主要营养素的摄入量,并能依据体重(克/千克)进行营养评估。
1.4 统计学方法
采用SPSS18.0软件进行数据分析,根据抗TNF-α治疗药物、疾病类型和初始疾病活跃程度进行分组分析。正态性检验采用Shapiro-Wilk法。正态分布数据采用均数±标准差(±s)表示,组间比较采取独立样本t检验或方差分析,对服从正态分布的配对样本采用配对t检验,对非正态分布的数据采用Q(P25,P75)表示,采用Wilcoxon秩和检验。计数资料采用频数(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
入组患者年龄18~50岁,平均(33.4±12.9)岁;男性24例,女性16例;病程12~150个月,平均(93.5±9.8)个月。所有患者入组前12周一直采用5-氨基水杨酸抗炎治疗,平均日用药量为(1 987.6±1 665.9)mg,25例患者联用硫唑嘌呤(2.30±0.98)mg/kg,15例患者联用类固醇(0.42±0.32)mg/kg。CD和UC的类型、病变部位及疾病活跃程度见表1。
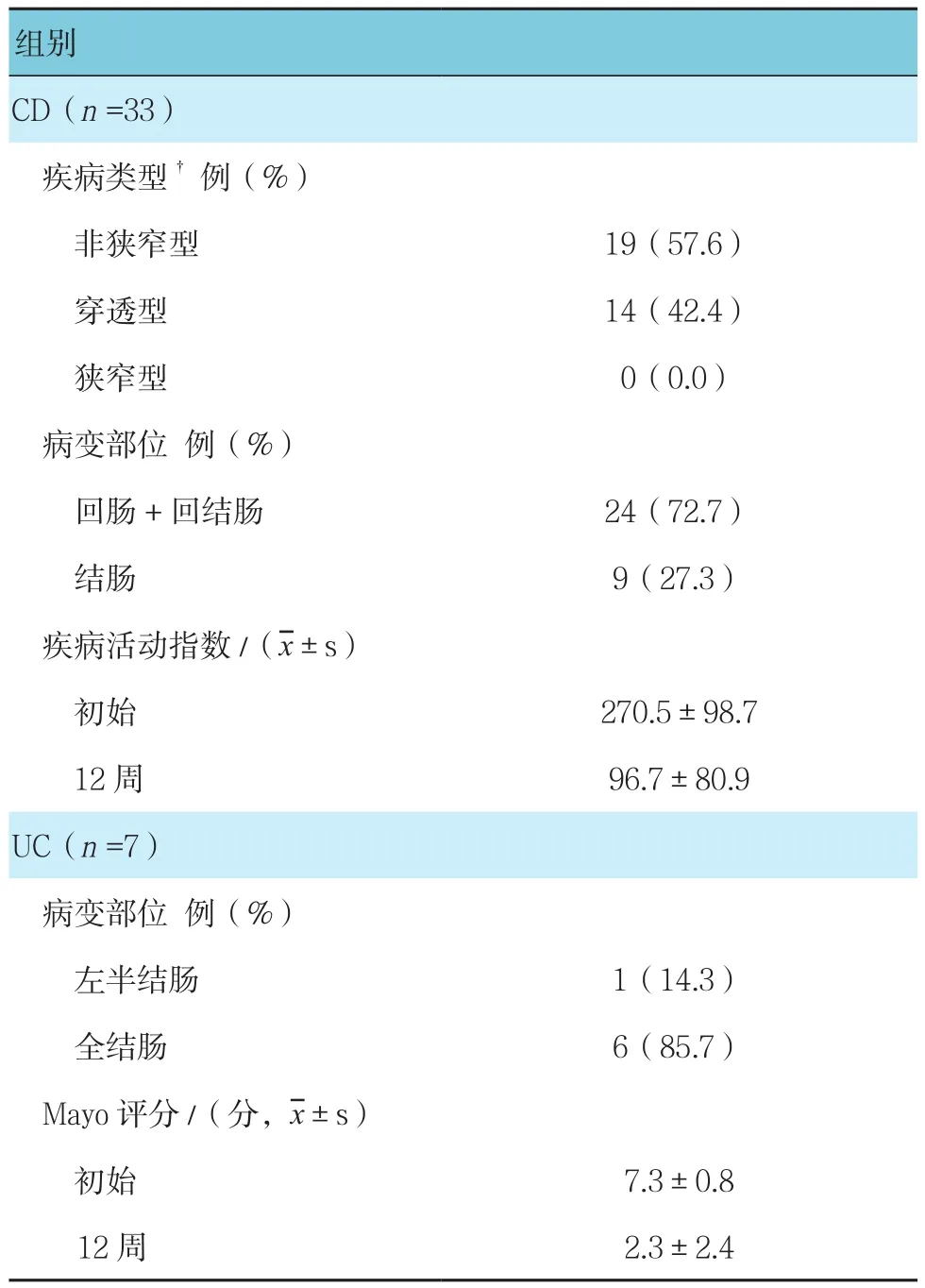
表1 疾病类型、病变部位及活跃程度比较
2.2 治疗前后身体成分比较
研究发现,治疗后患者体重、BMI、FFMI、SMI、体细胞质量与治疗前比较,差异有统计学意义(P<0.05),治疗后均增加,而BFMI、体脂百分含量、内脏脂肪面积与治疗前比较,差异无统计学意义(P>0.05)。见表2。
2.3 抗TNF-α药物分组比较
阿达木单抗与英夫利昔单抗治疗对IBD患者的身体成分变化未见差异,即两组间体重变化值、BMI变化值、FFMI变化值、SMI变化值、BFMI变化值、体脂百分含量变化值和内脏脂肪面积变化值比较,差异无统计学意义(P>0.05)。见表3。
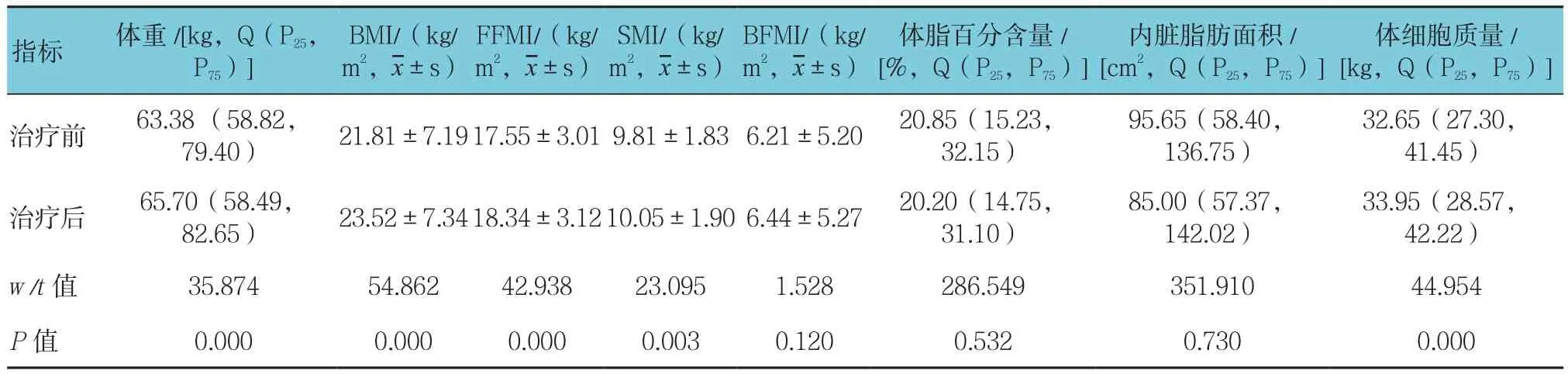
表2 治疗前后主要人体成分参数比较
2.4 治疗前后营养摄入比较
治疗后患者能量摄入和主要营养物质(蛋白质、碳水化合物、脂肪)摄入量与治疗前比较,差异有统计学意义(P<0.05),治疗后均明显增加,然而摄入营养物质的供能比比较,差异无统计学意义(P>0.05)。见表4。
表3 不同抗TNF-α药物对身体成分影响比较 (±s)

表3 不同抗TNF-α药物对身体成分影响比较 (±s)
注:变化值指的是从初始到12周的变化
组别 体重变化值/(kg)BMI变化值/(kg/m2 )FFMI变化值/(kg/m2)SMI变化值/(kg/m2)BFMI变化值/(kg/m2)体脂百分含量变化值/%内脏脂肪面积变化值 /(cm2)阿达木单抗(n =24) 2.4±3.2 0.79±1.08 0.54±0.12 0..32±0.50 0.23±0.15 0.3±2.8 -5.0±18.0英夫利昔单抗(n =16) 1.7±2.7 0.59±0.89 0.43±0.19 0.11±0.42 0.21±0.09 0.4±3.9 2.7±51.0 t值 1.738 1.854 1.899 1.901 0.923 1.287 1.56 P值 0.376 0.259 0.097 0.085 0.764 0.438 0.251
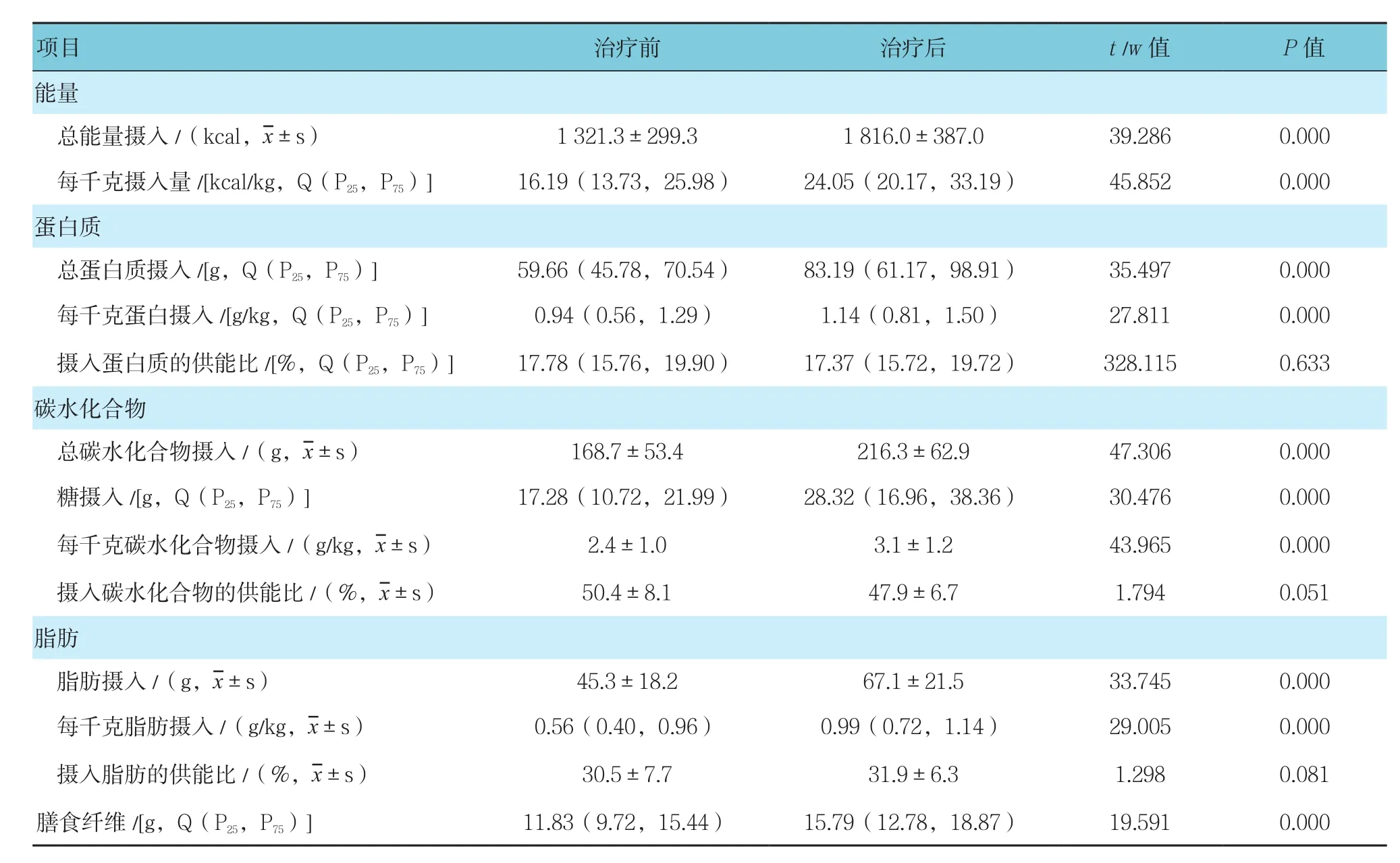
表4 治疗前后营养摄入分析
3 讨论
由于饮食摄入减少、肠道丢失等原因,营养不良是IBD的常见并发症之一,严重影响患者生活质量及预后[8-9]。因此,对于IBD患者的营养状况应给予高度重视。但是目前IBD患者营养状况和身体成分相关的研究少见报道,本文利用生物电阻抗法对IBD患者接受抗TNF-α药物治疗前后、不同药物治疗组之间、不同疾病类型及疾病初始活跃程度之间的身体成分、营养状态和营养摄入情况进行分析。结果发现在抗TNF-α药物治疗后,IBD患者营养状况有明显改善,患者体重、BMI、FFMI、SMI、体细胞质量均明显增加,而体脂相关参数如BFMI、体脂百分含量、内脏脂肪面积则无明显变化。这些身体成分指数表明患者接受抗TNF-α药物治疗期间,肌肉含量相对增加,而脂肪参数并无明显改善,说明身体成分发生有利变化。
目前针对不同抗TNF-α药物对IBD患者身体成分影响的比较尚缺乏足够的关注,仅有部分研究报道英夫利昔单抗或阿达木单抗对IBD患者营养指标或饮食状况的影响[10-11]。例如,WIESE等[12]研究7例CD患者经6个月英夫利昔单抗治疗的情况,发现治疗后患者炎症和营养指标都有所改善,但并未深入研究身体成分的具体变化,即体重增加是由于脂肪增加还是肌肉增加。SUBRAMANIAM等[13]利用MRI检测接受英夫利昔单抗治疗的患者肌肉体积变化,结果发现治疗25周后,患者的肌肉量明显增加,尤其是功能肌肉,其发现与本研究结果类似,但不同的是,其研究发现患者的饮食摄入量基本维持稳定,而本研究却发现患者饮食摄入量明显增加。
关于患者的饮食摄入量,本研究发现初始摄入的能量、脂肪、碳水化合物低于健康人均水平,经抗TNF-α治疗后能量摄入和主要营养物质(蛋白质、碳水化合物、脂肪)摄入量较治疗前都明显增加,但摄入营养物质的供能比并无明显变化,这使得临床医生意识到IBD患者个性化的膳食咨询的重要性和必要性。
关于抗TNF-α药物改善身体营养状况、增加饮食摄入量的原因,笔者考虑是以下三方面综合作用的结果。首先,TNF-α抑制剂本身可阻止炎症细胞因子诱导的脂肪和蛋白质水解来改善营养状况[14];其次TNF-α抑制剂具有黏膜愈合作用,从而改善肠道的营养吸收和利用[15];再次,药物治疗后,疾病活动度下降,患者身体活动度和食欲均改善,从而增加饮食摄入量[16]。
本研究存在一定的局限性,首先样本量较小,研究周期较短;其次虽然生物电阻抗法相对廉价,易于操作,且无电离辐射,但该方法目前缺少标准化操作指南,易造成测量误差。为获得更为精确的实验结果,未来需扩大样本量,开展随机对照实验,延长研究周期,并规范化测量方法。
总之,抗TNF-α药物治疗可明显增加IBD患者的体重及肌肉相关指数,而不增加脂肪参数,使患者身体发生有利变化,增加患者饮食摄入量,改善其营养状态。因此抗TNF-α药物治疗IBD值得临床推广。另外本研究发现英夫利昔单抗或阿达木单抗疗法对身体组分的影响差异无统计学意义。
参 考 文 献:
[1] 樊星, 翁谢川, 丁日高. 细胞因子在炎症性肠病中作用机制的研究进展[J]. 国际免疫学杂志, 2012, 35(6): 422-425.
[2] REGUIAÏ D Z, GRANGE F. The Role of Anti-Tumor Necrosis Factor-α therapy in pyoderma gangrenosum associated with inflammatory bowel disease[J]. American Journal of Clinical Dermatology, 2007, 8(2): 67-77.
[3] BARRET M, ANTOUN S, DALBAN C, et al. Sarcopenia is linked to treatment toxicity in patients with metastatic colorectal cancer[J]. Nutrition & Cancer, 2014, 66(4): 583-589.
[4] COUSIN S, HOLLEBECQUE A, KOSCIELNY S, et al. Low skeletal muscle is associated with toxicity in patients included in phase I trials[J]. Investigational New Drugs, 2014, 32(2): 382-387.
[5] GAGNIERE C, BEAUGERIE L, PARIENTE B, et al. Benefit of infliximab reintroduction after successive failure of infliximab and adalimumab in Crohn’s disease[J]. Journal of Crohn S & Colitis,2014, 146(4): S-456.
[6] DIGNASS A, ELIAKIM R, MAGRO F, et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 1: definitions and diagnosis (Spanish version)[J].Revista De Gastroenterologia De Mexico, 2014, 79(4): 140-151.
[7] GOLOGANU D, IONITA D, STANESCU C, et al. Changes over time in body composition assessed by segmental bioelectrical impedance analysis in COPD patients[J]. European Respiratory Journal, 2015, 46: 3068.
[8] 李艳龙. 炎症性肠病营养不良的原因与膳食治疗[J]. 河北中医,2012, 34(8): 1268-1269.
[9] 叶泉忠, 王莉娟, 程瑾. 50例炎症性肠病患者营养状况分析[J].现代实用医学, 2014, 26(7): 799-800.
[10] 周有连, 陈烨. 英夫利昔单抗治疗炎症性肠病的疗效及影响因素分析[J]. 南方医科大学学报, 2013, (12): 13-14.
[11] 夏冰清, 向城, 杨画, 等. 英夫利昔单抗对炎症性肠病患者黏膜愈合疗效的Meta分析[J]. 现代消化及介入诊疗, 2015, (5):474-481.
[12] WIESE D, LASHNER B D. Measurement of nutrition status in Crohn’s disease patients receiving infliximab therapy[J]. Nutrition in Clinical Practice Official Publication of the American Society for Parenteral & Enteral Nutrition, 2008, 23(5): 551-556.
[13] SUBRAMANIAM K, FALLON K, RUUT T, et al. Infliximab reverses inflammatory muscle wasting (sarcopenia) in Crohn’s disease[J]. Alimentary Pharmacology & Therapeutics, 2015,41(5): 419-428.
[14] 方杰. 以TNF-α为靶点治疗炎症性肠病的研究进展[D]. 安徽:蚌埠医学院, 2014.
[15] 唐齐林, 周国华, 王为. TNF-α、IL-6在炎症性肠病发病机制中的研究进展[J]. 医学综述, 2014, 20(7): 1174-1176.
[16] GUIDI L, FELICE C, PROCOLI A, et al. S1703 Tregs(FOXP3+CD4+) in peripheral blood of patients with inflammatory bowel disease (IBD) during treatment with anti TNF-α agents[J].Gastroenterology, 2009, 136(5Suppl1): A-253.
