七叶莲总皂苷体内外降尿酸作用及对高尿酸血症小鼠尿酸转运蛋白的影响
2018-05-09朱玲玲陈宝军
朱玲玲,陈宝军
台州恩泽医疗中心(集团)台州医院,浙江 台州 317000
高尿酸血症是由尿酸的产生和排泄功能障碍而引起其水平升高为特征的一种疾病。尿酸是嘌呤化合物的代谢终产物,在黄嘌呤氧化酶作用下,次黄嘌呤氧化成黄嘌呤,黄嘌呤氧化成尿酸[1]。痛风是一种与体内高尿酸水平相关的代谢紊乱疾病,可以引起炎症、痛风性关节炎和尿酸性肾结石。目前针对痛风的治疗方法主要是治疗炎症和控制高尿酸血症,黄嘌呤氧化酶被认为是高尿酸血症最重要的治疗靶点[2]。别嘌呤醇是一种肝脏黄嘌呤氧化酶抑制剂,主要用于治疗高尿酸血症和痛风。然而,它的临床用途经常受到副作用的限制,例如发热、皮肤皮疹、过敏反应、肝炎、史蒂文斯-约翰逊综合征等,甚至发生致死性肝坏死和肾病。因此,急需开发一种对高尿酸血症和痛风治疗有效的替代疗法[3]。
七叶莲[Schefflera venulosa(Wight et Arn.)Harms]为五加科鹅掌柴属植物,又名汉桃叶、七加皮、七叶烂、手树等,广泛分布于我国华南地区,主产于我国广东、广西、福建、台湾、云南和贵州等地。性温,味微苦,主要含有萜烯类、三萜皂苷类和有机酸类等化学成分,具有祛风除湿、催眠和活血止痛等功效,对三叉神经痛、坐骨神经痛、神经性头痛、风湿性关节痛以及跌打肿痛等均有一定的缓解作用[4~7]。近年来,对于七叶莲的化学成分和药理活性的研究逐渐增多,具有较好的开发前景,引起了许多学者的关注[8~9]。本研究的目的是通过体外相关酶系统和体内高尿酸血症小鼠模型来确定七叶莲总皂苷对黄嘌呤氧化酶的抑制活性和抗高尿酸血症作用,并探讨其对尿酸转运蛋白的影响。
1 材料与方法
1.1 实验材料 七叶莲药材采自云南省文山壮族苗族自治州文山县,七叶莲总皂苷由本实验室自制;氧嗪酸钾,乙胺丁醇,别嘌呤醇(湖北信康医药化工有限公司);黄嘌呤(上海恒远生物科技有限公司);血清尿酸测定试剂盒(南京建成生物工程研究所);Lowry蛋白浓度测定试剂盒(美国Solarbio公司);Anti-URAT1(美国 Abcam 公司);TRE-Trizol(美国Invitrogen公司)。其余试剂均为分析纯;水为纯净水。
雄性ICR小鼠60只,4周龄,体质量(22±2)g,购自浙江大学实验动物中心,实验动物合格证号:SCXK(浙)2014-0012。在温度为(23±2)℃、湿度为(50±10)%、12 h光照交替的环境中饲养。
1.2 体外黄嘌呤氧化酶活性测定 通过检测在反应系统中尿酸的生成量来衡量七叶莲总皂苷对黄嘌呤氧化酶的抑制活性。该反应系统包括0.6mL的100mmol/L磷酸盐缓冲液(pH 7.4),0.1 mL样品,0.1 mL黄嘌呤氧化酶(0.2 U/mL)和0.2 mL的1 mmol/L黄嘌呤(溶于0.1 mol/L NaOH溶液中)。通过加入含有或不含有抑制剂的酶来进行反应,反应15 min后,加入0.2 mL的1 mol/L HCl来终止反应,比较反应前后,该体系在290 nm处的吸光度改变。实验分为空白对照组,阳性对照组和七叶莲总皂苷低(200 μg/mL)、中(400 μg/mL)、高(800 μg/mL)剂量组,采用别嘌呤醇(30 μg/mL)作为阳性对照药。
1.3 模型的建立、分组及干预 60只ICR小鼠随机分为6组,每组10只,分别为正常对照组,模型对照组,阳性对照组,七叶莲总皂苷低、中、高剂量组,每天给药1次,连续给药7天。阳性对照组小鼠按10 mg/kg的剂量给予别嘌呤醇溶液;七叶莲总皂苷低、中、高剂量组小鼠分别给予剂量为50、100、200 mg/kg的七叶莲总皂苷提取液;正常对照组和模型对照组小鼠给予同体积0.3%羧甲基纤维素钠水溶液。采用氧嗪酸钾和乙胺丁醇造成小鼠高尿酸血症病理模型。正常对照组小鼠使用PBS来代替,其它各组小鼠从第4天开始给予250 mg/(kg·d)乙胺丁醇(灌胃给药)和 100 mg/(kg·d)氧嗪酸钾(腹腔注射),连续造模给药4天。在最后一次预处理1 h后,通过小鼠眼眦静脉收集大约0.5 mL血液样本,在4℃下放置1 h后,以10 000 g离心15 min获得血清。同时取小鼠肝脏和肾脏一并冷冻保存待测。
1.4 小鼠体内尿酸浓度和黄嘌呤氧化酶活性测定用标准诊断试剂来测定血清中的尿酸浓度。在小鼠肝脏中黄嘌呤氧化酶的活性是通过分光光度法测定黄嘌呤生成尿酸的量来完成。0.5 g小鼠肝脏在1 mL 50 mmol/L磷酸钠缓冲液(pH 7.4)中匀浆,在4℃条件下,以3 000 g离心10 min。除去脂质层之后,上清液在4℃条件下以10 000 rpm离心60 min。再次分离上清液用于测定黄嘌呤氧化酶活性与总蛋白浓度。50 mmol/L pH 7.4磷酸钠缓冲液包含10 μL肝组织匀浆和0.54 mL 1 mmol/L的氧嗪酸钾溶液,并在35℃下预孵15 min,加入0.12 mL 250 mmol/L黄嘌呤溶液。分别在0和30 min时,加入0.1 mL 0.6 mol/L HCl终止反应。并以3 000 g离心5 min,测定上清液在295 nm处的吸光度值。总蛋白浓度用Lowry法来测定。黄嘌呤氧化酶的活性用每毫克蛋白质每分钟形成尿酸的微摩尔数来表示。
1.5 小鼠肾脏URAT1的蛋白表达水平 采用Western blot法测定小鼠肾脏URAT1的蛋白表达水平。取小鼠肾皮层组织以含PMSF的裂解液RIPA提取蛋白,再以Lowry蛋白浓度测定试剂盒测定浓度。上述蛋白经10%的SDS-PAGE电泳分离后,在200 mA条件下转移到PVDF膜上(2 h),以5%的脱脂奶粉封闭 1 h后,一抗 URAT1(1∶1 000)和内参β-actin(1∶5 000),4℃孵育过夜。再以HRP标记二抗(1∶5 000)孵育1 h,显色后采用WO-9413B型凝胶成像系统软件Gelpro32分析胶片中的Western blot蛋白条带中的灰度值。
1.6 统计学方法 实验数据统计分析采用SPSS20.0软件,计量资料以(x±s)表示,显著性检验采用单因素方差分析,组间比较采用t检验。
2 结果
2.1 体外黄嘌呤氧化酶活性的抑制作用比较 见表1。与空白对照组比较,阳性对照组及七叶莲总皂苷低、中、高剂量组能够显著地抑制黄嘌呤氧化酶的活性(P<0.05)。随着七叶莲总皂苷浓度的上升,其对黄嘌呤氧化酶活性抑制作用也显著上升(P<0.05)。本实验为在体外建立的黄嘌呤氧化酶活性测定体系,独立于后面的动物实验,未造模,不设模型对照组。
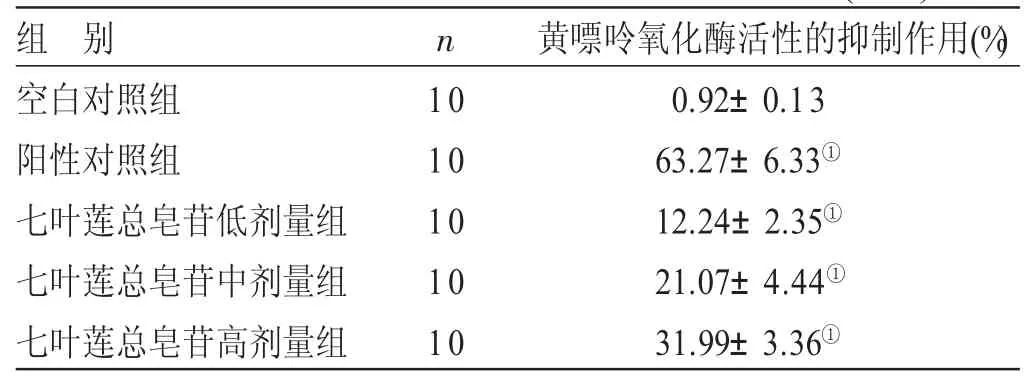
表1 体外黄嘌呤氧化酶活性的抑制作用比较(x±s)
2.2 各组小鼠体内血清尿酸水平比较 见表2。与正常对照组比较,模型对照组小鼠血清尿酸水平显著升高(P<0.05)。与模型对照组比较,阳性对照组、七叶莲总皂苷低、中、高剂量组小鼠的血清尿酸水平显著降低(P<0.05),具有一定的剂量依赖性。
2.3 各组小鼠肝脏黄嘌呤氧化酶活性比较 见表3。与正常对照组比较,模型对照组小鼠肝脏黄嘌呤氧化酶的活性没有明显的差异。与模型对照组比较,阳性对照组、七叶莲总皂苷低、中、高剂量组小鼠的肝脏黄嘌呤氧化酶活性显著降低(P<0.05),具有一定的剂量依赖性。
2.4 各组小鼠肾脏URAT1的蛋白表达水平比较 见表4。与正常对照组比较,模型对照组小鼠肾脏URAT1蛋白表达水平显著上升(P<0.05)。与模型对照组比较,阳性对照组,七叶莲总皂苷低、中、高剂量组小鼠的肾脏URAT1蛋白表达水平显著降低(P<0.05)。
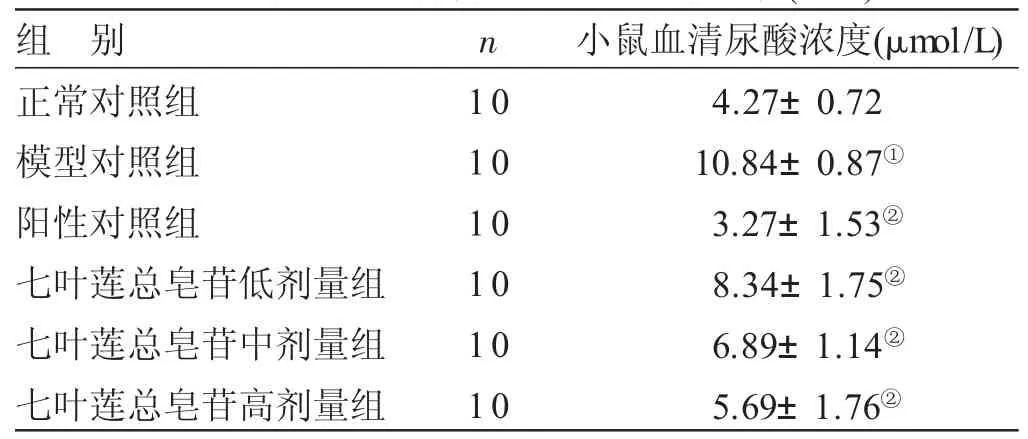
表2 各组小鼠体内血清尿酸水平比较(x±s)
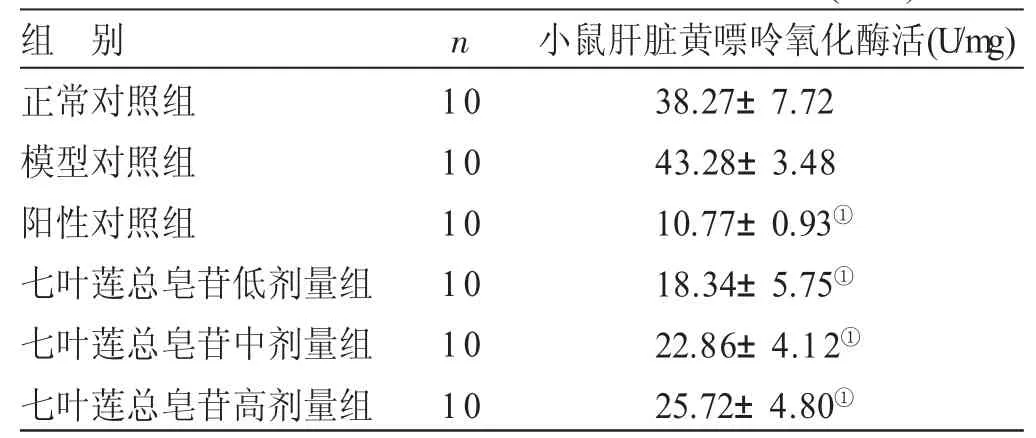
表3 各组小鼠肝脏黄嘌呤氧化酶活性比较(x±s)
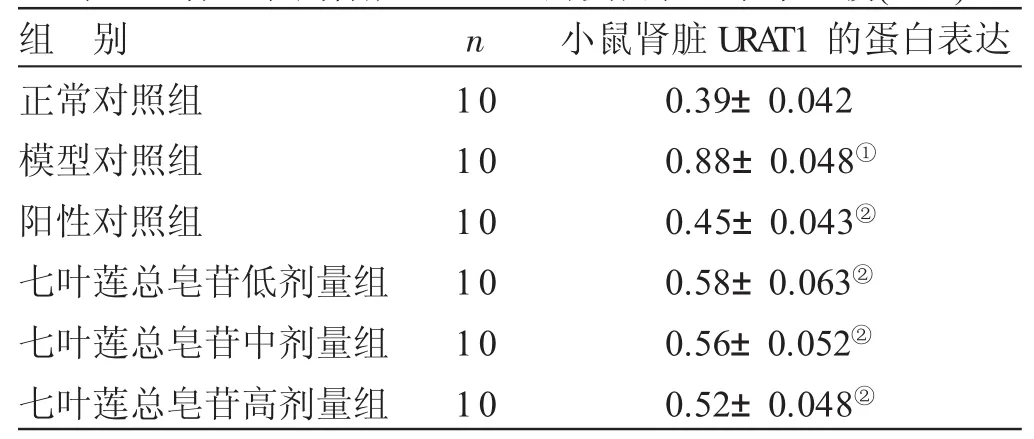
表4 各组小鼠肾脏URAT1的蛋白表达水平比较(x±s)
3 讨论
高尿酸血症是以血液中具有较高水平的尿酸为特征的一种疾病。一般来说,高尿酸血症和痛风的主要原因是嘌呤代谢紊乱,黄嘌呤经酶催化从而过度产生尿酸[10]。高尿酸血症主要由肾排泄尿酸降低或过多的肝尿酸生成引起。在肝脏,黄嘌呤氧化酶可以催化次黄嘌呤氧化成黄嘌呤,进而黄嘌呤氧化成尿酸。此外,痛风与嘌呤降解的终产物即血清尿酸水平升高有关[11]。血清尿酸水平的高低是关节和肾脏尿酸盐结晶沉积的最重要风险因素,有可能会导致尿路结石和痛风关节炎[12]。此前,许多中药成分[11,13~14]已被证明具有较高黄嘌呤氧化酶抑制活性和降低血清尿酸水平的能力。
本研究通过评估血清尿酸水平、肝脏黄嘌呤氧化酶活性和肾脏尿酸转运蛋白表达水平来研究七叶莲总皂苷抗高尿酸血症的作用。体外研究结果显示,七叶莲总皂苷低、中、高剂量均能抑制黄嘌呤氧化酶活性,并随剂量的增加,抑制作用逐渐增强。体内研究中,与正常对照组小鼠相比,高尿酸模型小鼠的血清尿酸水平显著升高,表明高尿酸血症的小鼠模型复制成功。比较正常对照组和模型对照组小鼠的肝脏黄嘌呤氧化酶的活性,没有发现显著区别。这一结果表明用本研究造模方法可能不影响小鼠的黄嘌呤氧化酶活性。七叶莲总皂苷低、中、高剂量组小鼠的血清尿酸水平、肝脏黄嘌呤氧化酶活性及肾脏尿酸转运蛋白URAT1表达均较模型组低,并均呈现一定的剂量依赖性。
可见,七叶莲总皂苷可以通过抑制黄嘌呤氧化酶活性和降低肾脏尿酸转运蛋白URAT1表达两种途径发挥降尿酸的作用。该结果为七叶莲作为降尿酸中药的开发利用奠定了一定基础。
[参考文献]
[1]Kang DH,Nakagawa T,Feng L,et al.A role for uric acid in the progression of renal disease[J].J Am Soc Nephrol,2002,13(12):2888-2897.
[2]Terkeltaub R,Bushinsky DA,Becker MA.Recent developments in our understanding of the renal basis of hyperuncemia and the development of novel antihyperuricemic therapeutics[J].Arthritis Res Ther,2006,8(Suppl 1):S4.
[3]Anzai N,Ichida K,Jutabha P,et al.Plasma urate level is directly regulated by a voltage-driven urate efflux transporter URATv1(SLC2A9)in humans[J].J Biol Chem,2008,283(40):26834-26838.
[4]刘同祥,张艳平.七叶莲的研究进展[J].中央民族大学学报:自然科学版,2010,19(2):75-77.
[5]闫挨拴,党晓伟,刘晓明.七叶莲化学成分及药理临床研究概况[J].中国乡村医药杂志,2007,14(3):49,58.
[6]崔涛,夏伟军,彭玲芳.七叶莲提取物中总黄酮和槲皮素的含量测定[J].药物分析杂志,2011,31(11):2054-2057.
[7]秦思.七叶莲总三萜抗类风湿性关节炎药效及其机制探究[D].泉州:华侨大学,2016.
[8]黄玉香.七叶莲提取工艺与药效学研究[D].泉州:华侨大学,2013.
[9]董泽科.七叶莲化学成分的分离鉴定和罗勒不同提取部位抗炎镇痛作用的研究[D].泉州:华侨大学,2013.
[10]Wang X,Wang CP,Hu QH,et al.The dual actions of Sanmiao wan as a hypouricemic agent:down-regulation of hepatic XOD and renal mURAT1 in hyperuricemicmice[J].J Ethnopharmacol,2010,128(1):107-115.
[11]施琬,李钟,顾祖莲,等.虎杖-桂枝药对配伍对大鼠慢性高尿酸血症和肾、肠尿酸转运体表达的影响[J].中国实验方剂学杂志,2016,22(2):107-112.
[12]Grassi D, Ferri L, Desideri G, et al.Chronic hyperuricemia,uric acid deposit and cardiovascular risk[J].Curr Pharm Des,2013,19(13):2432-2438.
[13]曾金祥,许兵兵,王娟,等.车前子中毛蕊花糖苷及异毛蕊花糖苷降低急性高尿酸血症小鼠血尿酸水平及其机制[J].中成药,2016,38(7):1449-1454.
[14]朱立然.萆薢总皂苷对高尿酸血症大鼠尿酸转运蛋白表达的影响[D].合肥:安徽中医药大学,2013.
