生物质基碳水化合物催化转化制备乳酸的研究进展*
2018-05-09唐石云罗文艳杨嘉鹏骆钱江
石 宁,唐石云,罗文艳,杨嘉鹏,马 博,骆钱江
(1. 贵州理工学院,化学工程学院,贵阳 550003;2. 广东省新能源和可再生能源研究开发与应用重点实验室,广州 510640)
0 前 言
随着煤、石油、天然气等不可再生化石资源的开采消耗以及因之而起的环境问题的日益严重,以可再生的生物质资源制备人类社会发展所需要的燃料及化学品成为解决当下资源短缺和环境污染等问题的有效途径。碳水化合物(纤维素、木聚糖、淀粉等)是生物质资源的主要成分之一,可以经水解转化为几种相对简单的单糖,而这些单糖则能够经后续的发酵或者催化转化的方法获取一系列具有高附加值的化学品,如乳酸、山梨醇、异山梨醇、乙二醇、乙酰丙酸、5-羟甲基糠醛等[1-3],这些平台化学品则可以经过后续转化制备液体燃料[4-6]、高分子聚合材料[7]及其他精细化学品[8-11],从而推动人类文明的可持续发展。
上述生物质基衍生化学品中,乳酸是一种重要的有机酸,被广泛应用于食品、化工、医药、化妆品等领域。特别地,乳酸可用于制备可生物降解的高分子材料聚乳酸(polylactic acid, PLA),或者作为前驱体制备丙二醇、丙烯酸、丙酮酸等精细化学品[11]。然而,目前工业上90%以上的乳酸是以淀粉/葡萄糖为原料,通过生物发酵法制取[9]。尽管该方法具有乳酸选择性高、发酵温度低等优点,但是所需时间长,且采用的原料是粮食,导致乳酸的生产成本高。此外,为了保持发酵液 pH为中性,需要不断添加Ca(OH)2到发酵液中以中和生成的乳酸,发酵结束后需采用硫酸处理乳酸钙以获取乳酸并副产硫酸钙,使得该技术生成成本高[9]。因此,对乳酸生产新技术的开发研究成为学术界的一个热点。
早在20世纪80年代,部分研究发现葡萄糖或果糖在水热条件下降解,能够生成少量的乳酸[12-13]。随后的研究中,随着反应体系的优化及催化剂的开发,生物质基糖类在水热条件下转化制备乳酸的选择性得到了显著提高,目前有文献报道催化纤维素转化可得到 89%的乳酸[2]。与传统发酵法制备乳酸相比,催化转化法可以利用自然界中广泛存在的廉价木质纤维素类生物质资源(比如秸秆、木屑、甘蔗渣等)为原料,既能实现生物质资源的高值利用,同时还具有反应时间短、产品易分离等优点,是一种极具研究价值的乳酸生产新技术。
二羟基丙酮、甘油醛、丙酮醛等三碳糖是葡萄糖等生物质基糖类制备乳酸的中间产物,部分制备乳酸的研究采用这些三碳糖作为原料[14-16],但是自然界中该类糖存在量极少,因此本文不对该类研究的文献进行综述,而将着重于对葡萄糖、果糖、纤维素等生物质基糖类制备乳酸及其酯类的转化途径、催化剂开发及催化机理的研究进行综述,分析催化剂与催化机理研究中存在的问题,以便为木质纤维素类生物质高效转化为乳酸提供研究思路。

图1 纤维素转化为乳酸的反应历程及乳酸的应用[11,13-14,17,23-25]Fig. 1 Route of cellulose converting into lactic acid and the utilization of lactic acid[11,13-14,17,23-25]
1 生物质基糖类降解为乳酸的反应路径及其副反应
如图1所示,纤维素经过下述步骤转化为乳酸:①纤维素水解为葡萄糖;②葡萄糖异构化为果糖;③果糖发生逆羟醛缩合反应转化为甘油醛和二羟基丙酮;④甘油醛和二羟基丙酮脱水转化为丙酮醛;⑤丙酮醛水合重排为乳酸[14,17]。经过上述反应历程,1 mol的葡萄糖单元可以生成2 mol的乳酸。上述步骤中,甘油醛、二羟基丙酮的脱水反应及丙酮醛的水合重排较容易实现,而葡萄糖的异构化反应和果糖的逆羟醛缩合反应较难实现高选择性催化[15-17]。另外,如果纤维素制取乳酸的反应以低级醇(甲醇、乙醇)作为溶剂,则生成的乳酸还会和溶剂发生酯化反应从而生成相应的酯类[18-21]。由于乳酸酯在高温下比乳酸更为稳定,因此以醇为溶剂往往比以水为溶剂获得更高的产物收率。比如,HOLM 等[22]采用Sn-β催化蔗糖降解时,采用水为溶剂仅得到低于30%的乳酸,而采用甲醇能获得68%的乳酸甲酯。
在纤维素及葡萄糖降解为乳酸的过程中,易发生下述副反应导致乳酸收率较低(图1):①葡萄糖发生逆羟醛缩合反应生成乙醇醛[23];②果糖脱去 3分子水反应生成5-羟甲基糠醛并继续降解为乙酰丙酸[24];③葡萄糖、果糖发生聚合反应,生成固态的腐黑物[25]。
要实现催化葡萄糖转化生成乳酸,就需要催化剂对葡萄糖的异构化反应和果糖的逆羟醛缩合反应均具有较好的催化作用。然而,并不是所有的催化剂都能够同时催化上述两步重要反应。比如钨基催化剂对糖类的逆羟醛缩合反应具有很好的催化作用,但是却不能很好地催化葡萄糖的异构化,导致葡萄糖来不及异构化为果糖就已经发生 C—C键断裂生成乙醇醛及其衍生物(如乙二醇)[23];另外,有的催化剂能够催化葡萄糖的异构化,却不能很好地催化逆羟醛缩合反应,但对果糖的脱水反应具有很强的催化作用(如 SnCl4、CrCl3、DMA-LiCl、CrCl2-RuCl3等强酸),导致在葡萄糖转化时生成的果糖不发生逆羟醛缩合反应却发生脱水反应生成5-羟甲基糠醛及乙酰丙酸[3,24]。
2 催化糖类转化为乳酸的催化剂
由于该过程中发生的副反应极多,要实现高效催化葡萄糖生产乳酸的目标,就需要催化剂能够:①催化葡萄糖异构化为果糖且抑制葡萄糖发生逆羟醛缩合反应;②催化果糖的逆羟醛缩合反应且抑制果糖的脱水反应;③避免葡萄糖、果糖发生缩聚反应生成胡敏素。目前所报道的催化生物质基糖类转化为乳酸的催化剂可以分为下面三类:均相无机强碱、均相路易斯酸和非均相路易斯酸。
2.1 均相无机强碱
有文献报道了强碱如NaOH、Ca(OH)2、Ba(OH)2能催化葡萄糖或纤维素转化得到乳酸。YAN等[26]在 300℃的高温液态水中,采用 NaOH和 Ca(OH)2催化纤维素和葡萄糖降解,得到的20% ~ 30%的乳酸。ESPOSITO等[27]则采用碱金属所对应的强碱Ca(OH)2、Ba(OH)2、Sr(OH)2催化葡萄糖降解,得到40% ~ 53%的乳酸。他们认为,碱土金属所对应的强碱的催化效果比碱金属所对应的碱的催化效果好,这是由于二价的碱土金属阳离子能够和葡萄糖形成配合,从而提高乳酸的收率。最近,LI等[28]报道了在室温下的水溶液中,使用 Ba(OH)2催化葡萄糖转化,能够得到95%的乳酸,但该反应中采用的葡萄糖浓度极低,不具有经济可行性。
有学者发现,在NaOH溶液中进行糖类转化时,添加活性炭及金属(锌粉或镍粉)可以有效地提高乳酸的收率至42%[29-31]。他们认为锌粉在反应过程中被转化成ZnO并产生H2,而产生的ZnO和H2都能够抑制乳酸的降解;镍粉一方面能够催化葡萄糖反应,另一方面镍粉转化得到的 Ni2+也对葡萄糖异构化反应具有催化作用[31]。活性炭的作用可能是其碱性位可以催化葡萄糖的异构化反应[32]。该催化体系中,ZnO可能还对果糖的逆醛醇反应具有较好的催化作用[19]。
在以强碱性水溶液为介质的催化体系中,强碱溶液对反应釜的腐蚀是不可避免的。此外,采用可溶性强碱作为催化剂时,由于催化剂会和乳酸反应生成乳酸盐,乳酸盐则需要通过酸化生成乳酸并副产相应的无机盐,导致生产成本高,不适于工业化生产。
2.2 均相路易斯酸
部分可溶性金属盐被发现对催化糖类转化制备乳酸具有较好的催化作用。早在2005年,BICKER等[33]就报道了ZnSO4能够催化二羟基丙酮、葡萄糖、蔗糖降解分别得到86%、42%和48%的乳酸。最近,WANG等[34]采用锌盐在乙醇中催化果糖和葡萄糖转化,分别得到52%和48%的乳酸乙酯,指出Zn2+能够与葡萄糖的羟基及羰基发生配位,从而催化葡萄糖的异构化反应。
RASRENDRA等[14]研究了均相路易斯酸(Na+、Mg2+、Fe3+、Cu2+、La3+、Co2+、Ni2+、Zn2+、Cr3+、Al3+的氯盐及硫酸盐)对三碳糖(甘油醛和二羟基丙酮)转化为乳酸的催化作用。上述盐类对三碳糖转化为乳酸均具有一定的催化作用。特别地,Al3+和Cr3+能够催化甘油醛及二羟基丙酮转化,得到 90%以上的乳酸。
近年来,厦门大学王野教授团队在使用均相路易斯酸催化纤维素制备乳酸方面取得了突破性的进展。2013年,他们报道了利用 Pb(II)的盐类催化转化纤维素可以得到70%的乳酸[35],认为Pb2+在水溶液中会形成Pb(II)—OH物种,一方面,该物种催化葡萄糖通过1,2-分子内氢原子转移而异构化为果糖;另一方面,该物种中Pb2+由于具有较大的离子半径,易与果糖分子中的羟基发生配位,并使得 C4—OH的氢原子带上正电荷,导致在C2=O与C4—OH之间发生质子转移,进而降低C3—C4间的C—C键能,从而引发果糖的逆羟醛缩合反应。然而,该研究没有阐明催化剂的活性物种如何催化葡萄糖异构化。后来,他们又发现钒氧根离子(VO2+)在水溶液中同样可以有效地催化纤维素转化为乳酸,收率高达67%[36]。他们认为VO2+在催化果糖逆羟醛缩合反应时,起到和Pb2+一样的作用。
陕西师范大学董文生团队发现镧系金属的盐类对糖类转化为乳酸具有特别的催化效果[2,37]。铒的盐类,如三氟甲基磺酸铒Er(OTf)3及氯化铒ErCl3,对糖类转化为乳酸表现出优异的催化效果,采用Er(OTf)3作为催化剂催化纤维素转化得到的乳酸收率高达89%[2]。然而,铒离子(Er3+)在催化过程中的作用机理,特别是对果糖逆羟醛缩合反应的作用机理,并没有进行深入研究。
部分研究采用锡的盐类去催化糖类降解制备乳酸或其酯类。最近,NEMOTO等[38]报导了在甲醇溶液中,利用 InCl3、SnCl2和NaBF4联合催化果糖和葡萄糖转化,分别得到72%和53%的乳酸甲酯。他们指出,InCl3对果糖的逆醛醇反应具有很好的催化作用,SnCl2则能够催化醛糖异构化为酮糖(葡萄糖异构化为果糖,甘油醛异构化为二羟基丙酮),而NaBF4则起到抑制SnCl2和InCl3醇解的作用。ZHOU等[39]采用SnCl2和SnCl4催化葡萄糖转化,在反应体系中加入少量的NaOH中和催化剂因发生醇解而产生的质子以抑制果糖的脱水反应,从而提高乳酸甲酯的收率至48%。另外,DOS SANTOS等[40]发现,含有Sn(IV)的有机金属催化剂在催化果糖降解时,对乳酸具有较高的选择性。他们认为,Sn(IV)发生水解形成的活性物种O-Sn-O可能对果糖的逆醛醇反应有催化作用。上述系列研究均表明,Sn(II)、Sn(IV)对果糖逆醛醇反应具有重要催化作用。
DENG等[41]报道了在水溶液中使用Al-Sn两种金属阳离子的可溶盐协同催化果糖、葡萄糖和纤维素转化,分别得到90%、81%和65%的乳酸。他们认为,在催化上述糖类制取乳酸的过程中,Al3+催化了葡萄糖的异构化反应,而 Sn2+则催化果糖的逆醛醇缩合反应。
尽管上述报道的均相路易斯酸催化剂(金属离子 Zn2+、Pb2+、Er3+、VO2+、Sn2+、Sn4+的可溶性盐)能够高选择性地催化纤维素降解为乳酸,但是使用这些均相催化剂存在诸多不利,比如催化剂与产物分离困难,催化剂不易回收,且一些金属盐离子的毒性较大,对产品造成一定的污染。另外,关于Zn2+、Pb2+、Er3+、VO2+、Sn2+、Sn4+在催化过程中所起到的催化作用机制并不明确。对该类催化剂催化活性中心及催化机理的深入研究,可以为后续非均相催化剂的设计与开发提供重要的理论指导,需要后续进行更深入的研究。
2.3 非均相路易斯酸
掺杂锡的Sn-β分子筛对糖类转化为乳酸及其酯类具有较好的催化效果。2010年,HOLM 等[22]以Sn-β分子筛为催化剂,分别以水和甲醇作为溶剂进行蔗糖转化,得到约30%的乳酸和68%的乳酸甲酯。近来,DONG 等[42]将 Zn2+通过离子交换法掺杂到Sn-β中,制备出的Zn-Sn-β催化剂能将蔗糖转化为乳酸的收率提高到 54%。他们指出,Zn2+的引入能同时提高催化剂的路易斯酸性位和碱性位点,而其碱性位点能够抑制果糖脱水等副反应,从而抑制果糖脱水等副反应的发生。Sn-β对葡萄糖的异构化反应已经被诸多研究所发现,但该催化剂对果糖的逆羟醛缩合反应的催化作用机制目前尚未明确。最近,YANG等[43]合成了层状的无氟Sn-β分子筛,并用于在甲醇中转化葡萄糖,可以得到58%的乳酸甲酯。ZHAO 等[44]将铁掺杂到 SnO2中,制备出 Fe-SnO2催化剂并将其用于转化果糖和葡萄糖,分别得到52%和35%的乳酸甲酯。
将前面发现的对糖类转化为乳酸的金属离子负载于固体载体上是一种非均相催化剂开发的途径。如前所述,陕西师范大学董文生团队发现铒的盐类对纤维素制备乳酸具有很好催化效果,随后他们将Er3+交换到脱蒙土 K10、β分子筛及 ZSM-5分子筛上,或者将Er2O3直接负载在Al2O3上,所制备的固体催化剂均能够催化纤维素转化分别得到50%以上的乳酸收率[45-46]。
钨基固体酸是一类对葡萄糖和果糖的逆醛醇缩合反应具有较好催化作用的固体催化剂。实际上,钨基固体酸对糖类的逆醛醇反应的催化作用已经被大连化学物理研究所的张涛团队发现,并用于催化纤维素制备乙二醇等小分子醇类[23,47-49]。CHAMBON等[50]采用含有钨的路易斯酸(Al-W和Zr-W)催化纤维素转化,得到乳酸选择性达到50% ~ 60%。他们指出,以钨为核心的活性中心对糖类的逆醛醇反应具有很好的催化作用,而Al和Zr原子的活性中心对葡萄糖异构化为果糖具有催化作用。CHAMBON的工作均表明,通过对催化剂进行组合或改性,将葡萄糖异构化反应与果糖逆羟醛缩合反应进行调变,可以实现对葡萄糖降解产物的调控。然而,关于钨基催化剂对糖类逆羟醛缩合反应的催化机理,目前尚未有明确的结论。
LIN的课题组在锆基非均相催化转化生物质基糖类制备乳酸开展了一系列研究。他们在水溶液中以固体酸 ZrO2催化木糖及木聚糖转化,分别得到42%和30%的乳酸[51]。随后,他们继续在水-甲醇溶剂体系中,采用掺杂 Zr4+的介孔分子筛 Zr-SBA-15催化果糖、葡萄糖、纤维素及淀粉转化,分别得到44.1%、37%、28%和27%的乳酸甲酯(与葡萄糖和果糖等六碳糖不同,木糖等属于五碳糖,一分子木糖只能生成一分子乳酸)[52]。他们认为,Zr-SBA-15中的 O—Zr—O结构作为路易斯酸中心,可能与糖的羰基发生作用,从而触发己糖的逆醛醇反应。WATTANAPAPHAWONG等[53]也报道了采用ZrO2催化纤维素转化,得到21%的乳酸,并指出ZrO2催化剂中较弱的路易斯酸位点(Zr原子)和碱性位点(O原子)的存在对逆醛醇缩合反应的发生具有重要催化作用。随后,他们合成了一系列 ZrO2-Al2O3催化剂并用于转化纤维素,使乳酸收率略微提高到25%[54]。
此外,COMAN等[55]报道了铌掺杂的NbF5@AlF3催化剂,催化纤维素转化得到 27%的乳酸。他们认为该催化剂中 Al—O—H结构中的氢原子提供了布朗斯特酸中心,而Nb=O结构属于路易斯酸中心。催化剂内部的路易斯酸性位点对纤维素转化生成乳酸具有重要作用,而布朗斯特酸中心则对纤维素水解为葡萄糖起到重要的催化作用。
最近,VERMA等[19]合成了Ga-ZnO/HY催化剂,用于超临界甲醇溶液中催化微晶纤维素转化得到57.8%的乳酸甲酯。他们认为该催化剂中ZnO上的路易斯酸性位是催化葡萄糖异构化反应及果糖的逆醛醇反应的活性位点。此外,掺杂的Ga2+与ZnO相互作用,产生的新路易斯酸位点对果糖逆醛醇反应具有重要的催化作用。他们还发现ZnO及GaO的添加都对纤维素转化具有一定的催化作用,但是其催化机理并不明确。
3 生物质基糖类转化为乳酸的催化作用机理
3.1 葡萄糖异构化机理
葡萄糖的异构化反应是木质纤维素类生物质转化为乳酸和 5-羟甲基糠醛等重要平台化学品的关键步骤,因此国内外近年来对该反应的催化机理开展了大量研究。目前公认的葡萄糖异构化为果糖主要分为三个步骤:①葡萄糖吡喃环开环并吸附于催化剂活性中心;②在催化剂作用下,葡萄糖C2—O—H中的O—H键断裂,分子内C2上的氢原子转移到C1上,C1=O双键断裂并从催化剂上获得氢原子形成C1—O—H,从而形成吸附在催化剂活性位上的链状果糖;③链状果糖脱离催化剂并闭合呋喃环[56-62]。目前诸多研究主要集中在两种均相催化剂(CrCl3、AlCl3)和两种非均相催化剂(Sn-β,WO3·H2O),其在水溶液中的活性中心如图2所示。
(1)均相路易斯酸(Cr3+、Al3+)催化葡萄糖异构化反应的催化机理
CrCl3和AlCl3在水中会发生部分水解并与水分子相络合,分别形成活性中心[Cr(H2O)5OH]2+和[Al(H2O)5OH]2+(结构见图2a和图2b),在水溶液中呈八面体结构,其中,金属阳离子中心是路易斯酸性位,而与金属阳离子结合的—OH起到碱性位的作用[58-62]。CrCl3和AlCl3对葡萄糖异构化反应的催化机理如图3所示:①当葡萄糖与活性物种接触时,葡萄糖的羰基(C=O)作为电子给体在金属离子(路易斯酸中心)发生吸附,同时葡萄糖上的 C1—O和 C2—O取代催化剂金属阳离子上的两个水分子并与之配位,形成 [M(C6H12O6)(H2O)3OH]2+阳离子,其中C2—OH与Cr—OH形成氢键(过渡态1);②葡萄糖 C2—OH上的氢原子转移到催化剂上的Cr—OH(布朗斯特碱性位点),生成Cr—OH2,同时 Cr3+阳离子中心(路易斯酸性位点)与 C1、C2上的氧原子发生配位,引发C2上面的氢原子转移到C1上(过渡态1→过渡态3);③与Cr3+配位的水分子中的一个氢原子转移到 C1—O上去并形成C1—O—H,从而得到与活性中心相连的链状果糖,并实现Cr—OH的再生(过渡态4)。其中,葡萄糖分子内的C2上的氢原子转移到C1上(过渡态1到过渡态3)是整个异构化反应的速控步骤[57-58]。
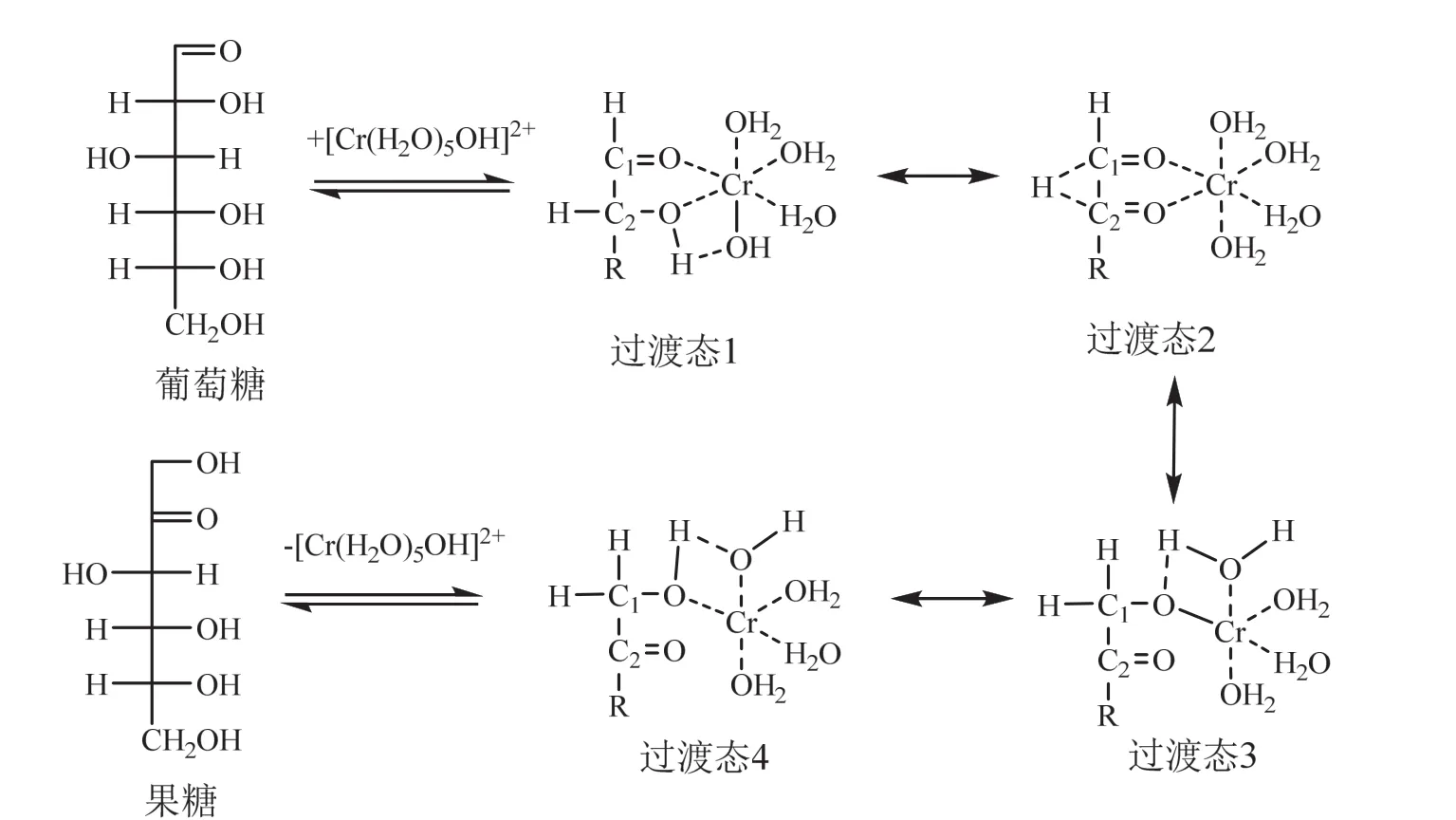
图3 水溶液中金属阳离子Cr3+催化葡萄糖的异构化反应机理[57-60]Fig. 3 Cr3+-catalyzed isomerization mechanism of glucose in aqueous solution[57-60]
TANG等[59]分析AlCl3催化葡萄糖异构化反应,利用ESI-MS/MS证明AlCl3在水溶液中的活性物种为[Al(H2O)4(OH)2]+而不是[Al(H2O)5(OH)]2+。另外,他们的研究表明葡萄糖上的C1=O与金属阳离子活性中心的相互作用对反应的触发起到重要作用。
正如前面所述,Zn2+、Pb2+、VO2+、Er2+四种催化剂均能高效催化葡萄糖生成乳酸,表明四种金属阳离子都能催化葡萄糖异构化为果糖。关于这四种阳离子在水溶液中所对应的活性物种及其催化机理,目前尚未有文献报道。但极有可能这四种金属阳离子在水溶液中也是形成了活性物种[M(H2O)x(OH)y]z+,该活性物种通过与Cr3+和Al3+相似的催化机理实现葡萄糖果糖的异构化[60]。
(2)非均相催化剂(Sn-β及WO3)催化葡萄糖异构化机理
由于Sn-β对葡萄糖的异构化反应具有优异的催化效果,大量工作研究了Sn-β对葡萄糖异构化反应的催化作用机理[61-66]。在早期的研究中,ROMANLESHKOV等[61]认为Sn4+是催化活性中心,而其上的硅醇并未起到相应的作用(活性位见图2c)。这种没有硅醇参与的 Sn-β催化葡萄糖异构化反应机理如图4a所示:葡萄糖的C2—O和C1—O与路易斯酸中心 Sn4+形成双齿配位,而 Sn—OH 则从C2—O—H 获得氢原子并传递给 C1—O,引发 C2上的氢原子转移到 C1上,从而生成链状的果糖分子;链状果糖分子从Sn4+配位中心脱离,形成链状的果糖[61]。在这一种双齿配位机理中,Sn4+与均相催化过程中的Cr3+、Al3+具有相似的作用。
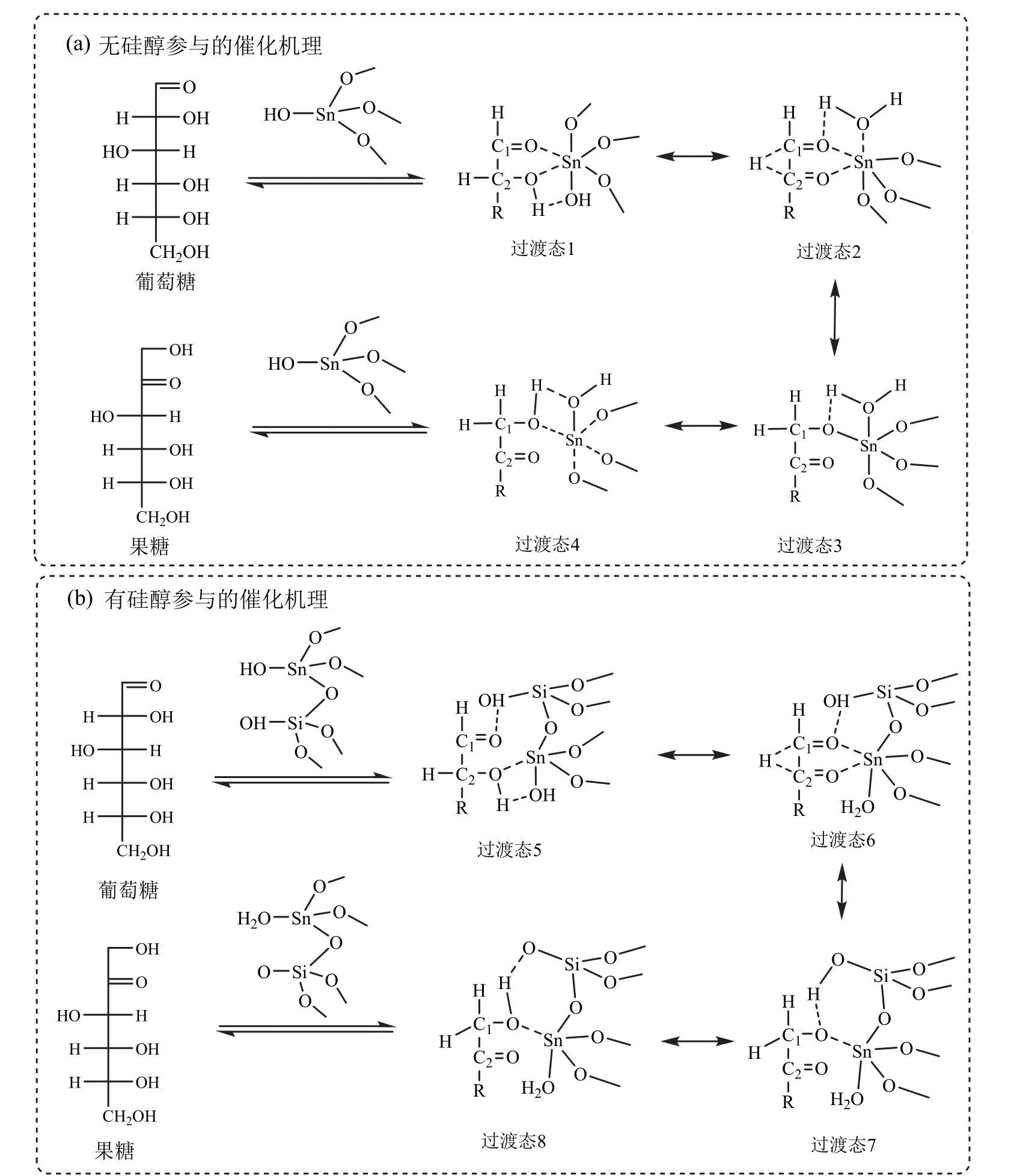
图4 Sn-β催化葡萄糖异构化反应的催化机理[61-66]Fig. 4 Isomerization mechanism of glucose catalyzed by Sn-β[61-66]
在上述机理中,Sn—OH起到关键的作用,是催化剂的活性中心,硅醇(Si—OH)则没有起到作用。但是BERMEJO-DEVAL等[63]利用Na+与Si—OH中的氢离子交换从而去除硅醇结构,得到的Na-Sn-β不能催化葡萄糖的异构化反应,表明 Sn-β中的Si—OH结构对葡萄糖的异构化反应起到重要作用。LI等[64]通过周期性密度泛函计算,指出Sn-β分子筛中 Sn4+相邻的羟基(可能来自于硅醇结构或吸附于Sn-β上的水分子)能够降低葡萄糖异构化反应过程中的过渡态形成的活化能,对于葡萄糖的异构化反应具有重要的影响。RAI等[65]同样在密度泛函计算的基础上,认为Sn-β催化葡萄糖异构化为果糖时,葡萄糖并不是与Sn4+形成双齿配位,而是由C2—O与Sn4+配位,C1—O则与和Sn4+毗邻的Si—OH通过氢键相连。他们提出的有硅醇参与的Sn-β催化葡萄糖异构化反应机理如图4b所示:①葡萄糖C1=O羰基与硅醇Si—OH形成氢键,C2—OH中的氧原子与Sn相连,而氢原子则与Sn—OH形成氢键,得到过渡态5;②C2—OH中的氢原子转移到Sn—OH上去,同时C1=O中的双键断开,C1—O中的氧原子与Sn4+相连,C2上的氢原子开始向C1转移,形成过渡态6;③C2—O从Sn4+上脱离,形成C2=O,C2上的氢原子则完全转移到C1上去,形成过渡态7;④硅醇上的氢原子转移到C1—O上去,形成过渡态8,最后从Sn-β上脱离,形成链状的果糖分子[63-66]。
WO3·H2O对葡萄糖异构化反应也具有一定的催化作用,LI等[67]通过周期的密度泛函理论计算了WO3·H2O对葡萄糖异构化反应的催化作用机理。他们提出的WO3·H2O催化剂活性中心如图2d所示,其中活性位点是路易斯酸中心 W6+和路易斯碱性位点W=O,吸附在催化剂表面的水分子起到质子传递的作用。当葡萄糖吸附在WO3·H2O表面时,路易斯酸中心钨离子与葡萄糖单元上的C1=O和C2—O发生配位,而路易斯碱性位点W=O与C2—OH形成氢键,同时吸附在催化剂表面的水分子与葡萄糖单元的C1=O形成氢键;随着路易斯酸中心钨离子与C1=O键能逐渐增强,C1=O的双键断裂,吸附在氧化钨上的水分子作为质子给体与 C1=O形成C1—O—H;与此同时,C2—H转移到C1上,形成开环的果糖。另外,他们通过计算指出,在WO3·H2O中掺杂 Nb5+、Ti4+等金属阳离子,可以有效降低葡萄糖异构化反应的活化能。
3.2 逆羟醛缩合反应机理研究
戊糖、己糖(葡萄糖及果糖)的逆羟醛缩合反应在生物质基糖类制备小分子化学品如乳酸、乙二醇、1,2-丙二醇等小分子化学品的过程中起到关键作用,但关于果糖逆羟醛缩合反应的催化作用机理目前鲜有研究。诸多能够催化葡萄糖异构化反应的路易斯酸(Pb2+、VO2+、Zn2+、Al3+、Er3+、Sn-β、WO3·H2O)也同样能够催化果糖的逆羟醛缩合反应,表明两种反应可能需要的催化活性中心相同。葡萄糖的逆醛醇缩合反应生成乙醇醛和赤藓糖,果糖的逆醛醇反应生成甘油醛和二羟基丙酮,木糖的逆醛醇反应生成乙醇醛和二羟基丙酮,这些结果表明逆醛醇缩合反应往往发生在与羰基相邻的α碳与β碳原子间,表明羰基在逆醛醇缩合反应过程中起到重要作用。WATTANAPAPHAWONG等认为逆醛醇缩合反应的催化机理如图5所示:在反应过程中,糖分子中的羰基及其相邻碳上的羟基与路易斯酸中心发生配位,同时催化剂或者溶剂中水分子的氢原子和氢氧根分别进攻α、β碳原子,导致α、β碳原子间的C—C键被弱化进而断裂,从而发生逆醛醇缩合反应[53]。

图5 路易斯酸催化葡萄糖、果糖逆醛醇缩合反应历程[53]Fig. 5 Reaction mechanism of retro-aldol condensation of glucose and fructose catalyzed by Lewis acid[53]
4 结论与展望
高效、绿色、易回收催化剂的开发是实现催化生物质转化制备乳酸的关键。目前的研究已经报道了部分可溶性碱(NaOH、Ba(OH)2、Ca(OH)2等)、均相路易斯酸(Pb2+、Er3+、VO2+的盐类)、非均相固体酸(Sn-β、Al-W、Zr-W、Zr-SBA-15、NbF5@AlF3等)均能够催化该反应。然而,各类催化剂的催化作用机制还缺乏具有说服力的结论。通过对目前催化剂的结构及其生物质转化为乳酸的催化作用性能的研究,揭示催化剂对该反应的微观催化机制,建立催化剂性能与其催化性能的相关理论,对指导后续非均相催化剂的可控性开发具有重要意义。
葡萄糖的异构化反应及果糖的逆醛醇反应是两个关键步骤,但目前仍然缺乏能够同时高效催化这两个反应的非均相催化剂。因此,通过对这两个反应的催化作用机制进行深入研究,研制出能够同时高效催化葡萄糖异构化反应和果糖逆醛醇反应的非均相催化剂,对实现生物质资源高效催化转化为乳酸具有重要的意义。
参考文献:
[1]GALLEZOT P. Conversion of biomass to selected chemical products[J]. Chemical society reviews, 2012,41(4): 1538-1558. DOI: 10.1039/C1cs15147A.
[2]WANG F F, LIU C L, DONG W S. Highly efficient production of lactic acid from cellulose using lanthanide triflate catalysts[J]. Green chemistry, 2013, 15(8):2091-2095. DOI: 10.1039/C3gc40836A.
[3]SHI N, LIU Q Y, ZHANG Q, et al. High yield production of 5-hydroxymethylfurfural from cellulose by high concentration of sulfates in biphasic system[J]. Green chemistry, 2013, 15(7): 1967-1974. DOI: 10.1039/C3gc40667A.
[4]LI G Y, LI N, YANG J F, et al. Synthesis of renewable diesel with the 2-methylfuran, butanal and acetone derived from lignocellulose[J]. Bioresource technology,2013, 134: 66-72. DOI: 10.1016/j.biortech.2013.01.116.
[5]ROMÁN-LESHKOV Y, BARRETT C J, DUMESIC J A,et al. Production of dimethylfuran for liquid fuels from biomass-derived carbohydrates[J]. Nature, 2007, 447(7147):982-985. DOI: 10.1038/nature05923.
[6]KUNKES E L, SIMONETTI D A, WEST R M, et al.Catalytic conversion of biomass to monofunctional hydrocarbons and targeted liquid-fuel classes[J]. Science,2008, 322(5900): 417-421. DOI: 10.1126/science.1159210.
[7]EERHART A J J E, FAAIJ A P C, PATEL M K.Replacing fossil based PET with biobased PEF; process analysis, energy and GHG balance[J]. Energy &environmental science, 2012, 5(4): 6407-6422. DOI:10.1039/C2ee02480B.
[8]VAN PUTTEN R J, VAN DER WAAL J C, DE JONG E,et al. Hydroxymethylfurfural, A Versatile Platform Chemical Made from Renewable Resources [J].Chemical Reviews, 2013, 113(3): 1499-1597. DOI:10.1021/Cr300182k.
[9]MAKI-ARVELA P, SIMAKOVA I L, SALMI T, et al.Production of lactic Acid/Lactates from biomass and their catalytic transformations to commodities[J]. Chemical reviews,2014, 114(3): 1909-1971. DOI: 10.1021/cr400203v.
[10]ZHANG Z R, SONG J L, HAN B X. Catalytic Transformation of Lignocellulose into Chemicals and Fuel Products in Ionic Liquids [J]. Chemical Reviews,2017, 117(10): 6834-6880. DOI: 10.1021/acs.chemrev.6b00457.
[11]FAN Y X, ZHOU C H, ZHU X H. Selective catalysis of lactic acid to produce commodity chemicals[J]. Catalysis reviews: science and engineering, 2009, 51(3): 293-324.DOI: 10.1080/01614940903048513.
[12]KROCHTA J M, TILLIN S J, HUDSON J S.Degradation of polysaccharides in alkaline solution to organic acids: product characterization and identification[J].Journal of applied polymer science, 1987, 33(4):1413-1425. DOI: 10.1002/app.1987.070330428.
[13]ANTAL M J JR, MOK W S L, RICHARDS G N.Mechanism of formation of 5-(hydroxymethyl)-2-furaldehyde fromD-fructose and sucrose[J]. Carbohydrate research,1990, 199(1): 91-109. DOI: 10.1016/0008-6215(90)84096-D.
[14]RASRENDRA C B, FACHRI B A, MAKERTIHARTHA I G B N, et al. Catalytic conversion of dihydroxyacetone to lactic acid using metal salts in water[J]. Chemsuschem,2011, 4(6): 768-777. DOI: 10.1002/cssc.201000457.
[15]DENG W P, ZHANG Q H, WANG Y. Catalytic transformations of cellulose and its derived carbohydrates into 5-hydroxymethylfurfural, levulinic acid, and lactic acid[J]. Science China chemistry, 2015, 58(1): 29-46.DOI: 10.1007/s11426-014-5283-8.
[16]WANG X C,LIANG F B, HUANG C P, et al. Siliceous tin phosphates as effective bifunctional catalysts for selective conversion of dihydroxyacetone to lactic acid[J]. Catalysis Science & Technology, 2016, 6(17):6551-6560. DOI: 10.1039/c6cy00553e.
[17]SROKOL Z, BOUCHE A G, VAN ESTRIK A, et al.Hydrothermal upgrading of biomass to biofuel; studies on some monosaccharide model compounds[J].Carbohydrate research, 2004, 339(10): 1717-1726. DOI:10.1016/j.carres.2004.04.018.
[18]LIU Z, LI W, PAN C Y, et al. Conversion of biomass-derived carbohydrates to methyl lactate using solid base catalysts[J]. Catalysis communications, 2011,15(1): 82-87. DOI: 10.1016/j.catcom.2011.08.019.
[19]VERMA D, INSYANI R, SUH Y, et al. Direct conversion of cellulose to high-yield methyl lactate over Ga-doped Zn/H-nanozeolite Y catalysts in supercritical methanol [J]. Green Chemistry, 2017, 19(8): 1969-1982.DOI: 10.1039/c7gc00432j.
[20]DE CLIPPEL F, DUSSELIER M, VAN ROMPAEY R, et al. Fast and selective sugar conversion to alkyl lactate and lactic acid with bifunctional carbon-silica catalysts[J]. Journal of the American chemical society,2012, 134(24): 10089-10101. DOI: 10.1021/Ja301678w.
[21]YANG L S, YANG X K, TIAN E, et al. Mechanistic insights into the production of methyl lactate by catalytic conversion of carbohydrates on mesoporous Zr-SBA-15[J]. Journal of catalysis, 2016, 333: 207-216.DOI: 10.1016/j.jcat.2015.10.013.
[22]HOLM M S, SARAVANAMURUGAN S, TAARNING E. Conversion of sugars to lactic acid derivatives using heterogeneous zeotype catalysts[J]. Science, 2010,328(5978): 602-605. DOI: 10.1126/science.1183990.
[23]WANG A Q, ZHANG T. One-pot conversion of cellulose to ethylene glycol with multifunctional tungsten-based catalysts[J]. Accounts of chemical research, 2013, 46(7):1377-1386. DOI: 10.1021/Ar3002156.
[24]ZHAO H B, HOLLADAY J E, BROWN H, et al. Metal chlorides in ionic liquid solvents convert sugars to 5-hydroxymethylfurfural[J]. Science, 2007, 316(5831):1597-1600. DOI: 10.1126/science.1141199.
[25]VAN ZANDVOORT I, WANG Y H, RASRENDRA C B,et al. Formation, molecular structure, and morphology of humins in biomass conversion: influence of feedstock and processing conditions[J]. Chemsuschem, 2013, 6(9):1745-1758. DOI: 10.1002/cssc.201300332.
[26]YAN X Y, JIN F M, TOHJI K, et al. Hydrothermal Conversion of Carbohydrate Biomass to Lactic Acid[J].AIChE journal, 2010, 56(10): 2727-2733. DOI: 10.1002/Aic.12193.
[27]ESPOSITO D, ANTONIETTI M. Chemical conversion of sugars to lactic acid by alkaline hydrothermal processes[J]. Chemsuschem, 2013, 6(6): 989-992. DOI:10.1002/cssc.201300092.
[28]LI L Y, SHEN F, SMITH R L, et al. Quantitative chemocatalytic production of lactic acid from glucose under anaerobic conditions at room temperature[J].Green chemistry, 2017, 19(1): 76-81. DOI: 10.1039/c6gc02443B.
[29]WANG F W, HUO Z B, WANG Y Q, et al. Hydrothermal conversion of cellulose into lactic acid with nickel catalyst[J]. Research on chemical intermediates, 2011,37(2/5): 487-492. DOI: 10.1007/s11164-011-0274-2.
[30]ZHANG S P, JIN F M, HU J J, et al. Improvement of lactic acid production from cellulose with the addition of Zn/Ni/C under alkaline hydrothermal conditions[J].Bioresource technology, 2011, 102(2): 1998-2003. DOI:10.1016/j.biortech.2010.09.049.
[31]HEDEGAARD R V, LIU L, SKIBSTED L H.Quantification of radicals formed during heating ofβ-lactoglobulin with glucose in aqueous ethanol[J]. Food chemistry, 2015, 167: 185-190. DOI: 10.1016/j.foodchem.2014.06.118.
[32]LIU Y, LUO C, LIU H C. Tungsten trioxide promoted selective conversion of cellulose into propylene glycol and ethylene glycol on a ruthenium catalyst[J].Angewandte chemie international edition, 2012, 51(13):3249-3253. DOI: 10.1002/anie.201200351.
[33]BICKER M, ENDRES S, OTT L, et al. Catalytical conversion of carbohydrates in subcritical water: a new chemical process for lactic acid production[J]. Journal of molecular catalysis a: chemical, 2005, 239(1/2): 151-157.DOI: 10.1016/j.molcata.2005.06.017.
[34]WANG J, YAO G D, JIN F M. One-pot catalytic conversion of carbohydrates into alkyl lactates with Lewis acids in alcohols[J]. Molecular catalysis, 2017,435: 82-90. DOI: 10.1016/j.mcat.2017.03.021.
[35]WANG Y L, DENG W P, WANG B J, et al. Chemical synthesis of lactic acid from cellulose catalysed by lead(II) ions in water[J]. Nature communications, 2013,4: 2141. DOI: 10.1038/Ncomms3141.
[36]Tang Z C, Deng W P, Wang Y L, et al. Transformation of cellulose and its derived carbohydrates into formic and cactic acids catalyzed by Vanadyl cations [J]. Chemsuschem,2014, 7(6): 1557-1567. DOI: 10.1002/cssc.201400150.
[37]LEI X, WANG F F, LIU C L, et al. One-pot catalytic conversion of carbohydrate biomass to lactic acid using an ErCl3catalyst[J]. Applied catalysis a: general, 2014,482: 78-83. DOI: 10.1016/j.apcata.2014.05.029.
[38]NEMOTO K, HIRANO Y, HIRATA K I, et al.Cooperative in-sn catalyst system for efficient methyl lactate synthesis from biomass-derived sugars[J].Applied catalysis B: environmental, 2016, 183: 8-17.DOI: 10.1016/j.apcatb.2015.10.015.
[39]ZHOU L P,WU L, LI H J, et al. A facile and efficient method to improve the selectivity of methyl lactate in the chemocatalytic conversion of glucose catalyzed by homogeneous Lewis acid[J]. Journal of Molecular Catalysis a-Chemical, 2014, 388: 74-80. DOI: 10.1016/j.molcata.2014.01.017.
[40]DOS SANTOS J B, DE ALBUQUERQUE N J A, DE PAIVA E SILVA ZANTA C L, et al. Fructose conversion in the presence of Sn(IV) catalysts exhibiting high selectivity to lactic acid[J]. RSC advances, 2015, 5(110):90952-90959. DOI: 10.1039/c5ra20881E.
[41]DENG W P, WANG P, WANG B J, et al. Transformation of cellulose and related carbohydrates into lactic acid with bifunctional Al(III)-Sn(II) catalysts[J]. Green chemistry,2018, 20(3): 735-744. DOI: 10.1039/C7GC02975F.
[42]DONG W J, SHEN Z, PENG B Y, et al. Selective chemical conversion of sugars in aqueous solutions without alkali to lactic acid over a Zn-Sn-Beta Lewis acid-base catalyst [J]. Scientific Reports, 2016: 1-6. DOI:10.1038/srep26713.
[43]YANG X M, BIAN J J, HUANG J H, et al. Fluoride-free and low concentration template synthesis of hierarchical Sn-Beta zeolites: efficient catalysts for conversion of glucose to alkyl lactate[J]. Green chemistry, 2017, 19(3):692-701. DOI: 10.1039/c6gc02437H.
[44]ZHAO X L, WEN T, ZHANG J J, et al. Fe-Doped SnO2catalysts with both BA and LA sites: facile preparation and biomass carbohydrates conversion to methyl lactate MLA[J]. RSC advances, 2017, 7(35): 21678-21685.DOI: 10.1039/c7ra01655G.
[45]WANG F F, LIU J, LI H, et al. Conversion of cellulose to lactic acid catalyzed by erbium-exchanged montmorillonite K10[J]. Green chemistry, 2015, 17(4): 2455-2463. DOI:10.1039/c4gc02131B.
[46]LI H, REN H F, ZHAO B W, et al. Production of lactic acid from cellulose catalyzed by alumina-supported Er2O3catalysts[J]. Research on chemical intermediates,2016, 42(9): 7199-7211. DOI: 10.1007/s11164-016-2529-4.
[47]JI N, ZHANG T, ZHENG M Y, et al. Direct catalytic conversion of cellulose into ethylene glycol using nickel-promoted tungsten carbide catalysts[J]. Angewandte chemie international edition, 2008, 47(44): 8510-8513.DOI: 10.1002/anie.200803233.
[48]ZHENG M Y, WANG A Q, JI N, et al. Transition metal-tungsten bimetallic catalysts for the conversion of cellulose into ethylene glycol[J]. Chemsuschem, 2010,3(1): 63-66. DOI: 10.1002/cssc.200900197.
[49]TAI Z J, ZHANG J Y, WANG A Q, et al. Catalytic conversion of cellulose to ethylene glycol over a low-cost binary catalyst of raney Ni and tungstic acid[J].Chemsuschem, 2013, 6(4): 652-658. DOI: 10.1002/cssc.201200842.
[50]CHAMBON F, RATABOUL F, PINEL C, et al. Cellulose hydrothermal conversion promoted by heterogeneous Bronsted and Lewis acids: remarkable efficiency of solid Lewis acids to produce lactic acid[J]. Applied catalysis B: environmental, 2011, 105(1/2): 171-181. DOI:10.1016/j.apcatb.2011.04.009.
[51]YANG L S, SU J, CARL S, et al. Catalytic conversion of hemicellulosic biomass to lactic acid in pH neutral aqueous phase media[J]. Applied catalysis B: environmental,2015, 162: 149-157. DOI: 10.1016/j.apcatb.2014.06.025.
[52]SHI F, LIU J X, HUANG X, et al. Direct Conversion of Cellulose into Ethyl Lactate in Supercritical Ethanol-Water Solutions[J]. Chemsuschem, 2015, 9(1): 36-41.DOI: 10.1002/cssc.201500855.
[53]WATTANAPAPHAWONG P, REUBROYCHAROEN P,YAMAGUCHI A. Conversion of cellulose into lactic acid using zirconium oxide catalysts[J]. RSC advances,2017, 7(30): 18561-18568. DOI: 10.1039/c6ra28568F.
[54]WATTANAPAPHAWONG P, SATO O, SATO K, et al.Conversion of cellulose to lactic acid by using ZrO2-Al2O3catalysts[J]. Catalysts, 2017, 7(7): 221.DOI: 3390/catal7070221.
[55]COMAN S M, VERZIU M, TIRSOAGA A, et al.NbF5-AlF3catalysts: design, synthesis, and application in lactic acid synthesis from cellulose[J]. ACS catalysis,2015, 5(5): 3013-3026. DOI: 10.1021/acscatal.5b00282.
[56]QIAN X H. Mechanisms and Energetics for brønsted acid-catalyzed glucose condensation, dehydration and isomerization reactions[J]. Topics in catalysis, 2012,55(3/4): 218-226. DOI: 10.1007/s11244-012-9790-6.
[57]CHOUDHARY V, MUSHRIF S H, HO C, et al. Insights into the interplay of lewis and brønsted acid catalysts in glucose and fructose conversion to 5-(Hydroxymethyl)-furfural and levulinic acid in aqueous Media[J]. Journal of the American chemical society, 2013, 135(10):3997-4006. DOI: 10.1021/Ja3122763.
[58]MUSHRIF S H, VARGHESE J J, VLACHOS D G.Insights into the Cr(III) catalyzed isomerization mechanism of glucose to fructose in the presence of water using abinitiomolecular dynamics[J]. Physical chemistry chemical physics, 2014, 16(36): 19564-19572.DOI: 10.1039/c4cp02095B.
[59]TANG J Q, GUO X W, ZHU L F, et al. Mechanistic study of glucose-to-fructose isomerization in water catalyzed by [Al(OH)2(aq)]+[J]. ACS catalysis, 2015,5(9): 5097-5103. DOI: 10.1021/acscatal.5b01237.
[60]NGUYEN H, NIKOLAKIS V, VLACHOS D G.Mechanistic insights into lewis acid metal Salt-Catalyzed glucose chemistry in aqueous solution[J]. ACS catalysis,2016, 6(3): 1497-1504. DOI: 10.1021/acscatal.5b02698.
[61]ROMÁN-LESHKOV Y, MOLINER M, LABINGER J A,et al. Mechanism of glucose isomerization using a solid lewis acid catalyst in water[J]. Angewandte chemie international edition, 2010, 49(47): 8954-8957. DOI:10.1002/anie.201004689.
[62]CHOUDHARY V, PINAR A B, LOBO R F, et al.Comparison of homogeneous and heterogeneous catalysts for glucose-to-fructose isomerization in aqueous media[J]. Chemsuschem, 2013, 6(12): 2369-2376. DOI:10.1002/cssc.201300328.
[63]BERMEJO-DEVAL R, GOUNDER R, DAVIS M E.Framework and extraframework tin sites in zeolite beta react glucose differently[J]. ACS catalysis, 2012, 2(12):2705-2713. DOI: 10.1021/cs300474x.
[64]LI G N, PIDKO E A, HENSEN E J M. Synergy between Lewis acid sites and hydroxyl groups for the isomerization of glucose to fructose over Sn-containing zeolites: a theoretical perspective[J]. Catalysis science &technology, 2014, 4(8): 2241-2250. DOI: 10.1039/c4cy00186A.
[65]RAI N, CARATZOULAS S, VLACHOS D G. Role of silanol group in Sn-Beta zeolite for glucose isomerization and epimerization reactions[J]. ACS catalysis, 2013,3(10): 2294-2298. DOI: 10.1021/cs400476n.
[66]YANG G, PIDKO E A, HENSEN E J M. The Mechanism of glucose isomerization to fructose over Sn-BEA zeolite: a periodic density functional theory study[J].Chemsuschem, 2013, 6(9): 1688-1696. DOI: 10.1002/cssc.201300342.
[67]LI G N, PIDKO E A, HENSEN E J M. A periodic DFT study of glucose to fructose isomerization on tungstite(WO3·H2O): influence of group IV-VI dopants and cooperativity with hydroxyl groups[J]. ACS catalysis,2016, 6(7): 4162-4169. DOI: 10.1021/acscatal.6b00869.
