营养盐限制对利玛原甲藻生长和产毒的影响
2018-05-09曾玲,龙超,文菁
曾 玲,龙 超,文 菁
(1.岭南师范学院化学化工学院,广东 湛江 524048;2.中国科学院南海海洋研究所/海洋生物资源可持续利用重点实验室,广东 广州 510301;3.岭南师范学院生命科学与技术学院,广东 湛江 524048)
有害藻华 (Harmful Algal Blooms,HABs)破坏了生态平衡,对人类健康和渔业经济等造成影响,是世界范围内备受关注的海洋环境问题[1]。利玛原甲藻(Prorocentrum lima)是一种世界范围内广泛分布且能暴发赤潮[2]的底栖附生甲藻,其产生的腹泻性贝毒(主要成分为冈田酸,Okadaic acid,OA)被鱼、虾、贝等摄食后在体内累积,通过食物链传递至人类,引起腹泻性中毒。随着大规模赤潮的频繁暴发和食用海产品导致中毒事件的发生,微藻的生长和产毒机制日益受到重视。研究微藻生长条件及其产毒机制不但有利于减少赤潮与毒素的环境公害,而且可使其结构独特的次生代谢产物为人类所利用,对保障水产品安全和人类生命安全具有重要意义[3]。
影响微藻生长和代谢产物的主要因子有氮、磷等营养元素。研究表明,氮、磷营养盐浓度对微藻的生长和产毒有显著影响[4-6]。氮、磷浓度与藻细胞生长速率往往呈正相关关系。然而,氮、磷浓度过高或过低均对藻细胞生长具有显著的抑制效应[7],低浓度氮、磷往往有利于毒素的合成和累积[4,8-9]。有关营养盐对P.lima生长和产毒影响的研究主要集中在温带种[4,9-14]。目前尚未有关于营养盐对热带P.lima生长和产毒影响的研究。此外,前人在研究氮、磷对 P.lima 生长和产毒的影响中[4,9,14],用的是f/2配方,该配方氮源只有NaNO3没有NH4Cl,或者是单独以NaNO3、NH4Cl作为氮源进行研究。本研究采用改良K配方(含NaNO3和 NH4Cl)[15],通过设定氮限制(1/2-N,1/4-N,1/8-N,1/16-N,1/32-N)和磷限制(1/2-P,1/4-P,1/8-P,1/16-P,1/32-P),对1株来自三亚海域的热带P.lima生长和产毒的影响进行研究。
1 材料与方法
1.1 藻培养
P.lima 分离自海南三亚(18°14′N ,109°31′E),用改良K配方的培养液进行分离纯化培养,试验于中国科学院南海海洋研究所海洋生物资源可持续利用重点实验室进行。培养温度28(±1)℃,光暗周期13L∶11D,盐度30‰,光源为白色日光灯,光照强度约为4 000 lx。
1.2 试验方法
1.2.1 N、P浓度设置 以改良K配方中的N、P营养盐为基础,固定N浓度,改变P浓度进行试验;同理,固定P浓度,改变N浓度进行试验。分别设置6个浓度梯度:1、1/2、1/4、1/8、1/16、1/32(表1)。取处于指数生长期、生长状况良好的藻细胞,离心,去掉原培养液,加入灭菌海水洗涤沉淀藻细胞,离心,重复上述步骤,共洗涤藻细胞3次,以除去原培养液中的营养盐。将洗涤好的藻细胞接种于800 mL培养液中,接种密度650 cells/mL。试验藻种培养所用培养液中除N、P浓度外,其余元素与K培养液相同。
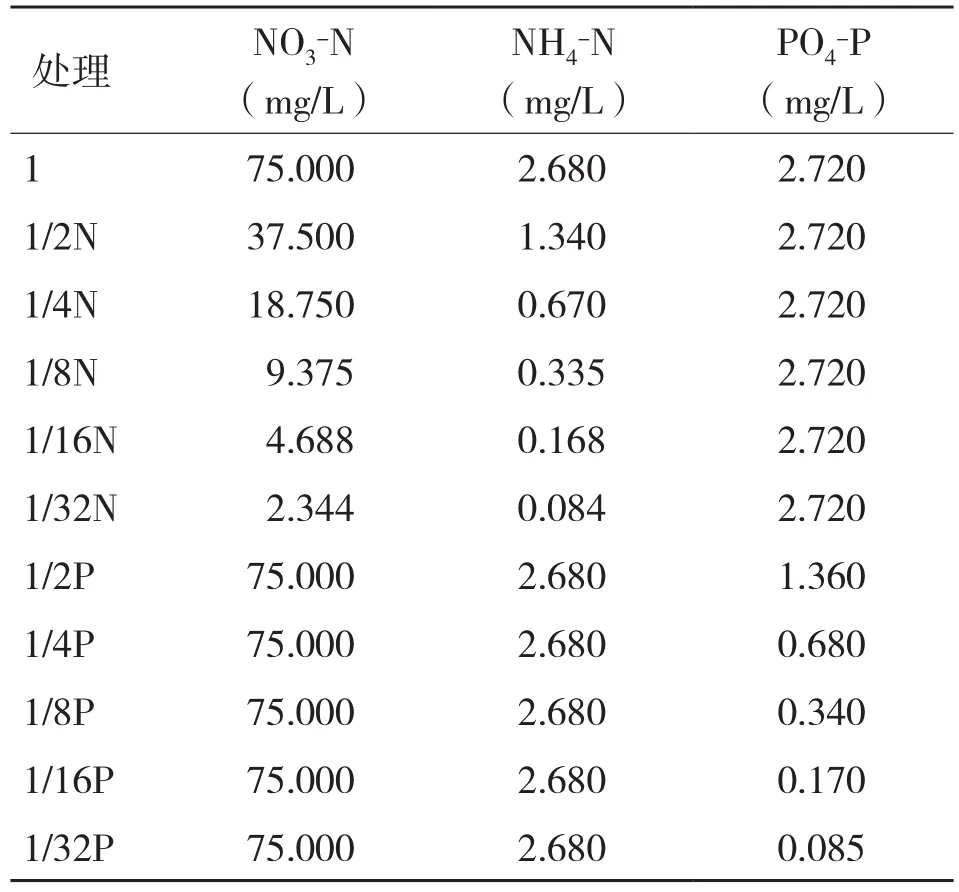
表1 N、P浓度梯度的设置
1.2.2 藻密度的测定和生长率的计算 每天在同一时间段取样。藻细胞用Lugol试液固定后,于Nikon TS100倒置显微镜下进行细胞计数。每个样品计数3次,取平均值,根据计数值绘制生长曲线,并根据Guillard的单细胞藻种群生长公式[16]计算藻细胞生长率:
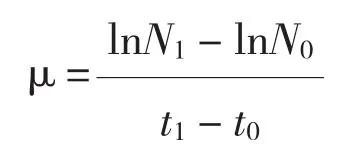
式中,N0为藻细胞初始密度,Nt为t天后藻细胞密度,t为培养天数。
1.2.3 残留N、P含量分析 海水的营养盐浓度用注射式营养盐自动分析仪(Lachat Inc.,QuichChem 8500,USA)测定,N通过镉柱将硝氮还原为亚硝氮,再用磺胺和N-1-盐酸奈乙二胺显色法进行测定;的测定采用靛酚蓝分光光度法;的测定采用以抗坏血酸为还原剂的钼蓝显色法。
1.2.4 叶绿素a含量测定 吸取6 mL充分混匀后的藻液至10 mL离心管,5 000 r/min离心5 min,弃上清,加入6 mL 80%丙酮,混匀,置于4℃冰箱黑暗抽提24 h,5 000 r/min离心10 min,取上清进行测定。测定波长为663、645 nm,以80%丙酮溶液作参比,根据公式Ca =12.71A663-2.59A645,计算叶绿素a含量。
1.2.5 毒素含量测定 毒素提取参考Quilliam等[17]的方法进行。在收集有藻细胞的离心管中加入0.5 mL Tris-HCl和1 mL甲醇,超声波提取1 min,3 500 r/min离心10 min,将上清转移至另一干净离心管;往原离心管加1 mL甲醇,漩涡振荡器上震荡5 min,然后3 500 r/min离心10 min,收集上清;重复上一步操作,共得离心上清液3.5 mL。适当稀释后用美国的Aabraxis公司的冈田酸(OA)试剂盒进行毒素检测。
试验数据采用SPSS软件进行差异显著性、相关性分析。
2 结果与分析
2.1 N、P在培养液中的残留浓度
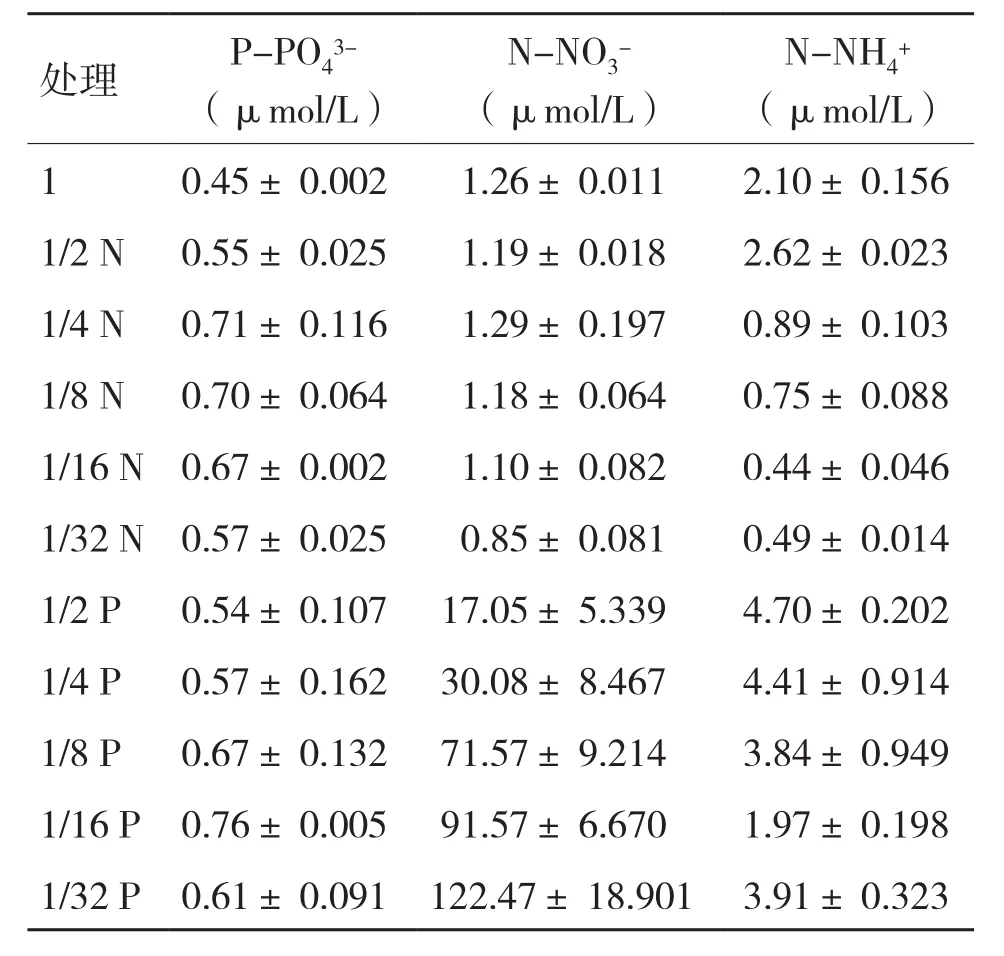
表2 N、P在培养液中的残留浓度
2.2 N、P限制对P.lima生长的影响
2.2.1 N、P限制对生长曲线和细胞密度的影响 N限制处理P.lima的生长曲线如图1a所示。各培养组藻细胞在接种后即进入指数生长期,随着N浓度限制程度的增大,细胞终密度减小,各生长曲线依次走低,呈现梯度。最佳生长是对照组,生长曲线位于最上层,细胞终密度在6个处理中最大,约3×104cells/mL。细胞终密度随着N浓度限制的增强而减小 (3×104~0.65×104cells/mL;P< 0.001),1/32N 限制的培养组增殖程度最小,稳定期藻密度停留在较低水平(0.65×104cells/mL),细胞终密度只有对照的1/5。随着N浓度的减小,指数期相应变短。
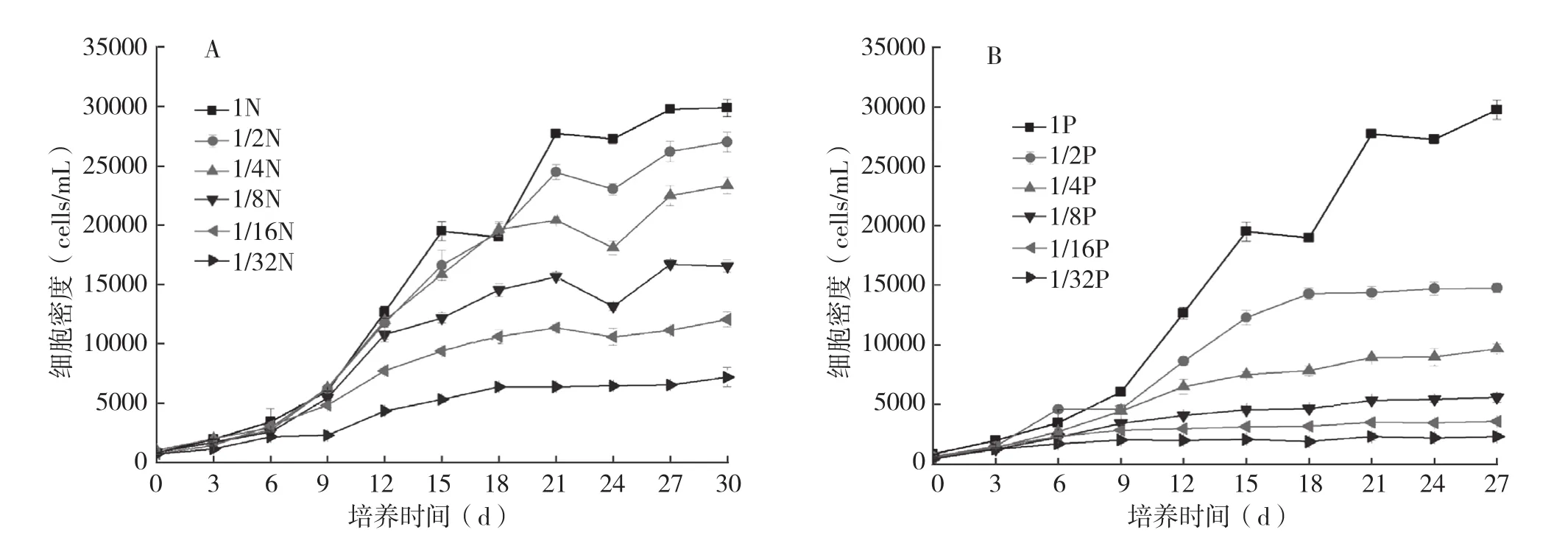
图1 营养限制条件下P.lima的生长曲线
P限制处理P.lima的生长曲线如图1B所示。随着P浓度限制程度的增大,细胞终密度逐级减小(3×104~0.23×104cells/mL,P<0.001),各生长曲线依次走低,呈现梯度。藻细胞增殖程度最低的是1/32P,生长曲线在第6 d后几乎与横坐标平行,细胞终密度停留在0.23×104cells/mL,是1/32N处理(0.65×104cells/mL)的1/3,仅达到对照(3×104cells/mL)的1/13。P限制对P.lima生长影响显著,1/2P~1/32P藻密度急剧下降(下降幅度>50%,P<0.001)。
同一限制水平下,N限制处理的细胞终密度比P限制的高。数据分析表明,细胞密度与N、P浓度密切相关,皮尔森相关系数分别为0.862、0.998,显然P浓度与细胞终密度的关系更密切。
2.2.2 N、P限制对生长速率的影响 不同营养限制条件下P.lima的生长速率见图2。基于每次藻细胞计数值绘制的生长曲线(图2A、图2B),所有处理的P.lima生长速率均随着培养时间的延长波动下降。N限制条件下,不同处理生长速率持续下降的时间不同,对照出现在培养12 d,1/2N、1/4N和1/8N出现在培养9 d,1/16N出现在培养6 d,据此推测限制程度越大,生长速率持续下降的时间越早。1/32N在培养9 d生长速率几乎为0,说明培养6~9 d细胞分裂尚未完成,未能出现增长。
P限制条件下,除了对照和1/2P处理,其余各处理的P.lima生长速率均在培养3 d开始急剧下降,1/16P和1/32P在培养12 d接近0,1/4P和1/8P在培养18 d接近0,1/2P在培养21 d接近0,而对照的P.lima生长速率接近0的时间是培养24 d,说明随着P限制程度的增大,藻细胞停止生长的时间提前。
整个生长周期的平均生长速率如图2C、图2D所示。N限制条件下,随着限制程度增大各处理的P.lima生长速率逐级降低(0.128~0.082 /d),差异极显著。P限制条件下,生长速率范围为0.047~0.133 /d,也随着营养限制的增大而逐级减小,各处理结果间差异极显著。平均生长速率与N、P浓度密切相关,皮尔森相关系数分别为0.857、0.905。
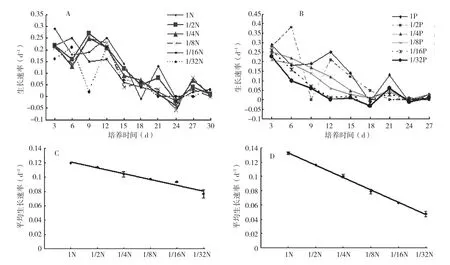
图2 不同营养限制条件下P.lima的生长速率
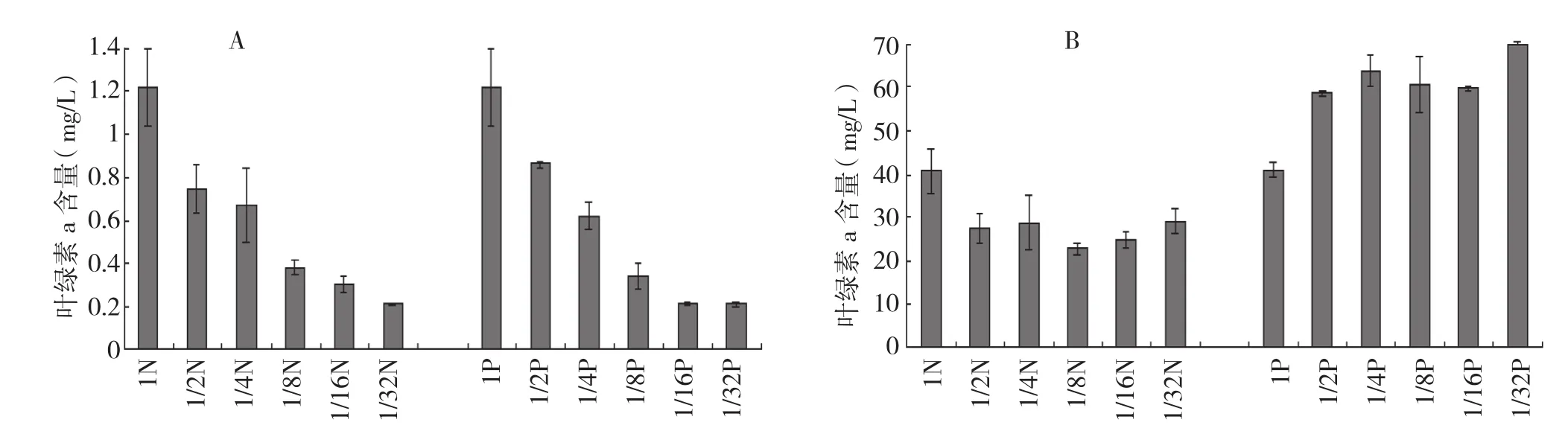
图3 N、P限制下单位体积叶绿素a含量(A)和单位细胞叶绿素a含量(B)
2.2.3 N、P限制对叶绿素a含量的影响 对各处理稳定期培养液中的叶绿素a含量进行测定,结果(图3A)表明,对照的叶绿素a含量最高(1.217 mg/L),1/32限制处理最低(1/32N:0.209 mg/L;1/32P:0.161 mg/L),随着N、P浓度的逐级减小,各处理藻液中单位体积叶绿素a含量逐级下降。单位体积叶绿素a含量与N、P浓度密切相关(P< 0.05,皮尔森相关系数:N限制0.975,P限制 0.972),说明培养液中N、P浓度受限制会影响藻细胞中叶绿素a的含量。单位体积叶绿素a含量与细胞终密度密切相关(P< 0.05,皮尔森相关系数:N限制0.931,P限制 0.971)。
单位细胞叶绿素a含量如图3B所示。N限制处理(1/2N~1/32N)单位细胞叶绿素a含量低于对照,差异不显著。P限制条件下,单位细胞叶绿素a含量高于对照,差异极显著,其中1/32P的浓度最高 (70.02 pg/cell)。N限制处理单位细胞叶绿素a 含量显著低于P限制处理,可能是因为N是叶绿素合成的重要元素,N缺乏阻止了叶绿素a的合成。
2.3 N、P限制对P.lima产毒的影响
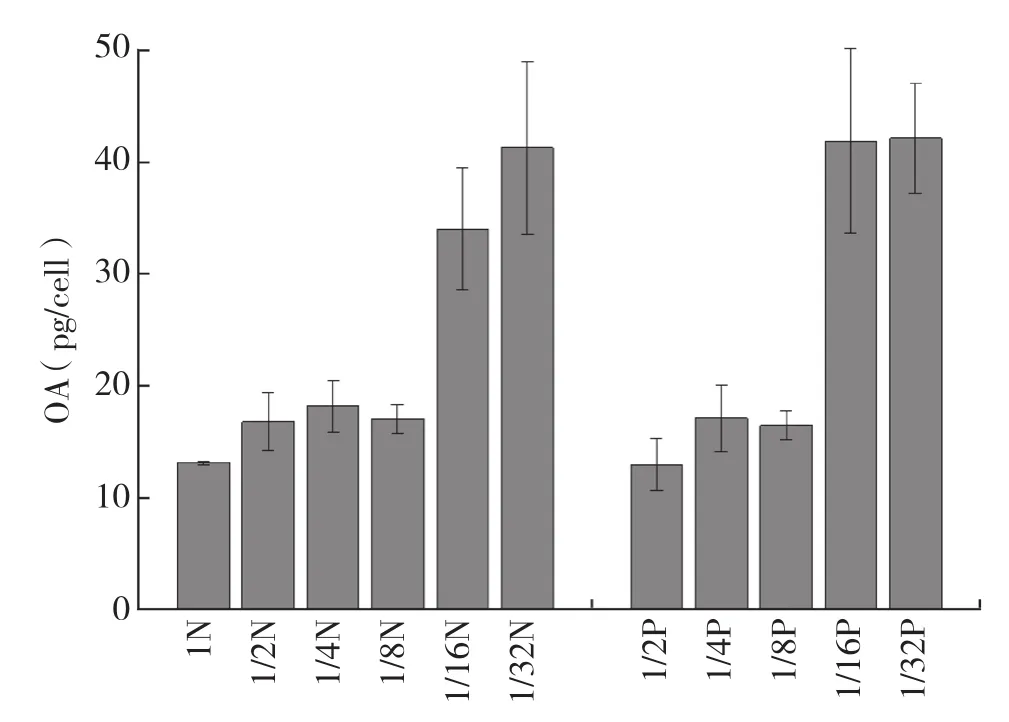
图4 N、P处理下P.lima单位细胞毒素含量
由图4可知,N限制条件下,各处理(1/2N~1/32N)的OA含量均比对照高,其中含量最高的是1/32N(41.30 pg/cell),比对照(13.18 pg/cell)高2倍多;前3个处理(1/2N、1/4N和1/8N)毒素升高幅度不明显,1/16N和1/32N的OA含量大幅度升高,导致N限制条件下各处理结果差异极显著。P限制条件下,1/2P处理的OA含量(13.02 pg/cell)与对照(13.18 pg/cell)几乎相等,其余处理均比对照高,其中1/16P(41.93 pg/cell)和 1/32P(42.16 pg/cell)极显著高于对照,其OA含量是对照的3倍多。前3个处理(1/2P、1/4P和1/8P)和对照之间OA含量差异不显著;后2个处理(1/16P和1/32P)之间差异不显著;但前4个处理和后2个处理之间差异极显著。OA浓度与生长速率呈负相关,N限制、P限制下的斯皮尔曼等级相关系数分别为-0.943、-0.886,即当生长速率下降时OA浓度升高。N限制处理的OA含量和P限制处理有两个共同点:(1)1/16和1/32处理OA含量大幅度上升;(2)OA最高含量均出现在1/32处理。
3 结论与讨论
3.1 N、P残留的浓度
N、P残留的浓度揭示了藻细胞对其吸收的状况,残留越多,吸收越少,反之,残留越少,吸收越多。本研究结果表明,随着P限制的增强,的残留量升高,这与 Vanucci等[8]的研究结果一致,即当N面临强烈的P限制时,培养液中残留的N会增多。P限制条件下,残留的含量(< 4.7 μmol/L)远低于含量(>17.05 μmol/L),这可能是吸收的比快的原因[4],的吸收发生在被消耗之后[18]。与其他N源相比,P.lima和其他原甲藻更倾向于吸收一般来说,对的偏好在底栖鞭毛藻中是常见的,因为是在底栖生境中随时可用的还原性氮源[18,21],但浓度过高会对 P.lima 有毒害作用,降低其生长速率和产毒量[4]。
3.2 N、P限制对叶绿素a含量的影响
N是叶绿素的主要成分,直接或间接影响光合作用;P 是构成ATP、GTP、核酸、磷脂、辅酶的最基本元素。适宜的N、P浓度有利于藻细胞生长和叶绿素a含量的增加[22];浓度过低会对藻细胞生长和叶绿素a的含量造成影响[7,22]。本研究表明,随着 N、P 浓度的降低,藻生长受限,单位体积叶绿素a含量减少。除了N、P浓度会对叶绿素a含量造成影响外,光照强度、CO2和pH值、铵氮等也是影响叶绿素a含量的因素。低光照强度会诱导细胞产生更多的叶绿素 a[4];Aikman 等[19]研究发现,在低CO2和高pH值的条件下,P.hoffmannianum的叶绿素a含量降低,CO2的缺乏抑制了光合作用的合成;过高的铵氮浓度对藻细胞有毒害作用,抑制藻的光合活性和氧化反应,导致叶绿素a含量降低[4]。
N、P 质量浓度对绿色颤藻(Oscillatoria chlorine)叶绿素a质量浓度的影响显著,其中主要影响因子是N[22]。本研究发现,N限制处理的单位细胞叶绿素a 含量远低于P限制处理,这可能是由于叶绿素a的分子结构中不含有P元素,P不像N那样直接参叶绿素a的合成,因此,当培养液中N受到限制,叶绿素a合成减少,而P限制条件下,N源充足,有足够的N用于叶绿素a的合成。同一培养条件下,不同P.lima藻株单位细胞叶绿素a含量存在差异,Morton等[23]研究表明,来自N位点的A249 藻株叶绿素a含量显著高于其余5种藻株,本研究中对照的叶绿素a含量与上述研究的A249无显著差异,高于Varkitzi等和Nascimento等研究的 P.lima 藻株[4,24]。
3.3 N、P限制对P.lima生长的影响
微藻的生长依赖于营养物质的供给[4,9]。N和P是微藻生长所必需的主要元素,不同N、P 营养盐水平对微藻生长影响显著[7,25-26]。N、P起始浓度影响微藻的生长,与藻细胞生长速率往往呈正相关[4,7]。过高或过低的N、P浓度对藻细胞生长表现出显著的抑制效应[7]。本研究表明,随着N、P起始浓度的降低,P.lima各生长指标(生长速率、细胞终密度、单位体积叶绿素a含量)下降,表现出明显的生长抑制。Vanucci等[9]的研究结果也证实了低N、P浓度会抑制P.lima的生长。
营养盐限制尤其是P 限制能够显著降低藻细胞的比生长速率和细胞密度,缩短藻细胞指数生长期和稳定期的持续时间[26]。网状原角藻的生长更多地受P 限制的影响而不是N 限制[26-28],在本研究及其他一些DSP产毒藻[29-31]和 PSP产毒藻[32-33]中亦证明了 P对藻的生长影响比N更大。然而,与上述藻不同,N对Ostreopsis cf.ovata生长的影响比P大[34]。N限制对铜绿微囊藻(Microcystis aeruginosa)的生长有明显抑制作用,而磷限制则没有[35]。也有些藻对N、P营养限制均不敏感,如惠氏微囊藻在不同N、P起始浓度下,除了低磷浓度(1/100)处理外,其余浓度处理的生长速率并未表现出显著影响[7]。
3.4 N、P限制对P.lima 产毒的影响
甲藻对营养物质吸收的能力低于其他藻类,在营养缺乏条件下,其竞争能力会比其他硅藻和无毒甲藻差,而毒素的产生可能是甲藻对低营养利用率的一种补偿性竞争策略,可以作为对摄食浮游藻类生物的威慑,防止被摄食;当营养不平衡时,毒素作为营养储存化合物,可以减轻某些过剩营养物质对藻造成的不利影响[26]。有研究表明,在营养平衡的条件下,藻类产毒量往往较低;而当营养失衡,尤其低N、P浓度条件能够刺激藻类产毒增加[4,8-9],本研究结果也支持上述观点。低P浓度条件下比低N 浓度更能促进毒素的累积[9,26,36]。胡蓉等[37]研究发现,培养液中不添加P时,链状裸甲藻的产毒量最大、达3.3 pg/cell,P限制可以促进链状裸甲藻细胞中PSP毒素的产生。P浓度对2种甲藻塔玛亚历山大藻(Alexandrium tamarense)和微小亚历山大藻(Alexandtium minutum)的生长和产毒能力均有显著性影响,此两种藻均在0 μmol/L 磷浓度下产毒能力最高[38]。DSP 是一类聚醚类或大环内酯类化合物,其结构中不含磷,磷盐直接参与DSP生物合成的可能性很小。磷盐对DSP合成的影响可能与该藻类在磷盐条件下的生长状况有关[39],它可能通过影响微囊藻的生长或者其他途径来影响藻毒素的合成[40]。
虽然 N 限制会促使 DSP 产量增加[4,9,12],但会抑制PSP的产量[31-32]和Ostreopsis cf.ovata的毒素产量[34],这是由于毒素组成元素不同,对营养限制的反应也有所不同[34]。Van等[41]研究发现,N和P限制对富含N的毒素会产生相反效果:N限制条件下毒素含量下降,P限制条件下毒素含量增加。N限制对铜绿微囊藻的产毒有明显抑制作用,而P限制对其产毒影响不大[35]。然而,无论N限制还是P限制对富含C的毒素具有相同的作用效果,均促进了毒素的产生[41],因为在营养限制的条件下,相对过剩的能量和新合成的有机碳不能用于细胞生长,因而被分流合成富含C的分子如毒素。
在所有营养限制条件下,当细胞生长速度减慢时(进入稳定期),OA的产量均在增加,这是因为虽然细胞生长速率减慢,但OA生成的速率不变,从而使得OA在P.lima中累积,这表明OA的产量受生长的调节[4],这一结论在其他有毒藻类[42]中也得到证实。本研究中,营养限制越强的处理组生长速率下降得越快,稳定期到来的时间越提前,在同样培养时间的前提下,OA累积时间越长,因此,限制最强的1/32处理组获得的OA含量最高。
采用不同培养条件对P.lima产毒研究的结果存在差异。Vanucci等[9]研究中的培养条件为:温度20℃,光暗周期16L∶8D,盐度25,90 μmol/m2s,f/2培养基,其结果表明,在N限制条件下,从低限制(1/3N)向强限制(1/50N),OA含量升幅不明显;P限制下(1/3P~1/50P),OA的峰值出现在1/20P,而不是限制最强的1/50P。本研究〔温度28(±1)℃,光暗周期13 L∶11 D,盐度30,光照强度4 000 lx,改良K培养基〕则发现在N、P限制条件下,从低限制(1/2)向强限制(1/32),OA含量增幅明显,增幅最大的处理(1/32)比限制程度最低的处理(1/2)高出1倍多。毒素的产生受细胞生理条件的调控,这些生理条件受到多种因素的影响(如营养限制),DSP毒素的大量产生可能是一种藻细胞对生理不平衡的非特异性细胞应答[9]。
参考文献:
[1]Smith V H,Schindler D W.Eutrophication science:where do we go from here?[J].Trends in ecology & evolution,2009,24(4):201-207.
[2]李兰涛,叶健欣,叶宁,等.利玛原甲藻对湛江港多种鱼虾贝的毒性研究[J].水产科学,2011,30(9):547-550.
[3]曾玲,文菁,徐春曼.氮,磷对微藻生长和产毒的影响[J].湛江师范学院学报,2011,32(6):103-108.
[4]Varkitzi I,Pagou K,Graneli E,et al.Unbalanced N:P ratios and nutrient stress controlling growth and toxin production of the harmful dinoflagellate Prorocentrum lima(Ehrenberg)Dodge[J].Harmful Algae,2010,9(3):304-311.
[5]Lim P T,Leaw C P,Kobiyama A,et al.Growth and toxin production of tropical Alexandrium minutum Halim(Dinophyceae)under various nitrogen to phosphorus ratios[J].Journal of applied phycology,2010,22(2):203-210.
[6]Dolman A M,Rücker J,Pick F R,et al.Cyanobacteria and cyanotoxins:the influence of nitrogen versus phosphorus[J].PloS one,2012,7(6):1-14.
[7]孙凯峰,肖爱风,刘伟杰,等.氮磷浓度对惠氏微囊藻和斜生栅藻生长的影响[J].南方水产科学,2017,13(2):69-76.
[8]龙超,龙丽娟.氮,磷对克氏前沟藻三亚株生长及产毒特性的影响[J].热带海洋学报,2012,31(4):117-123.
[9]Vanucci S,Guerrini F,Milandri A,et al.Effects of different levels of N-and P-deficiency on cell yield,okadaic acid,DTX-1,protein and carbohydrate dynamics in the benthic dinoflagellate Prorocentrum lima[J].Harmful Algae,2010,9(6):590-599.
[10]Morliaix M,Lassus P.Nitrogen and phosphorus effects upon division rate and toxicity of Prorocentrum lima(Ehrenberg)Dodge [J].Cryptogam Algol,1992,13(3):187-195.
[11]Tomas C R,Baden D G.The inf l uence of phosphorus source on the growth and cellular toxin content of the benthic dinof l agellate Prorocentrum lima[A].Toxic Phytoplankton Blooms in the Sea[C].Amsterdam:Elsevier,1993:565-570.
[12]Mclachlan J L,Marr J C,Conlon-Kelly A,et al.Effects of nitrogen concentration and cold temperature on DSP-toxin concentration in the dinof l agellate Prorocentrum lima(Prorocentrales.Dinophycae)[J].Toxins,1994,2:263-270.
[13]Sohet K,Pereira A,Braekman J C,et al.Growth and toxicity of Prorocentrum lima(Ehrenberg)Dodge in different culture media:effect of humic acids and organic phosphorus//Harmful Marine Algal Blooms[C].Nantes:LASSUS P,1995:669-674.
[14]钟娜,杨维东,刘洁生,等.不同氮源对利玛原甲藻(Prorocentrum lima)生长和产毒的影响[J].环境科学学报,2008,28(6):1186-1191.
[15]Keller M D,Guillard R R L.Factors significant to marine dinoflagellate culture//Anderson D M,White A W,Baden D G.Proceedings of the Third International Conference on Toxic Dinoflagellates[M].Elsevier,New York,1985:113-116.
[16]Guillard R R L.Division rates//Handbook of Phycological Culture Methods and Growth Measurements[M].Cambridge:Cambridge University Press,1973:289-311.
[17]Quilliam M A.Chemical methods for lipophilic shellf i sh compounds//Manual on Harmful Marine Microalgae[C].Paris:UNESCO publ,2003:211-245.
[18]Pan Y,Cembella A D,Quilliam M A.Cell cycle and toxin production in the benthic dinof l agellate Prorocentrum lima[J].Mar Biol,1999,134:541-549.
[19]Aikman K E,Tindall D R,Morton S L.Physiology and potency of the dinof l agellate Prorocentrum hoffmanianum during the complete growth cycle//Toxic Phytoplankton Blooms in the Sea[C].New York:Elsevier,1993:463-468.
[20]Fan C,Glibert P M,Burkholder J M.Characterization of the aff i nity for nitrogen,uptake kinetics,and environmental relationships for Prorocentrum minimum in natural blooms and laboratory cultures[J].Harmful Algae,2003,2:283-299.
[21]Glibert P M,Burkholder J M,Kana T M.Recent insights about relationships between nutrient availability,forms,and stoichiometry,and the distribution,ecophysiology,and food web effects of pelagic and benthic Prorocentrum species[J].Harmful Algae,2012,14:231-259.
[22]李活,贺春花,黄翔鹄,等.氮,磷,铁质量浓度对绿色颤藻生长的限制性条件[J].南方水产科学,2015,11(3):80-87.
[23]Morton S L,Tindall D R.Morphological and biochemical variability of the toxic dinof l agellate Prorocentrum lima isolated from three locations at Heron Island[J].J Phycol,1995,31:914-921.
[24]Nascimento S M,Purdie D A,Morris S.Morphology,toxin composition and pigment content of Prorocentrum lima strains isolated from a coastal lagoon in southern UK[J].Toxicon,2005,45:633-649.
[25]沈盎绿,李道季.不同营养盐水平对东海原甲藻和米氏凯伦藻生长的影响[J].海洋渔业,2016,38(4):415-423
[26]高春蕾,孙萍,贾智慧,等.温度和营养盐限制对网状原角藻生长与产毒的影响[J].生态学报,2017,37(12):4217-4226.
[27]Röder K,Hantzsche F M,Gebühr C,et al.Effects of salinity,temperature and nutrients on growth,cellular characteristics and yessotoxin production of Protoceratium reticulatum[J].Harmful Algae,2012,15:59-70.
[28]Mitrovic S M,Amandi M F,McKenzie L,et al.Effects of selenium,iron and cobalt addition to growth and yessotoxin production of the toxic marine dinoflagellate Protoceratium reticulatum in culture[J].Journal of Experimental Marine Biology and Ecology,2004,313(2):337-351.
[29]Guerrini F,Ciminiello P,Dell A C,et al.Influence of temperature,salinity and nutrient limitation on yessotoxin production and release by the dinoflagellate Protoceratium reticulatum in batch-cultures[J].Harmful Algae,2007,6(5):707-717.
[30]Rodriguez J J G,Mirron A S,Garcia M C C,et al.Macronutrients requirements of the dinoflagellate Protoceratium reticulatum[J].Harmful Algae,2009,8(2):239-246.
[31]Rodriguez J J G,Mirron A S,Camacho F G,et al.Culture of dinoflagellates in a fed-batch and continuous stirred-tank photobioreactors:growth,oxidative stress and toxin production[J]. Process Biochemistry,2010,45(5):660-666.
[32]John E H,Flynn K J.Growth dynamics and toxicity of Alexandrium fundyense(dinophyceae):the effect of changing N:P supply ratios on internal toxin and nutrient levels[J].Journal of Phycology,2000,35:11-23.
[33]John E H,Flynn K J.Modelling changes in paralytic shellfish toxin content of dinoflagellates in response to nitrogen and phosphorus supply[J].Marine Ecology Progress Series,2002,225:147-160.
[34]Vanucci S,Pezzolesi L,Pistocchi R,et al.Nitrogen and phosphorous limitation effects on cell growth,biovolume,and toxin production in Ostreopsis cf.Ovata[J].Harmful algae,2012,15:78-90.
[35]代瑞华,刘会娟,曲久辉,等.氮磷限制对铜绿微囊藻生长和产毒的影响[J].环境科学学报,2008,28(9):1739-1744.
[36]Markou G.Alteration of the biomass composition of Arthrospira(Spirulina)platensis under various amounts of limited phosphorus[J].Bioresource Technology,2012,116:533-535.
[37]胡蓉,徐艳红,张文,等.N,P,Mn和Fe对链状裸甲藻生长和产毒的影响[J].海洋环境科学,2012,31(2):167-172.
[38]黄世玉,王雪虹,张丽莉.磷浓度对2种有毒亚历山大藻生长和产毒力的影响[J].水生态学杂志,2012,33(1):107-111.
[39]杨维东,钟娜,刘洁生,等.不同磷源及浓度对利玛原甲藻生长和产毒的影响研究[J].环境科学,2008,29(10):2760-2765.
[40]严杨蔚,代瑞华,刘燕,等.氮和磷对有害藻类生长及产毒影响的研究进展[J].环境与健康杂志,2013,30(4):358-362.
[41]Van de Waal D B,Smith V H,Declerck S A J,et al.Stoichiometric regulation of phytoplankton toxins[J].Ecology letters,2014,17(6):736-742.
[42]Granéli E,Flynn K.Chemical and physical factors influencing toxin content[M].Ecology of harmful algae.Springer,Berlin,Heidelberg,2006:229-241.
