2型糖尿病合并急性脑梗死患者血清VE-cadherin和MCP-1的临床意义
2018-05-09陈擘璨
赵 丽, 陈擘璨
随着生活水平的日益提高,糖尿病的发病率随之增长。据国际糖尿病联盟报道[1]全球糖尿病患者3.82亿,预计到2035年将突破5.92亿,而且大部分患者位于中低等收入国家。据报道我国糖尿病的发病率已达到11.6%,是全球发病人数最多的国家[2]; 而且研究表明2型糖尿病是众多心脑血管疾病发生的危险因素[3,4]。
脑梗死作为2型糖尿病中最常见心脑血管病并发症之一,其发病率可达3.5%以上,能够加重患者的病情,造成预后不良,严重影响患者的日常工作和生活,而且脑梗死能够损害中枢神经系统,具有较高的致残率和致死率,给患者及家庭带来沉重经济负担和心理压力[5,6]。因此,寻找2型糖尿病合并急性脑梗死的危险因素和早期诊断疾病至关重要,但目前对2型糖尿病合并急性脑梗死的发病机制尚不明确,研究认为2型糖尿病患者脑梗死的发作和严重程度与炎症反应、血管内皮受损和免疫功能低下有关[5]。当血管内皮受损后,炎症因子进入血管壁介入炎症反应,引起动脉粥样硬化;MCP-1和VE-cadherin作为调节炎症细胞趋化和粘附的重要分子,在颈动脉粥样硬化和脑梗死后神经功能损伤的病理过程中发挥重要的作用,但具体作用尚不明确[7,8]。
本研究通过观察2型糖尿病合并急性脑梗死患者血清MCP-1和VE-cadherin的水平,探讨血清MCP-1和VE-cadherin水平与2型糖尿病合并急性脑梗死患者病情进展和动脉粥样硬化程度相关性,为临床诊治提供相应的理论依据。
1 资料和方法
1.1 研究对象 选取本院2013年1月-2016年12月神经内科就诊的2型糖尿病合并急性脑梗死患者128例作为观察组,选取本院同期就诊2型糖尿病非急性脑梗死患者64例作为对照组。纳入标准:(1)急性脑梗死的诊断应符合《中国急性缺血性脑卒中诊治指南2010年》[9]中的诊断标准;(2)患者发病时间<72 h,且症状持续时间>24 h;(3)经头部CT或MRI影像学检查,诊断为急性脑梗死;(4)糖尿病的诊断符合美国糖尿病学会推荐的2011年糖尿病诊断标准[10];(5)患者或其家属知情同意,本研究试验经医院伦理委员会批准。排除标准:(1)经头部CT或MRI影响学检查为脑出血者;(2)近90 d内有手术或胃肠道出血;(3)严重心、肝、肾功能障碍、心肌梗死、心绞痛或严重肺损害者;(4)有恶性肿瘤、自身免疫缺陷疾病者;(5)妊娠期或哺乳期的妇女;(6)心源性脑梗死;(7)具有脑血管病或外周血管病病史。
1.2 方法
1.2.1 样本采集和测定 入组时采集血清10 ml,以3000 r/min速度离心10 min,吸取血清放置-80 ℃冰箱备用。UA、FPG、HbAc1、Cr、血脂水平采用日立全自动生化分析仪检测,HbAc1水平采用离子交换高效液相色谱法(HPLC)检测,VE-cadherin和MCP-1应用ELISA法检测。
1.2.2 超声检查 观察组患者应用飞利浦彩色多普勒超声诊断仪,探头频率7.5 MHz,分别在颈总动脉远端2 cm和颈内动脉及颈外动脉1 cm的范围内取3处测量颈动脉内中膜厚度(IMT),计算IMT的平均值。
1.2.3 分组方法 (1)入院后患者给予常规治疗,1 w后,观察组按照参考文献[11]分为进展性2型糖尿病合并急性脑梗死(PCI组,55例)和非进展性2型糖尿病合并急性脑梗死(非PCI组,73例);(2)观察组患者根据颈动脉粥样硬化情况分为3组:即正常颈动脉(IMT正常组,25例)、颈动脉内膜中层增厚(IMT增厚组,43例)和动脉粥样硬化斑块形成(斑块组,60例)。颈动脉粥样硬化评判标准[12]:即正常颈动脉,IMT<1.0 mm;颈动脉内膜中层增厚,1.0 mm≤IMT<1.2 mm;动脉粥样硬化斑块形成,IMT≥1.2 mm。

2 结 果
2.1 观察组和对照组一般资料比较 两组在年龄、性别、BMI、糖尿病病程、UA、FPG、HbAc1、Cr、血脂水平等一般资料均无统计学差异(P>0.05),两组具有可比性(见表1)。
2.2 观察组和对照组VE-cadherin和MCP-1水平比较 观察组VE-cadherin和MCP-1的水平高于对照组,差异有统计学意义(P<0.05)(见表2)。
2.3 PCI组和非PCI组VE-cadherin和MCP-1水平比较 PCI组VE-cadherin和MCP-1的水平高于非PCI组,差异有统计学意义(P<0.05)(见表3)。
2.4 IMT正常组、IMT增厚组、斑块组3组VE-cadherin和MCP-1水平比较 3组VE-cadherin和MCP-1水平比较,差异有统计学意义(P<0.05);IMT正常组VE-cadherin和MCP-1的水平显著性低于IMT增厚组和斑块组(P<0.05);斑块组VE-cadherin和MCP-1的水平显著性高于IMT正常组和IMT增厚组(P<0.05)(见表4)。
2.5 PCI组和非PCI组超声检出情况比较 PCI组和非PCI组IMT正常和IMT增厚的检出率差异无统计学意义(P>0.05);而PCI组斑块的检出率明显高于非PCI组(P<0.05)(见表5)。
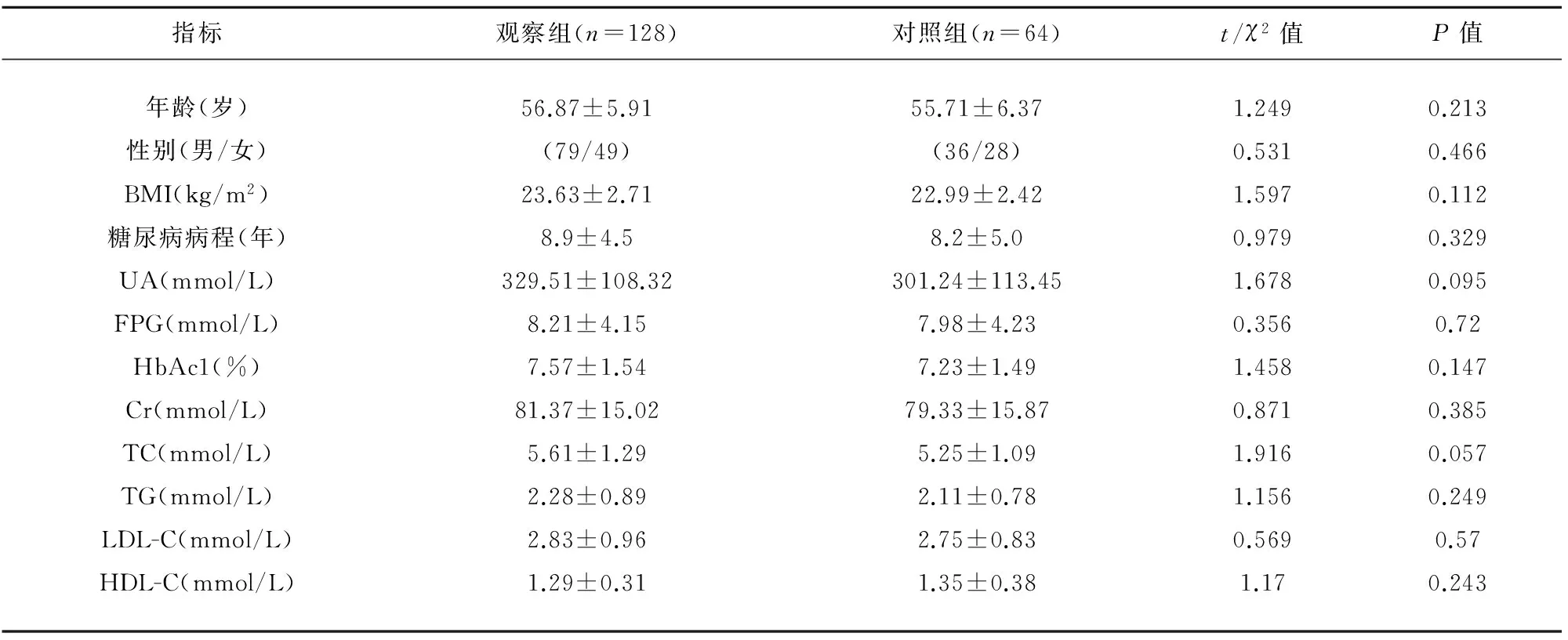
表1 观察组和对照组一般资料比较

表2 观察组和对照组VE-cadherin和MCP-1水平比较
与对照组比较△P<0.05

表3 PCI组和非PCI组VE-cadherin和MCP-1水平比较
与非PCI组比较#P<0.05

表4 IMT正常组、IMT增厚组、斑块组3组 VE-cadherin和MCP-1水平比较
与IMT正常组比较*P<0.05;与斑块组比较△#P<0.05

表5 PCI组和非PCI组超声检出情况比较
与非PCI组比较#P<0.05
3 讨 论
糖尿病是常见的一种代谢性疾病,在我国发病率较高,而糖尿病患者发生脑梗死的风险是非糖尿病患者的2~4倍[13]。颈动脉粥样硬化是引起脑梗死危险因素,而且斑块的脱落将导致脑动脉栓塞、血流受阻和神经功能缺血性损伤。炎症反应在动脉粥样硬化形成过程发挥重要作用,众多炎症因子参与血小板活化、斑块和血栓的形成。VE-cadherin和MCP-1在炎症因子的迁移和黏附分子介导的炎症反应过程中发挥的重要作用。但目前关于VE-cadherin、MCP-1等指标与2型糖尿病合并急性脑梗死的发病和动脉粥样硬化程度相关性研究尚少。
MCP-1也被称为CC类趋化因子配体2(CCL2),属于趋化因子家族CC亚家族,参与单核细胞趋化、内皮细胞活化和白细胞功能调节及介导多种促炎因子的生物活性,进而参与动脉粥样硬化的形成及缺血脑组织炎症反应的过程[14]。VE-cadherin是内皮细胞连接的主要黏附分子,属于经典钙粘蛋白家族的成员,对于内皮细胞功能和形态改变起到一定的作用,其还通过连接细胞内β-catenin蛋白,传递生物信号,促进多种炎症因子的分泌,参与动脉粥样硬化形成[15]。本研究通过分析,发现观察组血清VE-cadherin和MCP-1的水平显著性高于对照组(P<0.05),PCI组血清VE-cadherin和MCP-1的水平也明显高于非PCI组(P<0.05),说明VE-cadherin和MCP-1与急性脑梗死的发生和发展密切相关。观察组血清VE-cadherin和MCP-1的水平随着IMT的厚度增加而升高(P<0.05),说明VE-cadherin和MCP-1水平与动脉粥样硬化的程度存在一定的相关性。这可能是因为MCP-1及CCL2表达增加,促使趋化单核细胞向血管内皮下间隙的炎症部位聚集,促进活化巨噬细胞与血管内皮黏附,加剧巨噬细胞渗透进入血管壁形成泡沫细胞,加重血管的炎症,从而导致动脉粥样硬化的形成[16~18]。在动脉粥样硬化的过程中,VE-cadherin使血管内皮屏障功能受损,增加血管的通透性,促使炎症细胞黏附于血管内皮的局部,引起血管内皮损伤,从而促进动脉粥样硬化的发生发展[19,20]。
综上所述, 2型糖尿病合并急性脑梗死患者血清VE-cadherin和MCP-1水平显著升高,而且血清VE-cadherin和MCP-1水平与患者病情进展和动脉粥样硬化程度密切相关。但本研究尚存一定局限性,未动态监测血清VE-cadherin和MCP-1水平变化情况,也为研究患者脑脊液VE-cadherin和MCP-1水平与病情进展和动脉粥样硬化的程度的相关性,尚需日后进一步研究探讨。
[参考文献]
[1]王盼盼,李玉倩,刘晓田,等.静息心率与2型糖尿病发病风险的Meta分析[J].中华疾病控制杂志,2017,21(3):245-249.
[2]Xu Y,Wang LM,HE J,et al.Prevalence and control of diabetes in Chinese adults[J].JAMA,2013,310(9):948-959.
[3]Shah AD,Langenberg C,Rapsomaniki E,et al.Type 2 diabetes and incidence of cardiovascular diseases:a cohort study in 1.9 million people[J].Lancet Diabetes Endocrinol,2015,3(2):105-113.
[4]Murakami Y,Huxley RR,Lam TH,et al.Diabetes,body mass index and the excess risk of coronary heart disease,ischemic and hemorrhagic stroke in the Asia Pacific Cohort Studies Collaboration[J].Prev Med,2012,54(1):38-41.
[5]刘春苗,周艳辉.2型糖尿病并发急性脑梗死患者血清ICAM、ALCAM、VCAM、PECAM-1水平及临床意义[J].重庆医学,2017,46(8):1057-1059.
[6]Luo P,Li R,Yu SY,et al.The relationship between neutrophil-to-lymphocyte ratio and intracerebral hemorrhage in type 2 diabetes mellitus[J].J Stroke Cerebrovasc Dis,2017,26(5):930-937.
[7]Inose Y,Kato Y,Kitagawa K,et al.Activated microglia in ischemic stroke penumbra upregulate MCP-1 and CCR2 expression in response to lysophosphatidylcholine derived from adjacent neurons and astrocytes[J].Neuropathology,2015,35(3):209-223.
[8]Benn A,Bredow C,Casanova I,et al.VE-cadherin facilitates BMP-induced endothelial cell permeability and signaling[J].J Cell Sci,2016,129(1):206-218.
[9]中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010[J].中华神经科杂志,2010,43(2):146-153.
[10]American Diabetes Association.Standards of medical care in diabetes-2011[J].Diabetes Care,2011,34(Suppl 1):S11-61.
[11]Zhang CH,Zhao SQ,Zang YJ,et al.The efficacy and safety of Dl-3n-butylphthalide on progressive cerebral infarction:A randomized controlled STROBE study[J].Medicine (Baltimore),2017,96(30):e7257.
[12]Wu W,Guan Y,Xu K,et al.Plasma homocysteine levels predict the risk of acute cerebral infarction in patients with carotid artery lesions[J].Mol Neurobiol,2016,53(4):2510-2517.
[13]Zhao L,Hu FX.α-Lipoic acid treatment of aged type 2 diabetes mellitus complicated with acute cerebral infarction[J].Eur Rev Med Pharmacol Sci,2014,18(23):3715-3719.
[14]He JB,Chen YH,Lin Y,et al.Association study of MCP-1 promoter polymorphisms with the susceptibility and progression of sepsis[J].PLoS One,2017,12(5):e176781.
[15]Jiao ZY,Wu J,Wen B,et al.M3 muscarinic acetylcholine receptor dysfunction inhibits Rac1 activity and disrupts VE-cadherin/beta-catenin and actin cytoskeleton interaction[J].Biochem Cell Biol,2014,92(2):137-144.
[16]Rahmanian A,Mohebali N,Haghnegahdar A,et al.Serum levels of monocyte chemoattractant protein-1 correlate with poor clinical grades in cerebral aneurysms[J].Iran J Immunol,2015,12(4):302-310.
[17]袁佳利,刘 静,夏艳辉,等.单核细胞趋化蛋白-1与自身免疫性疾病研究进展[J].实用医院临床杂志,2017,14(2):126-129.
[18]Fukunaga H,Kishiro M,Akimoto K,et al.Imbalance of peroxisome proliferator-activated receptor gamma and adiponectin predisposes Kawasaki disease patients to developing atherosclerosis[J].Pediatrics International,2010,52(5):795-800.
[19]Gertz K,Kronenberg G,Uhlemann R,et al.Partial loss of VE-cadherin improves long-term outcome and cerebral blood flow after transient brain ischemia in mice[J].BMC Neurol,2016,16(1):144.
[20]Dejana E,Orsenigo F.Endothelial adherens junctions at a glance[J].J Cell Sci,2013,126(12):2545-2549.
