铅污染对不同生境芦苇体内抗氧化酶系统的影响
2018-05-08朱阳春范如芹刘丽珠穆春生张振华
张 娜, 杨 双, 童 非, 朱阳春, 范如芹, 卢 信, 刘丽珠, 穆春生,张振华
(1.江苏省农业科学院农业资源与环境研究所,江苏 南京 210014; 2.江苏省农业科学院,省部共建国家重点实验室培育基地江苏省食品质量安全重点实验室,江苏 南京 210014; 3.东北师范大学草地科学研究所植被生态教育部重点实验室,吉林 长春 130024; 吉林省延边朝鲜族自治州敦化市草原站,吉林 敦化 133700)
重金属污染在全球范围内已经成为一个严重问题。有研究者报道,土壤中重金属含量可高达1.0×105mg/kg[1],铅是最具有毒性的污染物之一。铅污染主要是由人类活动所造成,来源于尾矿和铅矿开采、煤燃烧、化肥、农药、电池、铅砷酸盐和工业废水,另一主要来源是汽车尾气排放。特别是在发展中国家,随着汽车数量增加,铅大量排放。尽管有些国家已不再使用含铅汽油,但是铅极其稳定,会长期存留在土壤中[2]。铅能够被植物根吸收并对植物产生一定的危害,例如抑制种子发芽,干涉营养元素吸收和转运,抑制叶绿素合成和光合作用,引起酶活性改变、膜脂过氧化,对植物的生理和代谢产生不良影响,导致植物生长和发育受阻,甚至死亡[3-8]。
当处于不利或胁迫环境时,植物会利用体内的抗氧化系统产生更多的抗氧化物或酶来抵抗氧化胁迫。铅污染能够诱导植物体内产生活性氧类(ROS),主要包括羟自由基(OH-)、过氧化氢(H2O2)、超氧阴离基(O2·-)等[9]。一定量的ROS是诱导抗氧化回应的一种信号分子,可导致植物体内过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)等各种抗氧化酶的活性增强,因此由重金属诱导的活性氧可能会被抵消、转换和清除。然而,当植物遭受严重胁迫时,体内可能产生过多的ROS,当自由基达到一定量时,植物体内丙二醛(MDA)的含量就会增加,可能导致膜损伤和抗氧化酶破坏。有研究结果表明,随着重金属浓度升高植物抗氧化酶活性增强[5,7-8],这在很多胁迫环境中均会发生[10-12],因为抗氧化酶是植物抵抗氧化胁迫的一种有效机制。然而也有研究结果表明,高浓度重金属导致抗氧化酶活性显著降低,因为当植物体内由重金属诱导的ROS达到一定量时,抗氧化酶受到破坏[13-15]。因此,受胁迫期间植物体内氧化和抗氧化之间的平衡对于植物的适应或抵抗外界干扰及最终存活发挥重要作用。
芦苇是典型的湿地植物,能够忍耐极端环境,如洪水、干旱和重金属污染[16-17]。因此,芦苇被广泛应用于湿地建设和恢复,处理有重金属污染的城市和工业废水、沉积物以及尾矿污染。有研究结果表明,芦苇抵抗重金属的防御机制主要是依赖抗氧化酶活性清除活性氧[18]。然而,目前有关不同生境芦苇抗氧化胁迫的能力是否存在差异还不清楚。因此,本研究拟探究淹水和干旱条件下,铅污染对芦苇体内蛋白质、MDA含量以及抗氧化酶活性的影响,评估两种不同生境芦苇对铅污染的耐受或抵抗能力。
1 材料与方法
1.1 试验材料准备
芦苇种子采自生长在吉林省长春市西部湿地的野生芦苇。试验用土采自吉林省长岭县东北师范大学试验站草地 0~20 cm表层土壤。土壤全氮和有机碳含量分别为6.9%和1.6%,pH值8.6,电导率91 μs/cm,最大田间持水量为200 g/kg。将一定浓度的Pb (NO3)2溶液均匀拌入风干并过1 mm筛的土壤,使污染土壤中全铅的目标含量分别为0 mg/kg、500 mg/kg、1 500 mg/kg、3 000 mg/kg和4 500 mg/kg。将拌匀的每份污染土装入底部封闭的花盆(内径30 cm,高35 cm)。将装有污染土的花盆避光温育45 d。同时,从各处理中取出少量污染土测定各污染土中铅的实际含量,测定结果表明对照土和4个浓度梯度的人工污染土中铅的含量分别为12.9 mg/kg、562.0 mg/kg、1 574.0 mg/kg、3 812.0 mg/kg、4 750.0 mg/kg。
1.2 试验设计
将播种后45 d约 3~4叶并高度一致的芦苇幼苗,移栽至装有污染土的花盆中,每盆20株。用遮阳布避光缓苗5 d后进行间苗,每盆保留10株。然后进行淹水和干旱处理,分别模拟芦苇的水生和干旱生境。每天下午16∶00浇水,淹水处理花盆中保持水层高出污染土表面 3~5 cm,干旱处理花盆中土壤含水量保持在田间持水量的 50%±5%。采用裂区试验设计,水分为主区包括水层和干旱2个水平,铅浓度为副区包括5个水平,共10个处理,每个处理12个重复。整个试验在东北师范大学校园避雨棚内进行,试验时间90 d。
1.3 测定方法
分别在处理的第60 d和90 d,从每株芦苇上取顶端第1个完全展开的叶片,用保鲜膜包裹立即放入液氮中,约30 min后转移至-80 ℃冰箱中保存。取冷冻叶片0.3 g,剪成1 cm长的碎片,加入5 ml提取液(50 mmol/L Tris-HCl缓冲液,pH 7.0,含1 mmol/L EDTA-Na2,1%聚乙烯吡咯烷酮),然后在液氮条件下研磨提取蛋白质和酶。
酶活性测定按照李忠光等的方法[19],并做适当修改。过氧化氢酶(CAT)活性测定反应混合液为50 mmol/L Tris-HCl,pH 7.0,内含0.1 mmol/L EDTA。超氧化物歧化酶(SOD)活性测定反应混合液为50 mmol/L Tris-HCl缓冲液,pH 7.8,内含0.1 mmol/L EDTA、0.1 mmol/L NBT、13.37 mmol/L蛋氨酸。过氧化物酶(POD)活性测定反应混合液为50 mmol/L Tris-HCl,pH 7.0,内含0.1 mmol/L EDTA、10 mmol/L愈创木酚和5 mmol/L H2O2。
可溶性蛋白质含量采用考马斯亮蓝G-250染色法[20]测定,丙二醛(MDA)含量采用TBA(硫代巴比妥酸)染色法[20]测定。
1.4 统计分析
对2次测定的可溶性蛋白质含量、酶活性和丙二醛含量进行重复测量分析,分析不同胁迫时间内这些参数对不同浓度铅和水分变化的响应。胁迫时间(60 d、90 d)作为组内因子,铅浓度和水分作为组间固定因子。重复测量中,当铅浓度和水分存在显著作用时,进行单因素方差分析和独立样本t检验。采用单因素方差分析法,分析不同水分条件下铅的作用,铅浓度作为固定因子。采用独立样本t检验,分析不同铅浓度水平上水分的作用,水分作为固定因子。在进行单因素方差分析时,对于不符合正态分布和方差齐性的数据进行转换。所有用数据使用SPSS17.0(SPSS Inc., Chicago, USA)分析,所有图用Sigmaplot 10.0 (Systht Software, Inc., San Jose, CA, USA)制作。
2 结 果
2.1 铅污染、淹水及胁迫时间对芦苇体内丙二醛含量的影响
铅污染、淹水及胁迫时间对芦苇体内丙二醛含量均有显著影响(表1)。在淹水条件下,随着铅浓度升高芦苇中丙二醛含量呈增加趋势,大于1 500 mg/kg的铅污染均导致丙二醛含量显著增加。干旱条件下,胁迫处理60 d,3 000 mg/k铅污染处理芦苇体内丙二醛含量显著增加;胁迫处理90 d,4个不同浓度铅污染处理均导致丙二醛含量显著增加。同一铅浓度水平上,胁迫处理60 d,淹水处理芦苇丙二醛含量大于干旱处理,而胁迫处理90 d的结果则相反(图1)。
表1铅、水分及其交互作用对芦苇丙二醛、可溶性蛋白质含量及各种抗氧化酶活性影响的方差分析结果
Table1ANOVAresultsoftheeffectsofPb,waterandtheirinteractiononthecontentsofmalondialdehyde(MDA)andsolubleprotein,andantioxidantenzymeactivitiesofPhragmitesaustralis

参数PbFPb×FTT×PbT×FT×Pb×F丙二醛含量∗∗∗∗∗∗ns∗∗∗∗∗∗∗∗ns蛋白质含量ns∗∗∗∗∗∗∗∗∗nsns过氧化氢酶活性∗∗∗∗∗∗nsnsns超氧化物歧化酶活性∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗过氧化物酶活性∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗
Pb代表铅污染处理,F代表淹水处理,T代表处理时间。*、**、***分别表示P≤0.05、P≤0.01和P≤0.001,ns表示不显著。

同一淹水或干旱处理水平上不同小写字母表示不同铅浓度处理间存在显著差异。图1 处理后60 d (A) 和90 d (B)铅污染对芦苇体内丙二醛含量的影响Fig.1 The effects of Pb contamination on MDA content of Phragmites australis after 60 d (A) and 90 d (B) of treatments
2.2 铅污染、淹水及胁迫时间对芦苇体内可溶性蛋白质含量的影响
淹水和胁迫时间及铅污染和淹水的交互作用均显著影响芦苇总可溶性蛋白质含量,而铅污染的影响不明显(表1)。淹水条件下,胁迫60 d和90 d芦苇体内总可溶性蛋白质含量随着铅浓度升高呈增加趋势,且胁迫90 d时500 mg/kg以上铅即可导致可溶性蛋白质含量显著增加。干旱条件下,胁迫60 d,最高浓度铅(4 500 mg/kg)导致芦苇体内可溶性蛋白质含量显著减小,而胁迫90 d,铅浓度升高虽导致可溶性蛋白质含量增加,但均未达到显著水平。在高浓度铅处理水平上,淹水处理芦苇的可溶性蛋白质含量显著大于干旱处理(图2)。

同一淹水或干旱处理水平上不同小写字母表示不同铅浓度处理间存在显著差异。图2 处理后60 d (A) 和90 d (B)铅污染对芦苇体内可溶性蛋白质含量的影响Fig.2 The effects of Pb contamination on soluble protein content of Phragmites australis after 60 d (A) and 90 d (B) of treatments
2.3 铅污染、淹水及胁迫时间对芦苇体内过氧化氢酶活性的影响
淹水和胁迫时间及铅污染与淹水的交互作用对过氧化氢酶(CAT)活性均产生显著影响(表1)。淹水条件下,胁迫60 d,4个铅浓度处理芦苇的CAT活性均显著升高;胁迫90 d,随着铅浓度增加CAT活性呈增加趋势但不显著。干旱条件下,胁迫60 d和90 d,CAT活性具有相似的变化趋势,即随着铅处理浓度升高CAT活性先增加后下降,即500 mg/kg和1 500 mg/kg铅水平上显著增加,而后减小(图3)。

同一淹水或干旱处理水平上不同小写字母表示不同铅浓度处理间存在显著差异。图3 处理后60 d (A) 和90 d (B)铅污染对芦苇体内过氧化氢酶活性的影响Fig.3 The effects of Pb contamination on CAT activity of Phragmites australis after 60 d (A) and 90 d (B) of treatments
2.4 铅污染、淹水及胁迫时间对芦苇体内超氧化物歧化酶活性的影响
铅污染、淹水和二者交互作用及胁迫时间对超氧化物歧化酶(SOD)活性均产生显著影响(表1)。淹水条件下,胁迫60 d,随着铅处理浓度升高SOD活性显著增加;胁迫90 d,SOD活性呈先增加后减小的趋势,但4个铅浓度处理SOD活性均大于对照。干旱条件下,胁迫60 d和90 d,随着铅处理浓度升高SOD活性显著增加。在同一铅浓度水平上,胁迫60 d,淹水处理的SOD活性显著小于干旱处理,而胁迫90 d,则是淹水处理显著大于干旱处理(图4)。
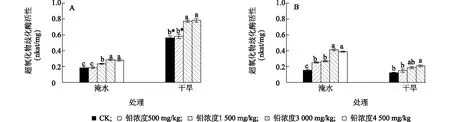
同一淹水或干旱处理水平上不同小写字母表示不同铅浓度处理间存在显著差异。图4 处理后60 d (A) 和90 d (B)铅污染对芦苇体内超氧化物歧化酶活性的影响Fig.4 The effects of Pb contamination on SOD activity of Phragmites australis after 60 d (A) and 90 d (B) of treatments
2.5 铅污染、淹水及胁迫时间对芦苇体内过氧化物酶活性的影响
铅污染、淹水和二者交互作用及胁迫时间对过氧化物酶(POD)活性均产生显著影响(表1)。淹水条件下,胁迫60 d,高浓度铅(3 000 mg/kg和4 500 mg/kg)导致POD活性显著增加;胁迫90 d,随着铅浓度升高POD活性呈先增加后减小的趋势,但均大于对照。干旱条件下,胁迫60 d高浓度铅导致POD活性显著增加,与淹水处理的变化趋势相同;胁迫90 d,POD活性随着铅浓度升高而增加,且3 000 mg/kg铅处理的酶活性显著增加。在同一铅浓度水平上,胁迫60 d干旱处理的POD活性大于淹水处理,且在最高铅浓度下达到显著水平;胁迫90 d淹水处理芦苇的POD活性则显著大于干旱处理(图5)。

同一淹水或干旱处理水平上不同小写字母表示不同铅浓度处理间存在显著差异。图5 处理后60 d (A) 和90 d (B)铅污染对芦苇体内过氧化物酶活性的影响Fig.5 The effects of Pb contamination on POD activity of Phragmites australis after 60 d (A) and 90 d (B) of treatments
3 讨 论
重金属与盐碱、干旱等其他环境胁迫因子相似,可能直接或间接地导致植物体内活性氧类(ROS)含量增加,使植物细胞膜、蛋白质甚至DNA遭受氧化性损伤[11-12]。为了适应胁迫并存活,植物体内常常产生抗氧化酶和特定代谢物抵消、转换和清除重金属诱导的ROS以抵抗氧化胁迫。然而,当植物体内由重金属诱导的ROS含量达到一定量时,也可能导致抗氧化酶受到破坏[5,7-8]。丙二醛(MDA)是膜脂过氧化产生的一种有毒物质,因此它被认为是自由基产生并可能导致组织受损的一种指示物[9]。本研究中,在淹水和干旱条件下,随着铅浓度和时间的增加,MDA含量均显著增加,说明随着胁迫时间的延长铅诱导芦苇体内产生的氧化胁迫增强,这与先前很多学者的观点[5,14-15]相同。有研究结果表明,干旱导致植物中MDA含量显著增加,膜脂过氧化作用增强[11,19]。Bauddh等研究发现,干旱和镉复合胁迫使蓖麻(Ricinuscommunis)和芥菜(Brassicajuncea)中的MDA含量均大于干旱和重金属单独胁迫处理[20]。同样,我们也发现,在胁迫90 d,干旱和铅处理对植物产生了更强的氧化胁迫,因为在胁迫90 d干旱处理芦苇MDA含量显著大于淹水处理。因此,在铅污染和干旱条件下芦苇遭受更强的氧化胁迫,可能是显著抑制芦苇生长的原因之一。
重金属对植物产生的胁迫,可以通过可溶性蛋白质含量来衡量,同时可溶性蛋白质含量的变化也体现了植物对重金属的抗性。有学者认为,植物体内可溶性蛋白质含量与重金属浓度呈负相关,随着重金属浓度升高植物体内可溶性蛋白质含量降低[21]。相反,也有研究结果表明随着重金属浓度的升高,植物体内可溶性蛋白质含量升高[22]。张雯对二穗短柄草(Brachypodiumdistachyon)的研究结果表明,低浓度镉导致植物体内可溶性蛋白质含量升高,而高浓度镉则导致植物体内可溶性蛋白质含量显著降低[23]。本研究中,淹水条件下随着铅浓度的升高,芦苇体内可溶性蛋白质含量增加。这可能是因为逆境下抗氧化酶活性增强,芦苇体内产生更多的可溶性蛋白质与铅离子络合来降低铅对植物的毒性。然而,干旱条件下胁迫60 d,铅处理芦苇体内可溶性蛋白质含量呈减小趋势,胁迫90 d则呈增加趋势。这可能是因为干旱胁迫初期芦苇体内可溶性蛋白质比较敏感,铅胁迫促进植物体内蛋白质的分解,而随后植物体内产生铅离子结合蛋白以降低铅的毒性。可见,芦苇体内可溶性蛋白质含量与外界水分变化也有一定关系。
抵抗ROS的酶主要包括过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)等,它们在抵消、转换和清除由铅诱导的活性氧中发挥重要作用。CAT和SOD主要抵抗过氧化反应,清除有毒的过氧化物。过氧化氢能够被CAT直接清除,转化成水和氧气[2,5,7]。本试验中,淹水60 d芦苇体内CAT活性随着铅处理浓度的升高而显著增加。说明芦苇对铅胁迫产生了有效的抵抗作用,这种抵抗机制在其他胁迫中也存在[10-12]。然而,在胁迫90 d,CAT活性虽然增加但不显著。说明在水和铅胁迫后期芦苇依靠CAT清除过氧化氢的抵抗几乎不起作用。有研究结果表明,铅污染、盐碱以及干旱等胁迫均导致CAT活性减小[12-14],但是本研究中干旱条件下小于3 000 mg/kg的铅污染处理的芦苇始终可以通过CAT清除过氧化氢。
SOD是植物抗氧化酶防御系统的重要组成部分,它能够将超氧阴离子自由基(O2·-)转化为过氧化氢和氧气[24]。在所有抗氧化酶中SOD活性对于植物抗氧化系统的维持更为重要[25]。有研究者报道,在盐碱、淹水以及重金属(如Cd、Pb和Al)污染环境中,植物体内SOD活性升高[11-12,14]。这与本研究结果相似,铅污染浓度升高导致SOD活性显著增加。然而Islam 等研究发现,随着铅处理浓度增加紫花香薷(Elsholtziaargyi)SOD活性显著减小[5]。这可能是因为当植物体内由重金属诱导的ROS含量达到一定量时,酶蛋白失活,酶合成减少或者酶亚基装配发生改变使抗氧化酶受到破坏[6,13]。本研究中,铅处理导致芦苇SOD活性增强,而且淹水条件下随着胁迫时间的延长SOD活性升高,但干旱条件下随着胁迫时间的延长SOD活性减小。因此,在淹水和干旱环境中SOD在抵抗铅诱导的氧化胁迫中均发挥重要作用,随着胁迫时间的延长,水生境芦苇具有较强的抵抗力。
POD主要是通过结合抗氧化物(作为给电子体)间接地清除过氧化氢[14-15]。它在细胞内外均有分布,例如细胞质、细胞壁、液泡以及细胞外孔隙。在很多胁迫环境中均发现POD活性增加,例如重金属(Al、Cu、Cd、Zn、Pb)、水、盐碱和寒冷等胁迫[5,11,26]。相反,也有研究结果表明,高浓度重金属如Pb、Zn和Cu等污染导致植物体内POD活性显著减小[5]。本研究发现,淹水和干旱条件下随着铅处理浓度升高POD活性增强。因此,在淹水和干旱环境中POD在抵抗铅诱导的氧化胁迫中均发挥重要作用。此外,高浓度(3 000 mg/kg和4 500 mg/kg)铅污染处理芦苇的POD和CAT活性减小,可能是因为过氧化氢和有毒过氧化物的清除过程被延迟,导致膜脂过氧化。
可见,无论是淹水还是干旱条件下,胁迫60 d的芦苇通过CAT、SOD和POD酶活性增强可以有效地抵抗和防御铅和淹水诱导的氧化胁迫。胁迫90 d,SOD和POD是抵抗铅污染引起的氧化胁迫的关键酶,但是干旱条件下SOD和POD活性有所减小。总之,尽管铅和淹水导致芦苇遭受一定的氧化胁迫,但是抗氧化酶可以作为芦苇内在的防御机制来抵抗铅胁迫所诱导的氧化损伤,而且在较长时间的胁迫下水生境芦苇具有较强的抗氧化能力。
参考文献:
[1] BLAYLOCK M J, HUANG J W. Phytoextraction of metals[C]//RASKIN I, ENSLEY B D. Phytoremediation of toxic metals: Using plants to clean up the environment. New York: John Wiley & Sons, Inc, 2000:53-70.
[2] SHARMA P, DUBEY R S. Lead toxicity in plants[J]. Brazilian J Plant Physiol, 2005, 17(1): 35-52.
[3] 姜立娜,邵珠田,宋子文,等. 铅处理对菜用大黄种子萌发和幼苗生长的影响[J]. 江苏农业科学,2016,44(4):223-225.
[4] GODBOLD D, KETTNER C. Lead influences root growth and mineral nutrition ofPiceaabiesseedlings[J]. J Plant Physiol, 1991, 139(1): 95-99.
[5] ISLAM E, LIU D, LI T, et al. Effect of Pb toxicity on leaf growth, physiology and ultrastructure in the two ecotypes ofElsholtziaargyi[J]. J Hazard Mater, 2008, 154(1): 914-926.
[6] GOPAL R, RIZVI A H. Excess lead alters growth, metabolism and translocation of certain nutrients in radish[J]. Chemosphere, 2008, 70(9): 1539-1544.
[7] WANG J, LI W, ZHANG C, et al. Physiological responses and detoxific mechanisms to Pb, Zn, Cu and Cd in young seedlings ofPaulowniafortunei[J]. J Environ Sci, 2010, 22(12): 1916-1922.
[8] HU R, SUN K, SU X, et al. Physiological responses and tolerance mechanisms to Pb in two xerophils:SalsolapasserinabungeandChenopodiumalbumL.[J]. J Hazard Mater, 2012, 205: 131-138.
[9] SMIRNOFF N. Antioxidants and reactive oxygen species in plants[M]. Wiley Online Library: John Wiley & Sons, 2005.
[10] BAISAK R, RANA D, ACHARYA P B, et al. Alterations in the activities of active oxygen scavenging enzymes of wheat leaves subjected to water stress[J]. Plant Cell Physiol, 1994, 35(3): 489-495.
[11] ZHANG J, KIRKHAM M. Drought-stress-induced changes in activities of superoxide dismutase, catalase, and peroxidase in wheat species[J]. Plant Cell Physiol, 1994, 35(5): 785-791.
[12] COMBA M E, BENAVIDES M P, TOMARO M L. Effect of salt stress on antioxidant defence system in soybean root nodules[J]. Funct Plant Biol, 1998, 25(6): 665-671.
[13] HERTWIG B, STREB P, FEIERABEND J. Light dependence of catalase synthesis and degradation in leaves and the influence of interfering stress conditions[J]. Plant Physiol, 1992, 100(3): 1547-1553.
[14] VERMA S, DUBEY R. Lead toxicity induces lipid peroxidation and alters the activities of antioxidant enzymes in growing rice plants[J]. Plant Sci, 2003, 164(4): 645-655.
[15] DAZY M, BÉRAUD E, COTELLE S, et al. Antioxidant enzyme activities as affected by trivalent and hexavalent chromium species inFontinalisantipyreticahedw[J]. Chemosphere, 2008, 73(3): 281-290.
[16] YE Z, BAKER A, WONG M, et al. Zinc, lead and cadmium tolerance, uptake and accumulation by the common reed,Phragmitesaustraliscav. trin. Ex steudel[J]. Ann Bot, 1997, 80(3): 363-370.
[17] DEMIREZEN D, AKSOY A. Accumulation of heavy metals inTyphaangustifoliaL. andPotamogetonpectinatusL. living in sultan marsh (kayseri, turkey)[J]. Chemosphere, 2004, 56(7): 685-696.
[18] FEDIUC E, ERDEI L. Physiological and biochemical aspects of cadmium toxicity and protective mechanisms induced inPhragmitesaustralisandTyphalatifolia[J]. J Plant Physiol, 2002, 159(3): 265-271.
[19] 李忠光,李江鸿,杜朝昆,等. 在单一提取系统中同时测定五种植物抗氧化酶[J]. 云南师范大学学报, 2002, 22(6): 44-48.
[20] 李合生. 植物生理生化实验原理与技术[M]. 北京:高等教育出版社,2000.
[21] 陶毅明. 镉铅胁迫下红树植物木榄生理生化特性, 抗氧化酶和相关蛋白的研究[D]. 桂林:广西师范大学, 2007.
[22] 洪仁远,杨广笑,刘东华,等. 镉对小麦幼苗的生长和生理生化反应的影响[J]. 华北农学报, 1991, 6(3): 70-75.
[23] 张 雯. 镉胁迫对二穗短柄草生长及生理特性的响应 [D]. 兰州: 甘肃农业大学, 2014.
[24] ALSCHER R G, ERTURK N, HEATH L S. Role of superoxide dismutases (sods) in controlling oxidative stress in plants[J]. J Exp Bot, 2002, 53(372): 1331-1341.
[25] SLOOTEN L, CAPIAU K, VAN CAMP W, et al. Factors affecting the enhancement of oxidative stress tolerance in transgenic tobacco overexpressing manganese superoxide dismutase in the chloroplasts[J]. Plant Physiol, 1995, 107(3): 737-750.
[26] MITTAL R, DUBEY R. Behaviour of peroxidases in rice: Changes in enzyme activity and isoforms in relation to salt tolerance[J]. Plant Physiol Biochem, 1991, 29(1): 31-40.
