IMRT联合TP方案治疗局部晚期食管鳞癌疗效及安全性研究
2018-05-08许俐文姚晓丹
许俐文 丁 婷 姚晓丹 王 纯
食管癌是临床常见的恶性肿瘤之一,早期可无症状或症状轻微,若发展到进行性吞咽困难已属中晚期,许多已失去手术机会,尤其是患者,确诊时只有不到10%的病例可以做根治性切除。放疗是食管癌的主要治疗手段,但仅靠单一常规放疗,5年生存率一直在10%左右,其主要原因为局部复发或未控[1]。目前化疗是除手术治疗以外临床上公认的最有效治疗方法之一,虽近期效果显著,但是远期效果仍然不佳,加上化疗治疗之后患者复发率较高,多数患者需要接受多次的化疗治疗,副作用较大,给患者的精神与身体带来了一定的负担与压力,且治疗费用较为昂贵[2-3]。近年来调强放疗(intensity modulated radiation therapy,IMRT)技术临床应用越来越广泛,在减轻不良反应及提高疗效等方面,较常规放疗技术优势,尤其在食管癌患者放弃手术前提下更具优势,能够在采用高剂量照射时仍然保护周围组织,对局部的治疗更加精确[4]。因此我们在临床充不断摸索和改进治疗方案,尽可能的改善其生存质量并延长患者生存期,提高药物治疗的安全性及有效性。近年来我院采用联合放化疗治疗的方法,予适形调强放疗联合TP方案化疗治疗晚期肺鳞癌,取得了较为满意的效果,本文采用瞻性研究,旨在探讨该联合治疗疗效,现报告如下。
1 资料与方法
1.1 一般资料
选取2015年6月至2016年7月我院收治的局部食管鳞癌晚期76例患者。纳入标准:①纤维胃镜确诊食管癌,经肝脏B超、胸片等影像学检查无远处转移[5],病理类型均为鳞癌,临床分期为Ⅱ期、Ⅲ期;②KPS评分≥80分[6]; ③年龄为40~68岁;④入院前均未接受过放治疗及其他抗肿瘤治疗及手术治疗;⑤患者心肺功能、血常规、肝肾功能能耐受本方案。随机分为两组,对照组年龄40~62岁,平均年龄(54.8±7.8)岁,男性20例,女性18例;临床分期Ⅲ期20例,Ⅱ期18例;观察组年龄40~62岁,平均年龄(53.1±6.7)岁,男性19例,女性19例;临床分期为Ⅲ期21例,Ⅱ期17例。两组患者一般资料及疾病的基线水平等差异无统计学意义。见表1。

表1 两组患者一般资料/例
1.2 方法
对照组:TP组患者治疗第1天,静脉滴注70 mg/(m·d)顺铂+150 ms/(m·d)紫杉醇进行化疗。化疗4个周期,每个周期21天。
观察组:体模固定体位,CT模拟定位后重建图象上勾画靶区。靶区定义:大体肿瘤区(gross tumor volume,GTV):包括食管肿瘤病灶GTV和食管旁肿大淋巴结GTVnd。GTV根据电子胃镜、食管造影片和CT检查结果共同确定上下界;GTVnd勾画标准:短径≥0.5 cm。临床肿瘤区(clinical tumor volume,CTV):轴向在GTV外扩5~10 mm,纵向包括GTV外30 mm食管及食管旁组织,不包括区域淋巴结,如有组织屏障的适当修改外扩范围。计划靶区(planning target volume,PTV):分别以GTV(包含GTVnd)及CTV为基础均匀外扩5 mm生成PTV-GTV及PTV。脊危及器官剂量限制:脊髓最大剂量<50 Gy,肺受照超过20 Gy以上的体积百分比V20≤25%、受照超过30 Gy以上的体积百分比V30≤20%,以上作为约束条件进行优化。用PrrVl平均剂量归一处方剂量。靶区目标:PTV-GTV平均剂量60 Gy/30次;PTV2剂量为54Gy/30次。限定子野总数<50个,子野面积>14 cm2,子野剂量≥5 MU。直线加速器6MV-X线每周治疗5 天,每天1次。物理师完成适形计划经副主任医师以上医生确认、CT模拟复位、加速器验证后实施治疗。每21天为1个周期,一共给予2个周期化疗。
1.3 观察和评价指标
出院后进行随访,记录患者各项指标及不良反应、生存情况。根据世界卫生组织(WHO)《实体瘤疗效评价标准》[7],采用WHO制定的《抗癌药物常见不良反应分级标准》[8]结合影像学检查、生化指标等进行评价。
治疗效果。部分缓解(PR):即靶病灶最大直径减少至少30%;完全缓解(CR):即所有靶病灶消失,维持超过4周;疾病进展(PD):即靶病灶最大直径增加超过25%;疾病稳定(SD):即靶病灶增加的程度也没达到PD水平,减小的程度没达到PR,处于两者之间。SD和PD判定为治疗无效,CR和PR判定为治疗有效。治疗有效率=(CR+PR)/患者总数。不良反应。Ⅳ度:出现严重的不良反应,Ⅲ度:出现不可耐受的中度不良反应;Ⅱ度:可耐受性的中度不良反应;Ⅰ度:轻度的不良反应;0度:未发生不良反应。生存质量:采用Karnofsky 功能状态评分评价,于治疗前、治疗6个月时进行评价。
1.4 统计学方法

2 结果
2.1 两组患者近期疗效
观察组CR患者显著多于对照组,对照组治疗总有效率为42.11%,观察组有效率为84.21%,总有效率两组比较差异显著(P<0.05),见表2。
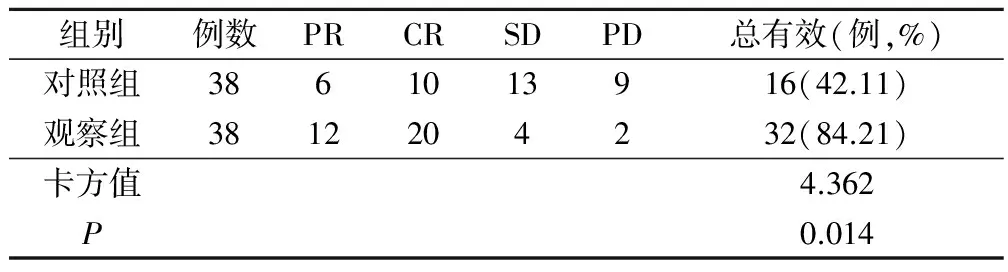
表2 两组患者近期疗效比较/例
2.2 生存质量Karnofsky评分比较
治疗后6个月后Karnofsky评分观察组显著高于对照组,差异具有统计学意义(P<0.05),见表3。

表3 生存质量Karnofsky评分比较
2.3 两组不良反应发生情况比较
治疗1个周期、2个周期后观察组恶心、呕吐反应以及粒细胞减少程度与对照组比较,差异无统计学意义 (P>0.05),见表4。

表4 两组不良反应情况比较/例
2.4 两组并发症情况分析
对照组并发症发生率与观察组比较,差异无统计学意义(P>0.05),见表5。

表5 两组并发症发生情况比较/例
3 讨论
食管癌给广大患者造成巨大威胁,特别是局部晚期食管鳞癌患者,由于局部肿瘤不断增大,食管癌患者肿瘤生长速度较快,外科手术是食管癌首选的治疗方法,而术后转移和复发情况发生率高[9]。患者即使进行了手术,术后并发症也较年轻患者多,且恢复慢,加上患者发现的时候往往已经到了晚期,错过了手术治疗的最佳时机。这类患者需要采取化疗治疗,也是目前公认的治疗方法,但是晚期鳞癌患者的身体状况较差,化疗的药物的毒副作用下,耐受性也随之降低,很难取得良好的治疗效果,若患者能耐受则可在短期内控制肿瘤的生长[10]。
放射治疗与手术及化疗相比适应证更广,且治疗创伤小,采取局部治疗并发症相对少,因此在食管癌的治疗中具有重要地位[11]。但多年来食管癌常规分割放疗的生存率没有明显提高,5年生存率长期徘徊在8%。主要原因是常规放疗技术不能保证肿瘤靶体积达到理想处方剂量,不可避免地使患者部分肿瘤及纵隔转移淋巴结漏照或处于低剂量区。适形调强放疗对病变和剂量进行精确定位和定量,充分利用现代加速器技术、计算机技术和影像学技术,使放疗进入了精确摆位、精确定位和精确治疗的新阶段[12]。IMRT应用在颈段及胸上段食管癌上,与3D-CRT相比,可提高靶区适型性,并更好地保护了脊髓、肺。
研究表明,TP化疗方案在鳞癌与非鳞癌的治疗表现差异,其中可能是由于非鳞癌大多数是内生性,倾向于深层浸润,而鳞癌则更加倾向于局部浸润[13]。而TP化疗方案中,紫杉醇主要通过发挥细胞毒性或者对酪氨酸激酶进行激活和基因诱导细胞凋亡来缩小肿瘤病灶和抑制癌细胞扩散[14];结合适行调强放射,将其应用在颈段及胸上段食管癌上,与普通放疗相比,可提高靶区适型性,并更好地保护了脊髓、肺。通过本研究结果所示,联合两种方法干预可有效提高生存质量及治疗有效率。本次研究中,在血液系统毒副反应方面,红细胞减少和血小板减少发生情况两组患者的不存在显著性差异,联合组患者的骨髓抑制发生率并不会增高;在非血液系统毒副反应方面,放射性损伤、胃肠道反应、周围神经毒性和肝肾功能损害发生情况两组患者不存在显著性差异。说明在本次研究中,两种新辅助化疗方案的不良反应发生情况除了骨髓抑制的发生率外基本一致,而并发症及不良反应则差异未见统计学意义,结果提示,联合放化疗治疗的效果更佳。
综上所述,调强放疗能提高食管鳞癌患者的生存率、缓解进食梗阻症状从而提高临床获益率,疗效明显优于常规放疗、3D-CRT,且安全性高,副作用少,已成为食管鳞癌患者的有效治疗手段。联合TP方案化疗应用于晚期肺鳞癌新辅助治疗并不会增加不良反应的发生率,且可有效增强提高患者的生存率,有利于改善患者生活质量。但对于如何最正确界定治疗靶区、最佳的分割方式和总剂量等问题还有待今后的临床研究进一步明确。
[1] Li JC,Liu D,Chen MQ,et al.Different radiation treatment in esophgeal carcinoma:a clinical comparative study〔J〕.J BUON,2012,17(3):512-516.
[2] Campbell NP,Villaflor VM.Neoadjuvant treatment of esop-hageal cancer〔J〕.World J Gastroenterol,2010,16(30):3793-3803.
[3] Wolf MC,Stahl M.Curative treatment of oesophageal carcinoma:current options and future developments〔J〕.Radiat Oncol,2011,6(10):55-57.
[4] 祝淑钗,李 任,王玉祥,等.500例中晚期食管癌单纯放疗的多因素分析〔J〕.中华放射肿瘤学杂志,2005,14(4):253-258.
[5] 中国抗癌协会食管癌专业委员会编.食管癌规范化诊治指南〔M〕.中国协和医科大学出版社,2011:15-16.
[6] 殷蔚伯,谷铣之,刘泰福,等.肿瘤放射治疗学〔M〕.第四版.北京:北京医科大学中国协和医科大学联合出版社,2008,561.
[7] 冯奉仪.实体瘤新的疗效评价标准(解读1.1版RECIST标准)〔C〕.第三届中国肿瘤内科大会论文集,2009: 123-125.
[8] Garaci E,Pica F,Serafino A,et al.Thymosin alphal and cancer:action on immune effector and tumor target cells〔J〕.Ann N Y Acad Sci,2012,1269(1):26-33.
[9] Schrag D,Weiser MR,Goodman KA,et al.Neoadjuvant chemotherapy without routine use of radiation therapy for patients with locally advanced rectal cancer:a pilot trial〔J〕.J Clin Oncol,2014,32(6):513-518.
[10] Kim SH,Lee JY,Lee JM,et al.Apparent diffusion coefficient for evaluating tumour response to neoadjuvant chemoradiation therapy for locally advanced rectal cancer〔J〕.Eur Radiol,2011,21(5):987-995.
[11] Van Cutsem E,Dicato M,Geva R,et al.The diagnosis and management of gastric cancer:expert discussion and recommendations from the 12th ESMO/World Congress on Gastrointestinal Cancer,Barcelona,2010〔J〕.Ann Oncol,2011,22(5):1-9.
[12] Wu XX,Sun Y,Guo WJ,et al.Rebuilding the balance of STAT1 and STAT3 signalings by fusaruside,a cerebroside compound,for the treatment of T-cell-mediated fulminant hepatitis in mice〔J〕.Biochem Pharmacol,2012,84(9):1164-1173.
[13] Cathcart MC,Gately K,Cummins R,et al.Thromboxane synthase expression and correlation with VEGF and angiogenesis in non-small cell lung cancer〔J〕.Bba- Mol Basis Dis,2014,1842(5):747-755.
[14] Lin SH,Wang L,Myles B,et al.Propensity score-based comparison of long-term outcomes with 3-dimensional conformal radiotherapy vs intensity modulated radiotherapy for esophageal cancer〔J〕.Int J Radiat Oncol Biol Phys,2012,84(5):1078-1085.
