局限性肺部磨玻璃影对早期肺癌的诊断价值
2018-05-08刘静
刘 静
肺癌作为临床常见疾病,其病死率居恶性肿瘤的首位,且近年来发病率呈不断上升趋势[1],严重威胁患者的生命健康。虽然进行了大量的肺癌影像学诊断研究,但约75%的肺癌患者确诊时仍进展到晚期。目前肺癌患者的5年总体生存率仅为15%,而Ⅰ期肺癌早期手术切除者其5年生存率可以达到70%以上[2]。近年来随着螺旋CT 在健康人群体检和高危人群肺癌筛查中的广泛使用,肺部局限性磨玻璃密度影(focal ground-glass opacity,fGGO)获得了较高的临床检出[3]。研究显示fGGO与早期肺癌有较密切的关系[4]。fGGO是一种特征性的影像学表现,但却不是肺癌的特异性征象。鉴于Ⅰ期肺癌相对较好的预后,且fGGO对Ⅰ期肺癌的早期诊断研究较少,本研究旨在探讨fGGO在早期肺癌诊断中的应用价值,为肺癌的早期发现和诊断提供参考,进一步改善患者的预后。
1 资料与方法
1.1 一般资料
选择2013年1月至2015年12月在本院行胸部CT示肺部有局限性直径≤5 cm fGGO病灶的患者98例,其中男性66例、女性32例,年龄为33~82岁,平均(58.74±6.21)岁。98例中有吸烟史者37例,合并慢性阻塞性肺病11例,17例有咳嗽、咳痰症状,13例有胸痛、胸闷症状,4例有痰中带血,64例为常规体检时发现,无任何临床症状。全部患者均经过CT 引导下穿刺或手术病理诊断,分为Ⅰ期肺癌组63例与良性病变组35例。
1.2 纳入标准
所有患者的临床资料完整,自愿参加本研究,均签署知情同意书。其中肺癌患者的诊断符合中华医学会肿瘤学分会关于肺癌的诊断与鉴别诊断标准,并根据国际肺癌分期系统将Ⅰ期肺癌分为T1aN0M0、T1bN0M0与T2aN0M0[5]。
1.3 检查方法
选用东芝 AquiLionCX 64排多层螺旋CT,扫描条件为:电压120 Kv,电流250 mA,机架转速0.3 s/圈。患者呈平卧位,从肺尖逐层扫描直至肺底。首先对全肺进行常规扫描,层厚与间隔均为5 mm,发现孤立病灶后对病灶局部进行高分辨率薄层(Thin-section CT)重建,层厚1 mm,间隔0.6 mm。观察窗位为-600 Hu,窗宽1 600~1 800 Hu。
1.4 评价指标
(1)观察胸部CT fGGO的影像学及形态学特征。由2位高年资医师采用双盲法阅片,对病灶的形状、直径、病灶边缘及内部征象进行分析。观察病灶边缘的光滑程度、分叶征、毛刺征、血管集束征与胸膜凹陷征,以及病灶内部是否出现钙化、空洞。意见不一致时请第3位主任医师进行判断,最终获得一致诊断意见。根据fGGO的实性成分含量将其分为单纯型磨玻璃影(pGGO)组与混合型磨玻璃影(mGGO)组。pGGO指完整病灶呈低密度,内可见支气管或血管壁,但完全没有实性组织成分;mGGO指病灶内部可见部分实性组织,且相应部分血管被覆盖。(2)比较胸部CT fGGO诊断Ⅰ期肺癌的灵敏度、特异度、阳性预测值、阴性预测值及诊断一致率。
1.5 统计分析
2 结果
2.1 肺癌病例与良性病变组一般情况
63例Ⅰ期肺癌患者中,男性38例、女性25例;平均年龄(59.23±6.81)岁;其中腺癌52例(82.54%)、鳞癌9例(14.29%)、腺鳞癌2例(3.17%)。35例良性病变患者中,男性18例、女性17例;平均年龄(53.74±7.38)岁;其中炎性假瘤16例(45.71%)、肺囊肿伴曲霉菌感染8例(22.86%)、肺结核7例(20.00%)、肺部炎症4例(11.43%)。2组病例的性别差异无统计学意义(χ2=0.726,P=0.394),年龄差异有统计学意义(t=6.829,P<0.001)。
2.2 不同类型fGGO病灶的恶性率比较
本研究98例患者中,总恶性率为64.29%(63/98)。mGGO组的恶性率为71.21%(47/66),高于pGGO组的50.00%(16/32),差异有统计学意义(χ2=4.224,P=0.040),见表1。

表1 不同类型fGGO病灶的恶性情况/例
2.3 不同分期Ⅰ期肺癌pGGO与mGGO的比较
将63例Ⅰ期肺癌按不同TNM分期分为T1aN0M0、T1bN0M0与T2aN0M0等3组,各TNM组pGGO与mGGO的分布情况如表2,可见随着TNM分期的提高,pGGO的比例呈降低趋势,而mGGO的比例呈升高趋势,差异有统计学意义(χ2=8.056,P=0.018)。

表2 不同分期Ⅰ期肺癌pGGO与mGGO的比较(例,%)
2.4 Ⅰ期肺癌与良性病变fGGO的CT特征比较
比较Ⅰ期肺癌组与良性病变组的CT征象,良恶性肿瘤的fGGO直径分别为(23.37±3.56)mm、(24.13±3.82)mm,差异无统计学意义(t=1.344,P=0.083)。肺癌组fGGO呈不规则形的比例(61.90%)及边界粗糙的比例(85.71%)均高于良性病变组(分别为40.00%、45.71%),差异有统计学意义(P<0.05)。Ⅰ期肺癌组fGGO呈毛刺征(93.65%)、分叶征(74.60%)及血管集束征(80.95%)的比例均高于良性病变组(分别为45.71%、31.43%、51.43%),差异有统计学意义(P<0.05)。2组胸膜凹陷征比例的差异无统计学意义(P>0.05)。而良性病变组fGGO内部空洞(40.00%)和钙化(22.86%)的比例高于Ⅰ期肺癌组(分别为7.93%、4.76%),差异均有统计学意义(P<0.05),见表3。
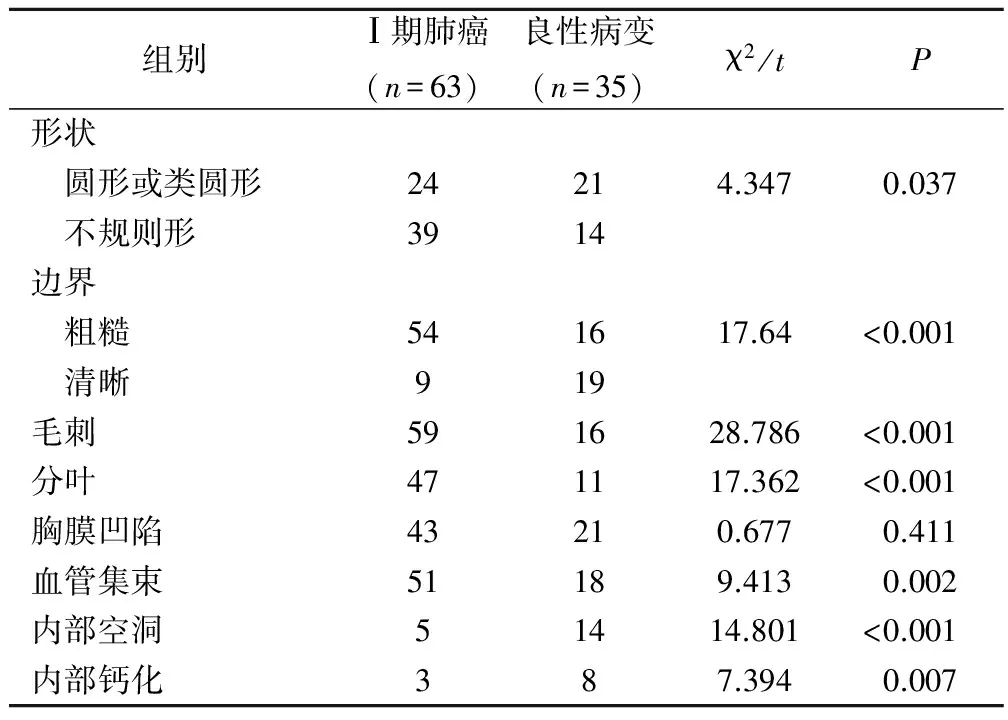
表3 Ⅰ期肺癌与良性病变fGGO的CT特征比较/例
2.5 fGGO诊断Ⅰ期肺癌的准确性
以病理结果为金标准来评价CT fGGO的诊断准确性,本研究共对90例患者获得了正确的诊断,总一致率为91.84%,采用fGGO诊断Ⅰ期肺癌与病理金标准的一致性良好(McNemar配对卡方检验χ2=0.50,P=0.727),Kappa指数为0.824(P<0.01)。依据胸部CT fGGO的表现共对58例Ⅰ期肺癌患者做出正确的诊断,灵敏度为92.06%(58/63),特异度为91.43%(32/35),阳性预测值为95.08%(58/61),阴性预测值为86.49%(32/37)。见表4。

表4 fGGO诊断Ⅰ期肺癌的一致性评价/例
3 讨论
目前CT是早期发现与诊断肺癌的有效方法[6-8],fGGO是肺部CT的一种重要征象,也是肺癌诊断的研究热点。通过CT随访fGGO及相关临床症状的变化有利于患者的明确诊断,大部分肺部良性病变在一段时间后即会出现典型症状或体征,在接受治疗后可消散。然而,肺癌患者早期并无明显临床症状,fGGO可长期持续存在,并随着时间而逐渐增大[9]。这种情况下对患者进行诊断性治疗或给予随访,则有可能使恶性fGGO患者失去早期手术时机。有鉴于此,对于首次发现fGGO的患者,分析其CT fGGO的形态学特征及征象,对于早期识别恶性病灶以指导治疗及改善预后有重要的意义。fGGO是指在高分辨率CT上表现为肺密度轻度增高影,通常呈较为模糊的、无固定的形状的致密状阴影,并且在阴影区仍可显示肺血管及支气管纹理[10]。fGGO的病理基础为部分肺泡萎缩,肺泡壁及隔性间质呈轻至中度变厚,肺泡腔内部分充盈细胞、液体或无定形物质,肺泡间质增厚及终末气管部分充填。任何使肺实质内空气含量下降而又未完全堵塞肺泡的病变如肺癌、真菌感染、肺部炎症、肺纤维化、肺出血等均可形成fGGO。fGGO是一种具有特征性却非特异性的CT影像学表现,研究表明fGGO常常是肺部疾病特别是肺腺癌及细支气管肺泡癌的早期表现。肺癌导致fGGO的主要原因可能为肺泡萎缩及成纤维增生。
根据GGO的影像学分布特征可以分为局限性GGO与弥漫性GGO,局限性GGO较多见于不典型腺瘤样增生、局灶性纤维化、炎症及早期肺癌,它包括pGGO与mGGO两类。目前已明确pGGO与mGGO是同种疾病在不同发展阶段的特征,pGGO没有片状、条状影及实性结节,其病理基础主要为病变组织依肺泡壁浸润生长,起初肺泡内含气比较充盈,不破坏肺泡结构。随病变组织的蔓延增加,逐步导致肺泡结构塌陷,病灶开始向含实性成分的mGGO变化[11]。恶性fGGO多见于早期肺腺癌及细支气管肺泡癌,fGGO 也能由炎症、肺纤维化等良性病变引起,良性病变引发的fGGO约在30%[12]。本研究显示在具有直径≤5 cm fGGO的研究对象中,良性病变比例为35.71%。肺癌临床病理分期与fGGO实性成分含量的多少关系密切,早期肺癌实性成分明显少于晚期肺癌[13]。本研究表明,随着Ⅰ期肺癌TNM分期的提高,pGGO的比例呈降低趋势,而mGGO的比例呈升高趋势,差异有统计学意义,与同类研究结果相似[5],进一步提示如果fGGO病灶中含有实性成分,则其恶性变的可能性较大。本研究中,直径≤5 cm 的fGGO病灶有64.29%的患者经病理证实为Ⅰ期肺癌,与文献报道的fGGO 60%~76%的恶性率比较接近[14]。
本研究总体诊断一致率为91.84%,与金标准相比,诊断一致性良好。灵敏度为92.06%,特异度为91.43%,说明通过fGGO的影像学特征来评价病灶的良恶性,有助于Ⅰ期肺癌的早期诊断。本研究阴性预测值为86.49%,说明利用fGGO进行肺癌的早期诊断时也应注意鉴别诊断,诊断时应对患者的临床资料进行综合评估[15]。本研究显示,Ⅰ期肺癌组fGGO呈不规则形及边界粗糙的比例均显著高于良性病变组(P<0.05),且Ⅰ期肺癌组边缘有毛刺征、呈分叶状及病灶周围有血管集束征的比例均显著高于良性病变组(P<0.05),与黄燕等[5]、Kishi等[16]研究一致。因此,对于fGGO边缘粗糙模糊,出现毛刺征、分叶征或血管集束征等征象提示有很大可能为恶性,应通过肺穿刺活检或手术病理等及时明确诊断。
综上所述,fGGO的影像学表现具有较高的特征性,应根据fGGO病灶的类别、边缘特征及内部结构对其性质进行综合判断,对早期肺癌患者早诊断、早治疗,以提高疗效,改善患者的预后。
[1] 查明元,赵奔英,王 强,等.VATS下肺叶切除与开胸肺叶切除对非小细胞肺癌的疗效分析〔J〕.实用癌症杂志,2013,28(6):659-661.
[2] Frank C,Daniel J,Lynn T.The new lung cancer staging system〔J〕.Chest,2009,136(1):260-271.
[3] 段庆红,焦 俊,赵震奇.局灶性磨玻璃影的周围型小肺癌的影像学与病理学对照研究〔J〕.贵阳医学院学报,2010,35(5):501-503.
[4] Moon Y,Lee KY,Moon SW,et al.Sublobar resection margin width does not affect recurrence of clinical N0non-small cell lung cancer presenting as GGO-predominant nodule of 3 cm or less〔J〕.World J Surg,2017,41(2):472-479.
[5] 黄 燕,王佑娟,王威亚,等.局限性磨玻璃影在Ⅰ期肺癌中的诊断价值〔J〕.四川大学学报(医学版),2014,45(2):316-319.
[6] 谭春明.磨玻璃影肺癌CT 特征分析〔J〕.实用医技杂志,2015,22(10):1053-1054.
[7] 唐汉军,姚 尉,张晓林,等.多层螺旋CT灌注成像在肺癌病理分型中的应用〔J〕.实用癌症杂志,2014,29(5):555-557.
[8] 华红伟,倪裕丰,王永杰,等.低剂量螺旋CT对肺癌高危人群早期筛查的临床研究〔J〕.实用癌症杂志,2016,31(4):558-560,563.
[9] Hasegawa M,Sone S,Takashima S,et al.Growth rate of s-mall lung cancers detected on mass CT screening〔J〕.Br J Radiol,2000,73(876):1252-1259.
[10] 刘 冰,米瑞华,魏旭东,等.以磨玻璃影为首发改变的血液肿瘤伴肺部感染患者临床特征分析〔J〕.中华医学杂志,2016,96(3):163-166.
[11] 沈 亮,黄海涛.局限性肺部磨玻璃影在早期肺癌诊治中的意义〔J〕.同济大学学报(医学版),2013,34(1):88-90,95.
[12] Nakata M,Saeki H,Takata I,et al.Fofal ground grass opacity detected by low-dose helical CT〔J〕.Chest,2002,121(5);1464-1467.
[13] Takashima S,Maruyama Y,Hasegawa M,et al.CT findings and progression of small peripheral lung neoplasms having a replacement growth pattern〔J〕.Am J Roentgenol,2003,180(3):817-826.
[14] Li F,Sone S,Abe H,et al.Malignant versus benign nodules at CT screening for lung cancer of thin-section CT findings〔J〕.Radiology,2004,233(3):793-798.
[15] 宋继龙,郭旺明.多层螺旋CT在肺部磨玻璃影良恶性鉴别诊断中的应用价值〔J〕.中国医学装备,2014,11(7):47-49.
[16] Kishi K,Homma S,Kurosaki A,et al.Smal lung tumors with the size of 1cm or less in diameter:clinical,radiological,and histopathological characteristics〔J〕.Lung Cancer,2004,44(1):43-51.
