紫杉醇联合卡铂化疗方案对中晚期宫颈癌患者免疫功能及血清SCC-Ag、TSGF水平的影响
2018-05-08李好山王军海
李好山 王军海 田 君
宫颈癌是最常见的恶性妇科肿瘤之一,传统的治疗手段采用手术治疗[1]。早期宫颈癌患者肿瘤体积小,预后情况比较良好,5年生存率达到85%以上;而中晚期患者肿瘤易发生转移,5年生存率降低至51%~72%[2]。因此临床上对于提高宫颈癌治疗的疗效,改善患者的生存质量显得尤为重要。目前有研究报道紫杉醇与铂类药物合用治疗中晚期宫颈癌,取得了理想的疗效,患者预后情况好,因此已经迅速成为了目前治疗宫颈癌的有效化疗方案之一[3]。大量研究发现,肿瘤标记物在肿瘤细胞的生长,转移,浸润中发挥着重要作用[4]。肿瘤特异性生长因子(tumor specific growth factor,TSGF)是多数与肿瘤生长转移相关的代谢物质的总称。TSGF在多种恶性肿瘤的早期诊断中敏感性高,被认为是1种理想的早期肿瘤辅助诊断指标。近年来在宫颈癌的检测中发挥着重要作用。鳞状细胞癌相关抗原(squamous cell carcinoma associated antigen,SCC-Ag)是1种宫颈癌诊断的肿瘤标志物。本研究旨在观察紫杉醇联合卡铂新型辅助化疗方案治疗中晚期宫颈癌患者的疗效以及对患者免疫功能及血清SCC-Ag,TSGF水平的影响。
1 材料与方法
1.1 一般资料
选取2014年5月至2016年4月收治我院肿瘤科的90例中晚期宫颈癌患者。纳入标准:①经组织活检病理确诊为中晚期宫颈癌;②患者未经过手术治疗,放化疗等治疗;③患者无其他恶性肿瘤病史;④患者病历资料完整;⑤患者无肝肾功能等重要脏器损伤;⑥Karnofsky功能评分>70分;⑦患者随访时间超过6个月。患者的临床分期采用国际妇产科联盟(FIGO)2009年的分期标准,肿瘤细胞的分级采用世界卫生组织(WHO)的分级标准。所有患者随机分为观察组和对照组各45例。观察组中男性27例,女性18例,年龄34~65岁,平均(52.18±16.39)岁,其中ⅠB1期16例,ⅠB2期9例,ⅡA期10例,ⅡB期4例,ⅢB期4例,ⅣA期1例,ⅣB期1例,病理分型:鳞癌34例,腺癌9例,腺鳞癌2例。对照组中男性25例,女性20例,年龄32~67岁,平均(53.34±15.91)岁,其中ⅠB1期17例,ⅠB2期10例,ⅡA期12例,ⅡB期3例,ⅢB期3例,ⅣA期1例,ⅣB期1例,病理分型:鳞癌36例,腺癌7例,腺鳞癌2例。两组患者在性别,年龄,临床分期和病理分型等方面差异不具有统计学意义(P>0.05),具有可比性。本研究获得本院医学伦理委员会批准,所有患者及家属均已签署知情同意书。
1.2 治疗方法
观察组患者第1天紫杉醇125 mg/m2+第2天卡铂80 mg/m2,3周为1个疗程,治疗2个疗程以上。在应用紫杉醇治疗前一天患者应当口服氟美松,3.5 mg/次,早晚各1次,连续服用3天;患者化疗前肌注异丙嗪20 mg和静脉注射氟美松10 mg。对照组患者采用伊立替康60 mg/m2与卡铂60 mg/m2分别溶于生理盐水500 ml中,静脉滴注,3周为1个疗程,治疗2个疗程以上。观察组与对照组患者在治疗1周后采集血液进行血常规检测,如果患者血液白细胞水平降低到4.0×109/L,应当立即应用集落细胞刺激因子处理,更为严重的血小板减少与贫血患者应当进行输血处理。在患者化疗期间均需要进行常规的保肝,止吐等治疗,每周对患者进行血常规,心电图和肝肾功的检测,同时记录治疗过程中出现的不良反应。
1.3 观察指标
1.3.1 疗效比较 根据WHO提出的对实体肿瘤治疗效果的评价标准,患者近期疗效可以分为:完全缓解(CR),肿瘤病灶完成消失;部分缓解(PR),肿瘤病灶体积减小≥50%;稳定(SD),肿瘤病灶体积减小<50%;进展(PD),肿瘤病灶体积增加>25%或者出现了转移病灶。有效率(RR)=完全缓解(CR)+部分缓解(PR)
1.3.2 免疫功能及血清指标的比较 分别采集两组患者治疗前后的清晨空腹肘静脉血液3 ml,经2 500 r/min离心10 min后,收集上清液-80 ℃冰箱保存待测。应用流式细胞仪(美国BD公司)测定患者血液中CD3+、CD4+、CD8+的水平,同时计算CD4+/CD8+的比值;采用电化学发光法检测血清中SCC-Ag和TSGF的水平,SCC-Ag和TSGF检测的试剂盒购置美国雅培公司,所有实验操作严格按照试剂盒上说明书进行。
1.3.3 生存质量调查量表(quality oflife questionnaire-core30,QLQ-C30) 采用欧洲癌症研究和治疗组织(EORTC)提出的QLQ-C30量表对两组患者治疗前以及治疗2个疗程后的生存质量进行评分。QLQ-C30量表分为功能量表和症状量表两大类。其中功能量表包括躯体功能,认知功能、情绪功能、角色功能和社会功能5个方面,症状量表包括疲乏,食欲减退和疼痛3个方面。功能量表的评分越高代表患者的生存质量越好,症状量表的评分越高则代表患者的生存质量越差。
1.4 随访情况
对观察组与对照组患者治疗结束后进行定期的随访,随访的形式不限,可以为电话、书信和门诊复查等。患者治疗的第一年期间对患者每3个月进行一次随访,第二年对患者每6个月进行一次随访。主要的内容有:妇科检查,盆腔超声,胸部X线和阴道细胞学检查等。
1.5 统计学方法
应用SPSS 22.0软件对研究数据进行数据处理。计量资料均用均数±标准差表示,组间的比较采用t检验;计数资料以率(%)表示,组间的比较采用卡方检验;以P<0.05为差异具有统计学意义。
2 结果
2.1 观察组与对照组疗效的比较
观察组中没有完全缓解患者,部分缓解者29例,有效率为64.44%;对照组中没有完全缓解患者,部分缓解者21例,有效率为46.67%。与对照组相比,观察组的疗效更高,差异具有统计学意义(χ2=9.238,P=0.002)。见表1。

表1 两组患者临床疗效的比较(例,%)
2.2 两组患者治疗前后免疫功能的影响
观察组与对照组患者经药物治疗后CD3+、CD4+和CD4+/CD8+水平明显升高,而CD8+水平降低,与同组中患者治疗前比较,差异具有统计学意义(P<0.05);而与对照组治疗后相比,观察组治疗后CD3+、CD4+和CD4+/CD8+水平升高更加显著,CD8+降低也更显著(P<0.05)。见表2。
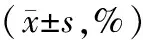
表2 两组患者治疗前后免疫功能的影响
注:与同组治疗前比较,△为P<0.05;与对照组治疗后比较,▲为P<0.05。
2.3 两组患者治疗前后血清中SCC-Ag、TSGF水平的比较
观察组与对照组患者治疗后血清中SCC-Ag、TSGF水平出现下降,与同组患者治疗前相比,差异具有统计学意义(P<0.05);与对照组治疗后比较,观察组治疗后血清中SCC-Ag、TSGF水平更低,差异具有统计学意义(P<0.05),见表3。

表3 两组患者治疗前后血清中SCC-Ag、TSGF水平的比较
注:与同组治疗前比较,△为P<0.05;与对照组治疗后比较,▲为P<0.05。
2.4 两组患者治疗前后生存质量评分的比较
观察组与对照组患者经药物治疗后躯体功能、情绪功能和社会功能评分明显升高(P<0.05),而患者的认知功能和角色功能无差异性改变(P>0.05);患者疲乏、食欲减退和疼痛等症状评分明显低于治疗前(P<0.05);观察组躯体功能、情绪功能、社会功能、疲乏、食欲减退和疼痛方面较对照组更好,差异具有统计学意义(P<0.05),见表4。
2.5 两组患者不良反应情况比较
观察组患者经治疗后出现胃肠道反应、骨髓抑制、血小板下降和白细胞下降等不良反应发生率低于对照组,差异具有统计学意义(P<0.05);而呼吸困难发生率与对照组比较,差异无统计学意义(P>0.05)。见表5。
3 讨论

表4 两组患者治疗前后生存质量评分的比较
注:与同组治疗前比较,△为P<0.05;与对照组治疗后比较,▲为P<0.05。

表5 两组患者不良反应情况比较(例,%)
宫颈癌是临床上较为常见的生殖道恶性肿瘤,在全世界的发病率和死亡率极高,并且呈现逐年上升的趋势[4]。临床上关于宫颈癌的治疗手段主要有手术治疗,放化疗和激素治疗等。大部分的研究报道宫颈癌对绝大多数化疗药物的敏感性低,有效率低于15%[5]。中晚期的宫颈癌患者肿瘤细胞比较容易侵袭和转移,导致患者的治疗效果不佳,容易复发和预后较差。随着如今化疗药物的不断发展,化疗已经成为了治疗宫颈癌最重要的手段。
紫杉醇是1种通过促进微管蛋白的合成,抑制微管有丝分裂的进行,从而阻断肿瘤细胞的增殖与分化[6]。向华国等[7]的研究发现,紫杉醇治疗鳞状细胞型宫颈癌具有很好的临床疗效。铂类药物是临床上最常用的抗肿瘤药物。其主要的机制是通过与DNA形成交联,抑制DNA的复制与转录。有研究报道,当顺铂单独用于治疗宫颈癌时,治疗有效率在23%~50%,当顺铂与紫杉醇联合用药时,可以减小肿瘤病灶的体积,并且两药之间不会有交叉耐药现象的产生[8]。Zhang等[9]的研究同样证实,紫杉醇能够诱导宫颈癌HeLa细胞的凋亡,抑制肿瘤细胞的增殖,与顺铂药物联用时作用更加明显。李雪梅等[10]的研究也发现紫杉醇与顺铂联合用于宫颈癌治疗能够有效降低顺铂治疗过程中带来的不良发硬,同时能够协同作用增强临床疗效。本研究中通过紫杉醇联合卡铂治疗中晚期宫颈癌,结果发现药物治疗后观察组患者的临床疗效和生存质量评分均高于对照组,提示紫杉醇与卡铂联合用药治疗中晚期宫颈癌具有明确的治疗效果,该结果与上述观点一致。在本研究中同样观察了紫杉醇联合卡铂治疗宫颈癌的不良反应例如胃肠道反应,骨髓抑制,血小板下降和白细胞下降等,但其发生率都明显低于对照组。治疗过程中药物所带来的不良反应会导致患者的依从性降低,进而影响患者的治疗效果以及生存质量。因此紫杉醇与卡铂药物联用在治疗中晚期宫颈癌过程中的不良反应情况更具优势。
TSGF是多种参与肿瘤细胞增殖,浸润和转移有关的代谢物质的统称,与肿瘤发生发展以及预后有着密切关系[11]。有研究发现TSGF在乳腺癌,胃癌等众多恶性肿瘤中均存在高表达[12-13]。有研究报道,TSGF在宫颈癌其他肿瘤标记物改变之前就会明显升高,而且对宫颈癌的早期诊断较为敏感[14]。SCC-Ag是宫颈癌早期最常用的诊断指标,是1种特异性的鳞状细胞癌的肿瘤标记物,对众多鳞状上皮细胞起源的恶性肿瘤例如食管癌[15],肺癌[16],胃癌[17]等的诊断具有重要的价值。有研究报道SCC-Ag升高与宫颈癌肌层浸润深度和淋巴结的转移密切相关[18]。在本研究中,观察组与对照组患者治疗前的SCC-Ag与TSGF呈高表达,经药物治疗后,两组患者血清中SCC-Ag与TSGF的水平明显减低(P<0.05);与对照组治疗后相比,观察组患者血清中SCC-Ag与TSGF水平下降更为明显(P<0.05),提示血清中SCC-Ag与TSGF的水平变化对宫颈癌的诊断具有重要的临床价值,有待进一步的研究。有研究显示,宫颈癌患者的免疫功能低下是造成化疗效果不佳的重要原因之一,甚至有些患者无法承受化疗所带来的不良反应从而被迫放弃治疗[19]。本研究显示观察组患者经药物治疗后CD3+,CD4+和CD4+/CD8+升高与CD8+降低幅度较正常组更大(P<0.05),说明紫杉醇联合卡铂可以促进肿瘤周围免疫反应的产生,增强抗肿瘤作用。
综上所述,紫杉醇联合卡铂治疗中晚期宫颈癌可以改善患者的免疫功能,降低血清SCC-Ag与TSGF的水平,提高患者的生存质量,具有有效率高,不良反应少的特点,对于临床上宫颈癌的治疗具有重要参考价值。
[1] Alexandre E,Sebastien G,Renaud M,et al.Outcome of early stage cervical cancer patients treated according to a radiosurgical approach:Clinical results and prognostic factors〔J〕.Gynecol Oncol,2017,144(3):541-546.
[2] Fajardo-Ramirez OR,Barboza-Cerda MC,Ortiz-Lopez R,et al.Prevalence and 3-year persistence of human papillomavirus serotypes in asymptomatic patients in Northern Mexico〔J〕.Int J Gynaecol Obstet,2017,136(1):40-46.
[3] 曹玉梅.宫颈癌Ⅰb2-Ⅱb期术前全身新辅助化疗的疗效观察〔J〕.中南医学科学杂志,2011,7(1):86-88.
[4] Sobczyk K,Wozniak-Holecka J,Holecki T,et al.The organization and financing of cervical cancer prevention carried out by midwives in primary health care〔J〕.Ginekol Pol,2016,87(12):798-804.
[5] 曾 威,徐文生,徐 红,等.宫颈癌根治术中加行腹主动脉旁淋巴结切除在ⅠB2及ⅡA2期宫颈癌治疗中的临床价值〔J〕.实用妇产科杂志,2013,29(3):206-210.
[6] 鲍业忠,祁德安,张 力,等.多西紫杉醇和米托蒽醌治疗激素抵抗性前列腺癌的效果观察〔J〕.临床医学研究与实践,2016,1(17):91-92.
[7] 向华国,丘敏梅,欧雪峰,等.女性人乳头状瘤病毒与沙眼衣原体、解脲脲原体及淋病奈瑟氏菌感染的相关性〔J〕.中国皮肤性病学杂志,2013,12(7):670-672.
[8] 张 蓉,李 斌,白 萍,等.紫杉醇联合铂类在局部晚期宫颈癌新辅助化疗中的应用〔J〕.中华肿瘤杂志,2011,33(8):616-620.
[9] Zhang F,Fei J,Sun M,et al.Heparin modification enhances the delivery and tumor targeting of paclitaxel-loaded N-octyl-N-trimethyl chitosan micelles〔J〕.Int J Pharm,2016,511(1):390-402.
[10] 李雪梅.小剂量紫杉醇联合顺铂周疗方案治疗宫颈癌70例的疗效观察〔J〕.贵阳中医学院学报,2013,35(4):101-102.
[11] Yin LK,Sun XQ,Mou DZ.Value of Combined Detection of Serum CEA,CA72-4,CA19-9 and TSGF in the Diagnosis of Gastric Cancer〔J〕.Asian Pac J Cancer Prev,2015,16(9):3867-3870.
[12] 郭续胜,邢业兰,郭 丽,等.BXTM联合TSGF检测诊断恶性肿瘤的临床研究〔J〕.山东医学高等专科学校学报,2012,34(5):335-337.
[13] 陈 进,章 烨.乳腺癌患者手术治疗前后血清IGF-Ⅱ和TSGF检测的临床意义〔J〕.中国老年学杂志,2012,32(8):1733-1734.
[14] 葛 瑜,张 林,徐敬云.血清TSGF、CA125、CA19-9联合SCC检测在老年宫颈癌诊断中的价值〔J〕.中国老年学杂志,2016,36(21):5358-5360.
[15] 孙 楠.食管癌患者围术期血清SCC-Ag、D-D、MICA及外周血T淋巴细胞亚群变化规律研究〔J〕.海南医学院学报,2013,19(5):642-643.
[16] 姜会萍.肺癌患者血清SCC-Ag和VEGF-C检测及临床意义〔J〕.山东医药,2012,52(15):69-70.
[17] Messager M,de Steur WO,van Sandick JW,et al.Variations among 5 European countries for curative treatment of resectable oesophageal and gastric cancer:A survey from the EURECCA Upper GI Group (EUropean REgistration of Cancer CAre)〔J〕.Eur J Surg Oncol,2016,42(1):116-122.
[18] 赵德英,张 惠,方红艳,等.SCC-Ag与宫颈癌临床病理特征的相关性及对淋巴结转移的预测价值〔J〕.武汉大学学报(医学版),2016,37(5):777-781.
[19] 高 琴,张丹丹,白 帆,等.紫杉醇联合铂类方案治疗中晚期宫颈癌患者的临床疗效及对血清CYFRA21-1、SCC-Ag的影响〔J〕.疑难病杂志,2015,8(1):53-56.
