2016年上海地区肌酐、尿酸、尿素正确度验证结果分析
2018-05-08金中淦唐立萍虞啸炫刘文彬欧元祝
金中淦, 居 漪, 李 卿, 唐立萍, 虞啸炫, 刘文彬, 欧元祝
(上海市临床检验中心,上海 200126)
虽然目前与临床疾病相关的新的检测标志物层出不穷,但肌酐(creatinine,Cr)、尿酸(uric acid,UA)、尿素(urea,Urea)这3项指标仍是临床实验室常规且实用的检测指标,对于与肾脏疾病、心脑血管疾病相关的高尿酸血症等具有重要的临床价值,因此这些项目的准确检测对临床疾病的诊断及监测具有重要意义。上海市临床检验中心于2014年在上海地区开展包括Cr、UA、Urea的小分子正确度验证计划,用以评价临床实验室检测结果的正确度。本研究通过分析2016年上海地区小分子正确度验证计划的数据,了解目前上海地区Cr、UA、Urea检测的质量状况。
1 材料和方法
1.1 材料
1.1.1 小分子正确度调查样本 样本编号分别为2016A、2016B,均为上海市东方医院检验科检测后剩余的新鲜血清样本(肉眼可见溶血和脂血样本排除在外),离心过滤后分装(0.5 mL/支),每个水平各3支。按照中国合格评定国家认可委员会(China National Accreditation Service for Conformity Assessment,CNAS)GL03《能力验证计划样品均匀性和稳定性评价指南》要求评估调查品的均一性和稳定性。
1.1.2 研究对象 参加2016年度小分子正确度调查的二级甲等及以上医院临床实验室以及独立实验室共70家。
1.1.3 标准物质 (1)正确度控制物为美国国家标准技术研究院(the National Institute of Standards and Technology,NIST)SRM 909c,材料为冰冻血清,-70 ℃保存,按说明平衡至室温后使用;(2) Cr纯品标准物质为NIST SRM 914a,纯度为99.7%,不确定度为±0.3%;d3-Cr标记物购自美国剑桥同位素实验室,同位素丰度为98 ℃;(3)UA纯品标准物质为 NIST SRM 913a,纯度为99.6%,不确定度为0.1%;UA标记物为1,3-15N2(丰度>98atom%,加拿大CDN Isotopes公司);(4)Urea标准物质为NIST SRM 9l2a,纯度为99.9%,不确定度为0.1%;Urea标记物为13C、15N2(美国剑桥同位素实验室),纯度>98%。Cr、UA、Urea纯品标准物质用作参考方法赋值过程中制备校准品。
1.2 仪器与试剂
Agilent 1290超高效液相色谱仪(美国Agilent公司)、API 5000串联三重四极杆质谱仪(美国AB sciex公司),Agilent G7000B气相质谱仪(美国Agilent公司)、XP205天平(德国梅特勒-托利多公司)、Thermo Reacti-Therm干浴氮吹仪(美国赛默飞科技公司)。乙酸铵(色谱级)、乙腈(质谱级)、乙酸、无水乙醇等试剂均购自美国Fisher公司,试验用水由Milli Q纯水仪(美国密理博公司)制备。
1.3 方法
1.3.1 正确度样本处理 将3套共6支样本(2016A、2016B各3支)通过冷链系统运输到各临床实验室,保证样本在运输过程中处于冰冻状态。临床实验室收到样本后立即将其存放在-70 ℃冰箱或-20 ℃冰箱中,在保证当日室内质控在控的前提下,按照各实验室自己的标准操作规程测定样本,每个项目每个浓度重复测定2次,记录测定结果,如Cr-2016A需回报6个数据。将检测仪器、方法原理、试剂等信息通过网络回报。检测剩余样本按照生物安全要求进行处理。
1.3.2 参考方法检测样本 参照检验医学溯源性联合委员会(the Joint Committee for Traceability in Laboratory Medicine, JCTLM) 公布的参考方法,建立本实验的参考方法。 Cr 、UA采用同位素稀释液相色谱串联质谱法(isotope dilution liquid chromatography tandem mass spectrometry,ID-LC/MS/MS),Urea采用同位素稀释气相色谱串联质谱法(isotope dilution gas chromatography tandem mass spectrometry,ID-GC/MS/MS)。采用重量法加样、包括法计算样本浓度[1-6]。所有样本、校准物、正确度质控物均重复测定3个批次,计算均值作为最终结果。
1.4 评价标准
评价标准采用WS-T403—2012《临床化学检验常规项目分析质量指标》,Cr的偏移≤5.5%,室内变异系数(coefficient of variation,CV)≤4.0%; UA的偏移≤4.5%,CV≤4.5%;Ur的偏移≤3.0%,CV≤3.0%[5]。
1.5 统计学方法
使用上海市临床检验中心的室间质评管理平台进行数据的统计处理,以每个样本的均数为统计值,分析所有回报结果的临床实验室3个项目的室内CV、偏移及按不同系统分组后的CV、偏移。
2 结果
2.1 正确度样本赋值结果
用参考方法为正确度调查样本赋值的结果分别为142.16 μmol/L(Cr-2016A)、304.27 μmol/L(Cr-2016B)、351.14 μmol/L(UA-2016A)、581.58 μmol/L(UA-2016B)、7.94 mmol/ L(Urea-2016A)、15.63 mmol/L(Urea-2016B)。每个数据均为连续测定3批,每批重复测定3次以上的结果均值。每批分析过程中同时测定NIST SRM 909c,其检测结果在靶值±不确定度范围内,则本次实验结果有效。见表1。

表1 参考方法测定NIST SRM 909c的结果
2.2 正确度调查结果分析
2.2.1 不同仪器系统组的偏移及组内不精密度分析 按仪器进行分组,不同仪器组Cr-2016A测定结果与靶值的偏移为-5.54%~0.62%,90%(9/10)的检测系统偏移满足行业标准中的允许偏移,CV为1.71%~6.25%;Cr-2016B测定结果与靶值的偏移为-5.34%~2.89%,100%(10/10)的检测系统偏移满足行业标准中的允许偏移,CV为0.92%~4.74%;UA-2016A测定结果与靶值的偏移为-1.43%~2.62%,100%(10/10)的检测系统偏移满足行业标准中的允许偏移,CV为0.54%~4.72%;UA-2016B测定结果与靶值的偏移为-1.49%~3.73%,100%(10/10)的检测系统偏移满足行业标准中的允许偏移,CV为0.85%~3.84%; Ur-2016A测定结果与靶值的偏移为-1.74%~0.81%,100%(10/10)的检测系统偏移满足行业标准中的允许偏移,CV为1.24%~4.98%;Ur-2016B测定结果与靶值的偏移为-0.08%~1.16%,100%(10/10)的检测系统偏移满足行业标准中的允许偏移,CV为0.53%~4.15%。见表2。

表2 不同仪器组检测均值与靶值的偏移、CV分析 (%)
2.2.2 单个实验室的偏移及室内不精密度 对单个实验室数据进行分析,实验室内部3个项目6个检测结果的室内CV及与靶值的相对偏移见图1、图2。根据CrCV≤4.0%、UACV≤4.5%、UrCV≤3.0%的标准[5],Cr-2016A、Cr-2016B、UA-2016A、UA-2016B、Urea-2016A、Urea-2016B分别有4.29%(3/70)、2.86%(2/70)、0.00%(0/70)、1.43%(1/70)、8.57%(6/70)、7.14%(5/70)的实验室超过行业标准的要求。以参考方法定值结果为靶值,并以《临床化学检验常规项目分析质量指标》(WS/T 403—2012)中偏移的标准[7]评价回报结果的实验室的不合格率,结果见表3。

图1 单个实验室3个项目6个检测结果的室内CV

图2 单个实验室3个项目6个检测结果与靶值的偏移
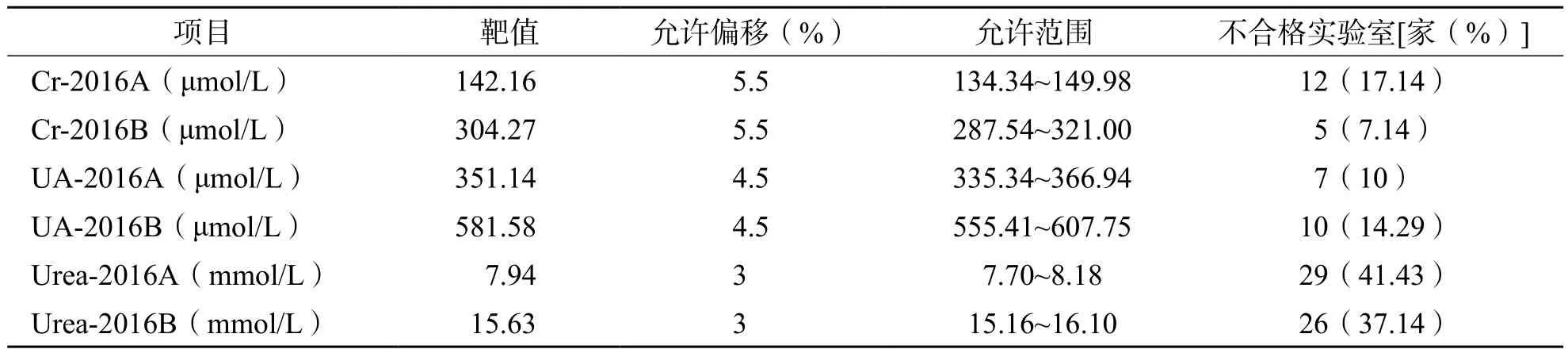
表3 正确度调查不合格率分析
3 讨论
和常规室间质评相比,正确度验证是一种比较理想的质评方法,其使用的样本和临床患者样本接近,实验室采用多次重复检测,样本的指定值采用参考方法测定,不受基质效应、方法特异性等因素的影响,有助于标准化进程的推进。上海市临床检验中心生化实验室的参考方法经过这几年的运行,每年参加国际、国内参考实验室比对,并通过了ISO 15195参考实验室认可,证明其检测能力准确可靠,为开展正确度验证工作提供了保障。目前,多家临床检验中心在开展正确度验证计划,为临床实验室的质量管理和改进提供多种选择。
本研究分析了上海地区2016年度小分子正确度验证结果,按仪器进行分组分析,Cr-2016A、Cr-2016B、UA-2016A、UA-2016B、Urea-2016A、Urea-2016B测定结果与靶值的偏移分别为-5.54%~0.62%、-5.34%~2.89%、-1.43%~2.62%、-1.49%~3.73%、-1.74%~0.81%、-0.08%~1.16%,总体情况较好。在测定方法的CV方面,实验室内CV的中位数均在1%左右,表明上海地区大多数实验室检测结果具有较好的精密度,优于全国调查的结果[8]。
正确度是指多次测量均值与靶值(参考值)的接近程度,一般用偏移来评价。从单个实验室检测结果的偏移来看,2个批号样本Cr的不合格率分别为17.14%、7.14%,UA的不合格率分别为10.00%、14.29%,Urea的不合格率分别为41.43%、37.14%,表明部分实验室的正确度还需改进,其标准化程度还不够。Cr的情况好于张传宝等[8]的研究结果,而Urea的情况与他们的研究结果较接近,存在大量偏移不合格的实验室。当临床实验室未能通过正确度验证时,一般要从校准品入手查找问题,如校准品的定值是否存在问题,或是否使用了无溯源性的非配套标准品;另外,应注意实验室使用的检测方法是否具有特异性,试剂是否在有效期内以及人员、设备问题,逐一排查,发现问题并加以改进。
Urea出现的高不合格率情况应引起注意。对于评价标准的制定,国际临床化学和检验医学联合会组织的国际参考实验室比对制定的Cr、UA、Urea的允许偏移分别为5%、3.25%、5%。国家卫生计生委临床检验中心组织的临床检验室间质评计划中正确度验证制定的Cr、UA、Urea的允许偏移分别为6%、6%、4%[10],比国际标准中的偏移标准稍宽松。因此,我们目前评价采用的标准是否适用还需要在实际工作中加以验证。因此对于质评机构来说,一个合适的评价标准的确定是至关重要的,需要在实践中不断探索。
[1]WS/T 414—2013 血清肌酐测定参考方法-同位素稀释液相色谱串联质谱法[S].北京:中华人民共和国国家卫生和计划生育委员会,2013.
[2]DAI X,FANG X,YANG M,et al. Application of liquid chromatography/LTQ linear ion trap mass spectrometry for quantifying the biomarkers creatinine and cortisol in serum[J]. Anal Lett,2008,41:2912-2922.
[3]金中淦,居漪,唐立萍,等. 血清肌酐参考方法的建立及其在正确度调查中的应用[J]. 检验医学,2015,30(11): 1070-1073.
[4]DAI X,FANG X,ZHANG C,et al. Determination of serum uric acid using high-performance liquid chromatography (HPLC)/isotope dilution mass spectrometry (ID-MS) as a candidate reference method[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2007,857(2):287-295.
[5]KESSLER A,SIEKMANN L. Measurement of urea in human serum by isotope dilution mass spectrometry: a reference procedure[J]. Clin Chem,1999,45(9):1523-1529.
[6]金中淦,居漪,唐立萍,等. 尿素参考方法建立及在正确度验证中的应用[J]. 临床检验杂志,2016,34(12):897-900.
[7]WS-T403—2012 临床化学检验常规项目分析质量指标[S]. 北京:中华人民共和国国家卫生和计划生育委员会,2013.
[8]张传宝,赵海建,马嵘,等. 三种外部质量评价计划对实验室血清肌酐和尿素分析质量的作用[J]. 中华检验医学杂志,2014,37(5):371-375.
[9]卫生部临床检验中心. 2017年临床检验室间质量评价计划书[EB/OL]. (2016-05-01)[2016-12-30].http://www.clinet.com.cn/plan/type=list&classid=13 84&years=2017&labcenterid=11.
